您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-11-06 09:05
前 言
药物代谢,又称生物转化(Biotransformation),是指药物作为外源性的物质在体内发生化学结构改变的过程。常规小分子的药物代谢研究,通常关注代谢途径、代谢产物种类、参与代谢的酶、代谢速率以及代谢种属差异等。代谢研究的内容非常丰富,也为理解机体对药物的处置过程提供了关键信息。对于手性药物,由于手性现象的存在,其代谢研究具有其特殊性。
以R和S代表手性药物的一对对映异构体。手性药物代谢可能存在两种情况:一种情况是R或S自身分别代谢,可能存在代谢速率差异或种属差异,也可能对外消旋体治疗效果产生影响;另一种情况是手性药物可能发生特有的代谢方式-手性反转(Chiral inversion),即可从一个对映异构体转变为其镜像对映异构体。手性反转研究是手性药物开发非常关键的内容,尤其是在药物早期研发阶段,需要关注手性药物的手性反转特性,避免影响手性药物研发方向。

图1. 手性药物立体选择性代谢
1、对映异构体自身代谢
1、一对对映异构体的代谢存在代谢速率差异和种属差异。
表1是一些上市药物的一对对映异构体(标示为R和S构型),研究者分别在体外代谢体系中测定清除率,并计算清除率的相对比值[1]。若清除率比值大于或小于1,说明这对对映异构体代谢速率存在差异。从数据可以看出,这些药物R构型和S构型的体外代谢清除率存在明显差异,最高差异可达8.88倍。假如以消旋体给药,R构型和S构型的体内暴露量可能存在较大差异。此外从表格数据可以看到,非洛地平的一对对映异构体在不同种属肝微粒体中,清除率比值也存在差异,在人肝微粒体中R构型代谢快于S构型,但在大鼠和犬肝微粒体中S构型代谢快于R构型,说明其代谢存在种属差异。
表1. 一对对映异构体药物在体外代谢体系中的清除率比值[1]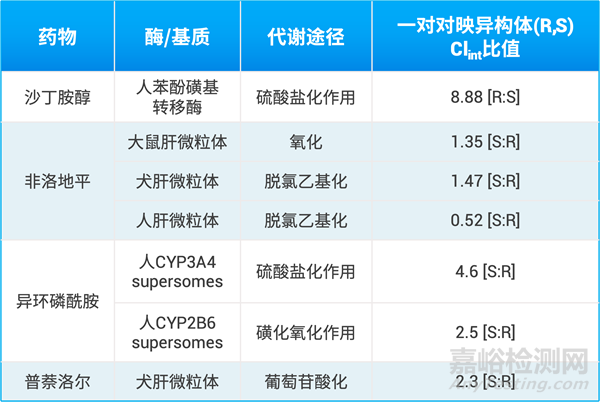
2、一对对映异构体的立体选择性代谢可对外消旋体的治疗效果产生影响。
异环磷酰胺(Ifosfamide)与剂量相关的主要副作用之一是尿毒性,由脱氯甲基化(Dechloromethylation)的分解产物引起。脱氯甲基化途径是产生有效成分的4-羟基化途径(4-hydroxylation)的竞争代谢途径。生成活性的4-羟基化代谢产物时,R-异环磷酰胺生成率比S-异环磷酰胺快3倍。产生毒性的脱氯甲基化代谢产物时,S-异环磷酰胺内在清除率比R-异环磷酰胺高4.6倍。因此,R-异环磷酰胺的代谢谱比S-异环磷酰胺更理想,可更好地产生积极治疗效果[2]。
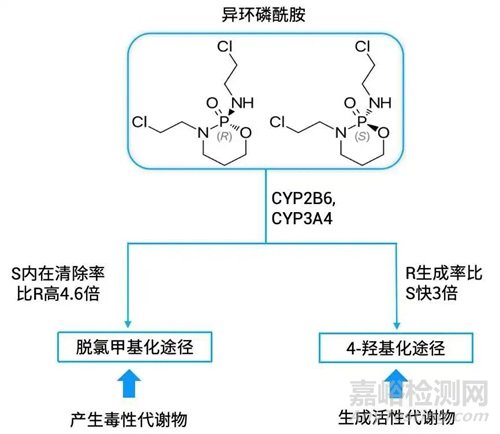
图2. 异环磷酰胺的立体选择性代谢
2、手性反转(Chiral inversion)评估考量
手性反转是一个对映异构体转化为其镜像对映异构体的过程,此过程可能影响药效甚至产生毒性对映异构体,多个手性药物相关指导文件中提到需要关注手性反转[3-5]。我们可通过以下几个问题来了解手性反转。
1、手性反转有方向性吗?
手性反转有方向性,大多是单向,少数是双向。2-芳基丙酸类非甾体抗炎药是容易发生手性反转的一类药物。以布洛芬为例,R-型布洛芬可以转化为S-型布洛芬,但S型不能转化为R型[6]。S型布洛芬是布洛芬中主要起药效的对映异构体,它可以以更低的剂量获得和外消旋布洛芬相当的疗效。
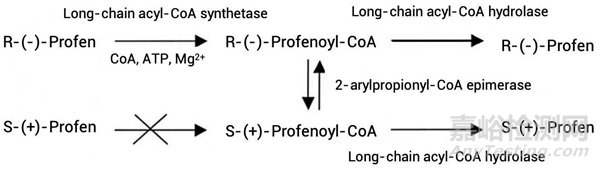
图3. 布洛芬手性反转的方向性[6]
2、所有手性药物都会发生手性反转吗?
不是所有手性药物都会发生手性反转,与结构相关。有文献提到结构与手性反转的关系特点:甲基α-碳上的烷基取代基的大小和手性中心甲基的存在至关重要[6]。
3、手性反转都是酶促吗?
影响手性反转因素较多,常规认为生物因素(如酶、组织类型、种属等)可能导致手性反转。在生物学过程中,酶、受体和其它结合分子可将对映异构体识别为不同的分子实体,因为它们与结合位点的解离常数不同,从而导致不同的行为和相应的药理反应差异[7-9]。但是一些非生物因素(如pH、温度),也可能引起手性反转[10]。这就提示除了要关注酶在手性反转中的作用外,在药物配制和样品前处理过程中也要注意pH值、温度及不同溶剂对手性反转的影响。

图4. 影响手性反转的因素[10]
4、手性反转如何研究?
手性反转研究需要先通过手性合成或手性分离得到单一对映异构体。体外研究可选择制剂溶液、胃肠液、血浆、肝微粒体等体系进行评估。孵育单一对映异构体,并采用手性分析方法检测一对对映异构体在体外体系中的浓度变化。如果孵育R构型化合物,同时检测R和S构型,若孵育体系中检测到S构型,则说明会发生手性反转。体内研究则选择相关动物种属,单一对映异构体给药,使用手性分析方法检测一对对映异构体的药物浓度。类似体外的情况,如果采用R构型给药,体内检测到S构型的药物,则说明在体内发生了手性反转。
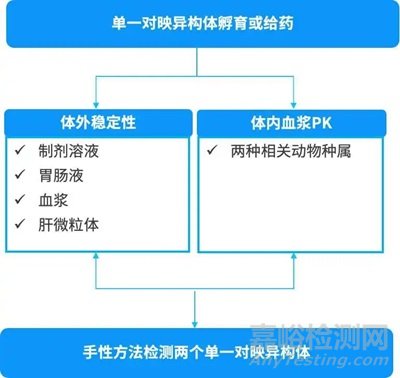
图5. 手性反转研究内容
5、如何评估手性反转的程度?
手性反转率暂无统一计算标准,以下计算方式供参考:转化生成的对映异构体的AUC比上原对映异构体与转化生成对映异构体二者AUC之和,两个单一异构体分别示例如下表。

对于手性反转程度的界定暂无相关指导文件。根据《药物代谢产物安全性试验技术指导原则》,如果代谢产物水平高于体内总暴露量的10%时,需要对此代谢产物进行监测。对于发生手性反转的手性药物,可以将转化生成的对映异构体作为代谢物处理。此外也有文献提到,虽然存在大约5%的手性反转,但视为没有反转。
基于以上依据,我们对手性反转程度的评估提出了一些建议(图6)。如果反转率大于10%,需要在临床前使用手性分析方法监测两个对映异构体,以便与临床阶段获得的临床药代动力学数据进行比较。

图6. 手性反转程度的评估建议
结 语
在生物体内,转运体、酶、受体和其它结合分子可以区分不同的对映异构体,从而导致生物过程中的不同反应。手性药物的立体选择性代谢可产生不同类型和/或数量的代谢物,应在临床前尽早使用手性分析方法对其代谢特征进行全面研究。单一对映异构体药物是目前手性药物研发的主要形式,因为一对对映异构体可能具有不同的生物学性质,开发单一对映异构体可降低未知的安全风险,并且可以选择优势单一对映异构体获得更好的疗效。在单一对映异构体研发早期,建议研究清楚是否可能会发生手性反转,以及手性反转的程度。对于消旋体药物研究,也需要通过手性分析,确定一对对映异构体间是否发生手性反转,PK特征是否相同,在目标人群中一对对映异构体血浆暴露比例是否固定等。药明康德药性评价部(DMPK)拥有完善的手性分析平台,丰富的手性药物代谢研究经验,可助力提高手性药物研发效率。
参考文献:
[1] Dion R Brocks. Drug Disposition in Three Dimensions: An Update on Stereoselectivity in Pharmacokinetics. Biopharm Drug Dispos. 2006 Nov;27(8):387–406.
[2] Roy P, Tretyakov O, Wright J, Waxman DJ. Stereoselective metabolism of ifosfamide by human P-450s 3A4 and 2B6. Favorable metabolic properties of R-enantiomer. Drug Metab Dispos 1999; 27: 1309–1318.
[3] FDA's policy statement for the development of new stereoisomeric drugs [J]. Chirality, 1992, 4(5): 338-340.
[4] EMA’s policy: Investigation of chiral active substances. 1994.
[5] Health Canada (2000) Stereochemical issues in chiral drug development.
[6] V Wsól 1, L Skálová, B Szotáková. Chiral inversion of drugs: coincidence or principle? Curr Drug Metab. 2004 Dec;5(6):517–33.
[7] Lu, H. Stereoselectivity in drug metabolism. Expert Opin. Drug Metab. Toxicol. 2007, 3, 149–158.
[8] Testa, B. Types of stereoselectivity in drug metabolism: A heuristic approach. Drug Metab. Rev. 2014, 47, 239–251.
[9] Tiritan, M.E.; Ribeiro, A.R.; Fernandes, C.; Pinto, M.M.M. Chiral pharmaceuticals. Kirk-Othmer Encycl. Chem. Technol. 2016, 1–28.
[10] Hassan Y. Aboul-Enein, Valliappan Kannappan and Selvakumar Kanthiah. Chiral Inversion of Pharmaceutical Drugs - Mini Review. Volume 26, Issue 15, 2023.

来源:药明康德DMPK


