您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-11-08 08:11
摘 要: 建立高效液相色谱法测定热感赛比斯坦颗粒中的吗啡含量。采用Waters RP-C18色谱柱(250 mm×4.6 mm,5 μm)为分离柱,以乙腈-0.01 mol/L磷酸二氢钾和0.05 mol/L庚烷磺酸钠混合溶液(pH 3.5)(体积比为5∶95)为流动相,流量为1.0 mL/min,检测波长为230 nm,柱温为28 ℃。吗啡的质量浓度在0.24~23.70 μg/mL范围内与色谱峰面积线性关系良好,相关系数为0.999 9,方法检出限为0.14 μg/mL,定量限为0.22 μg/mL。样品加标平均回收率为99.05%,测定结果的相对标准偏差为1.62%。该方法适用于热感赛比斯坦颗粒及原料药材罂粟壳中吗啡含量的测定。
关键词: 热感赛比斯坦颗粒; 高效液相色谱法; 吗啡
热感赛比斯坦颗粒是由艾克木·穆罕默德·艾扎木汗于1874年撰写的维医典籍《医科思热·爱扎穆》第723页收藏的经典名方,处方由破布木果、大枣、罂粟壳、甘草等12味药材组成,其制备工艺为将处方药材粉碎成粗粉,加水煎煮3次,每次1 h,过滤,合并滤液后浓缩成膏状,加入糖粉制成颗粒制剂。该中成药制剂具有清除异常胆液质、止咳、化痰的功效,可用于治疗热性感冒咳嗽、呼吸道感染等症状[1]。其处方中的罂粟壳为罂粟科植物罂粟Papaver somniferum L.的干燥成熟果实,味酸涩,性平,专治久咳、久泻、脱肛、脘腹疼痛[2]。现代药理及化学研究表明,罂粟壳药材主要药效成分为生物碱类,其中以吗啡为主,具有显著的镇痛、镇咳作用,并能使胃肠道及其括约肌的张力提高、消化液分泌减少、便意迟钝,从而起到止泻的作用[3]。在中成药中罂粟壳药材常作为处方原料用于治疗久咳、久泻等症状[4‒5],但同时它具有成瘾性,当人体摄入吗啡达到一定量时会产生精神依赖性[6‒7],因此控制制剂中的吗啡含量尤为重要。
在《中华人民共和国卫生部 药品标准 维吾尔药分册》[8]中仅对热感赛比斯坦颗粒中药材罂粟壳进行了定性鉴别,没有相关含量测定的标准方法,对该制剂的药品质量和安全性难以进行有效控制。目前对热感赛比斯坦颗粒中生物碱含量及其他制剂中吗啡含量的测定已有相关报道[9‒10],但对于热感赛比斯坦颗粒及原料药材罂粟壳中吗啡含量的测定还未见报道。刘新豫等对热感赛比斯坦颗粒中生物碱的含量进行了测定[9],但该方法色谱峰保留时间较短,易受流动相的干扰。笔者通过优化色谱条件和样品处理条件,建立了高效液相色谱法测定热感赛比斯坦颗粒及其处方原料药材罂粟壳中吗啡的含量。通过测定原料药材罂粟壳及热感赛比斯坦颗粒中吗啡的含量,可明确原料药材在制剂中的转移率,以确保临床应用的安全性和有效性。该方法简便、准确性、专属性较好,可为该制剂的质量和用药安全提供技术保障。
1、 实验部分
1.1 主要仪器与试剂
高效液相色谱仪:Waters e 2695型,沃特世科技(上海)有限公司。
数控超声波清洗器:KH-300DE型,昆山禾创超声仪器有限公司。
电子天平:BT125D型,感量为0.01 mg,德国赛多利斯公司。
甲醇、乙腈:均为色谱纯,美国赛默飞世尔科技公司。
吗啡对照品:质量分数为98%,批号为171201-201123,中国药品生物制品鉴定所。
热感赛比斯坦颗粒样品:批号分别为20200209、20200215、20200224,新疆和田维吾尔药业股份有限公司。
实验用水为一级水。
1.2 色谱条件
色谱柱:Waters RP-C18柱(250 mm×4.6 mm,5 μm,美国沃特世科技有限公司);柱温:28 ℃;检测波长:230 nm;进样体积:10 μL;流动相:乙腈-0.01 mol/L磷酸二氢钾和0.05 mol/L庚烷磺酸钠混合溶液(PH 3.5) (体积比为5∶95);流量:1.0 mL/min。
1.3 溶液配制
吗啡对照品溶液:0.237 mg/mL,精密称取吗啡对照品适量,置于10 mL容量瓶中,用20%(除特殊说明外,均为体积分数)的甲醇溶液(含5%乙酸)溶解并稀释至标线,混匀,于4 ℃下避光保存。
吗啡对照品系列工作溶液:精密量取0.005、0.010、0.025、0.050、0.25、0.50 mL吗啡对照品溶液,分别置于5 mL容量瓶中,用20%的甲醇溶液(含5%乙酸)定容至标线,摇匀,配制成吗啡的质量浓度分别为0.24、0.47、1.19、2.37、11.85、23.70 μg/mL的系列工作溶液。
1.4 样品处理
将热感赛比斯坦颗粒研细后取3.0 g,精密称定,置于具塞锥形瓶中,加入4 mL氨水,充分湿润,静置10 min,称量并记录其质量,加入30 mL三氯甲烷,密封,超声30 min。冷却至室温,再次称量并记录其质量,加入三氯甲烷补足减失的质量,然后过滤,取20 mL滤液浓缩至近干,加入甲醇定容至10 mL容量瓶中,摇匀,得样品溶液[8]。
取罂粟壳药材粉末约0.5 g,精密称定,同法制备罂粟壳药材溶液。
按热感赛比斯坦颗粒处方中药材比例及制备工艺,制备缺少罂粟壳药材的阴性样品,同法制备阴性样品溶液。
1.5 定量方法
取对照品溶液、样品溶液、阴性样品溶液,按照1.2色谱条件测定,以色谱峰面积外标法计算吗啡的含量。
2、 结果与讨论
2.1 色谱条件优化
2.1.1 流动相选择
分别选择乙腈-0.5%乙酸铵溶液(含0.08%三乙胺)、乙腈-0.01 mol/L庚烷磺酸钠溶液和0.02 mol/L磷酸二氢钾溶液的等量混合液(用10%磷酸溶液调节pH值至2.8)、乙腈-0.01 mol/L磷酸二氢钾溶液(用5%磷酸溶液调节pH值至2.7)、乙腈-0.01 mol/L磷酸二氢钾和0.05 mol/L庚烷磺酸钠混合溶液(用5%磷酸溶液调节pH值至3.5) (体积比为5∶95)作为流动相[11‒14],考察不同流动相体系时目标物的分离效果。结果表明,以乙腈-0.5%乙酸铵溶液(含0.08%三乙胺)、乙腈-0.01 mol/L庚烷磺酸钠溶液和0.02 mol/L磷酸二氢钾溶液的等量混合液(pH 2.8)为流动相时,吗啡出现双峰;以乙腈-0.01 mol/L磷酸二氢钾溶液(pH 2.7)为流动相时,色谱峰基线漂移;以乙腈-0.01 mol/L磷酸二氢钾和0.05 mol/L庚烷磺酸钠混合溶液(pH 3.5)为流动相时,色谱峰基线平稳,吗啡色谱峰分离度及峰形良好,因此选择乙腈-0.01 mol/L磷酸二氢钾和0.05 mol/L庚烷磺酸钠混合溶液(pH 3.5) (体积比为5∶95)作为流动相。
2.1.2 波长选择
波长的选择对色谱峰面积有较大影响,继而影响测定结果的准确度。在200~800 nm波长范围内,扫描吗啡对照品溶液。结果表明,吗啡的最大吸收波长为230 nm,故选择检测波长为230 nm。
2.1.3 柱温的选择
色谱柱温度对目标物的分离效果有较大影响。考察色谱柱温度分别为25、28、30 ℃时吗啡的分离效果[15‒17]。结果表明,当色谱柱温度在25 ℃时,色谱峰有拖尾现象,分离度不佳;当温度为30 ℃时,色谱峰基线漂移且分离度差;当温度为28 ℃时,色谱峰基线稳定,分离度好,因此选择色谱柱温度为28 ℃。
2.2 样品处理条件优化
在制备热感赛比斯坦颗粒样品溶液时,分别选择乙腈-0.01 mol/L磷酸二氢钾和0.05 mol/L庚烷磺酸钠混合溶液(pH 3.5)[18]、75%乙醇、75%甲醇和氨水4种溶剂湿润样品,然后加入三氯甲烷进行提取。结果表明,样品经氨水湿润后,加入三氯甲烷超声提取,提取溶液中吗啡色谱峰形良好且峰面积最大,因此在制备样品溶液时用氨水湿润样品后加入三氯甲烷超声提取。
选择超声时间分别为20、30、40 min进行试验。结果表明,当超声时间为20 min时,吗啡的色谱峰面积小于超声时间为30 min和40 min时的色谱峰面积,而超声时间为30 min和40 min时的色谱峰面积基本相同,考虑到检测效率,选择超声时间为30 min。
2.3 方法专属性
取吗啡对照品溶液、热感赛比斯坦颗粒样品溶液、罂粟壳药材溶液、阴性样品溶液,在1.2色谱条件下分别进样测定,色谱图如图1所示。由图1可以看出,吗啡对照品溶液、热感赛比斯坦颗粒样品溶液、罂粟壳药材溶液在相同的保留时间处具有同一色谱峰,吗啡色谱峰分离度大于1.5,理论塔板数按吗啡色谱峰计不低于5 000,而阴性样品溶液中无相应的色谱峰,表明该方法专属性良好。
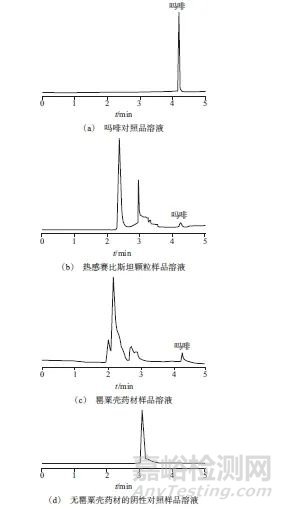
图1 高效液相色谱图
Fig. 1 High performance liquid chromatography chart
2.4 线性方程与检出限
在1.2色谱条件下,分别测定吗啡对照品系列工作溶液,记录色谱图,以目标物的质量浓度为横坐标(x),以色谱峰面积为纵坐标(y),绘制标准工作曲线,得线性方程为y=2.71×106x+1.05×104,相关系数为0.999 9。结果表明,吗啡的质量浓度在0.24~23.70 μg/mL范围内与色谱峰面积线性关系良好。
取吗啡对照品溶液适量,用20%的甲醇溶液(含5%乙酸)逐级稀释,在1.2色谱下进行测定,分别以3倍信噪比和10倍信噪比对应的质量浓度作为方法检测限和定量限。该方法的检测限为0.14 μg/mL,定量限为0.22 μg/mL。
2.5 精密度试验
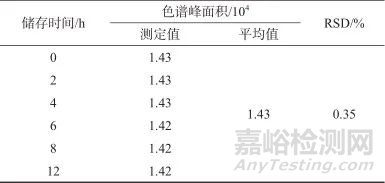
取热感赛比斯坦颗粒样品6份,每份3.0 g,精密称定,按1.4方法制备样品溶液,在1.2色谱条件下进行测定,记录色谱峰面积,结果见表1。由表1可知,测定结果的相对标准偏差(RSD)为1.62%,表明该方法精密度良好。
表1 精密度试验结果
Tab. 1 Results of precision test

2.6 样品溶液稳定性试验
按1.4方法制备样品溶液,于室温下储存,分别于第0、2、4、6、8、12 h进样测定,记录色谱峰面积,结果见表2。由表2可知,色谱峰面积测定结果的相对标准偏差为0.35%,表明样品溶液在室温下放置12 h稳定性良好。
表2 稳定性试验结果
Tab. 2 Results of stability test
2.7 样品加标回收试验
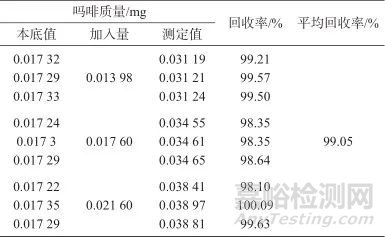
取热感赛比斯坦颗粒样品9份,平均分为3组,每份3.0 g,精密称定,按1.4方法制备样品溶液,在1.2色谱条件下进样测定。根据各组中吗啡的平均含量,分别精密加入适量的吗啡对照品溶液,使吗啡的加入量分别相当于其含量的80%、100%、120%,在1.2色谱条件下进样测定,结果见表3。由表3可知,样品加标平均回收率为99.05%,表明该方法准确度良好。
表3 样品加标回收试验结果
Tab. 3 Sample spiked recovery test results
3、 结语
通过优化色谱条件和样品处理条件,建立了高效液相色谱法测定热感赛比斯坦颗粒中的吗啡含量。该方法准确、简单、方便,适用于热感赛比斯坦颗粒及其处方原料药材罂粟壳中吗啡的含量测定,为该制剂的制备以及临床用药的安全性提供依据。
参考文献:
1 国家中医药管理局《中华本草》编委会.中华本草:维吾尔药卷[M].上海:上海科学技术出版社,2015:310.
Editorial Board of Chinese Materia Medica,State Administration of Traditional Chinese Medicine. Chinese herbal medicine:Uyghur medicine roll[M]. Shanghai:Shanghai Scientific and Technical Publishers,2015:310.
2 中华人民共和国卫生部药典委员会.中华人民共和国药典(2020年版):一部[M].北京:中国科技医药出版社,2020.
Pharmacopoeia Committee of the Ministry of Health of the People's Republic of China. Pharmacopoeia of the People's Republic of China(2020 Edition):Part One[M]. Beijing:China Medical Science and Technology Press,2020.
3 中国医药科学院药用研究所.中药志:第3册[M].北京:人民卫生出版社,1984:685.
Institute of Medicinal Sciences. Chinese Academy of Medical Sciences. Journal of Traditional Chinese Medicine:Volume 3[M]. Beijing:People's Health Publishing House,1984:685.
4 钟赣生.中药学[M].北京:中国中医药出版社,2016:428.
ZHONG Gansheng. Chinese pharmac[M]. Beijing:China Press of Traditional Chinese Medicine,2016:428.
5 阿不都克热木•阿不都热合曼,马丽,韩梦婷,等.祖卡木颗粒和罂粟壳提取液对小鼠行为学的影响[J].现代中药研究与实践,2019,33(4):33.
Abudoukeremu·Abudoureheman,MA Li,HAN Mengting,et al. Effects of Zukamu Granules and Poppy shell extract on behavior of mice[J]. Research and Practice on Chinese Medicines,2019,33(4):33.
6 薛楚,刘思雪,黄芳.罂粟科植物罂粟、延胡索和岩黄连镇痛作用的研究进展[J].药学研究,2019,38(5):290.
XUE Chu,LIU Sixue,HUANG Fang. Research progress on the analgesic effect of Poppy,Rhizoma Corydalis and Corydalis saxicola Bunting[J]. Journal of Pharmaceutical Research,2019,38(5):290.
7 谭为,杨秀颖,张莉,等.中药罂粟壳毒的历史认识与现代研究[J].中药药理与临床,2019,35(2):159.
TAN wei,YANG Xiuying,ZHANG Li,et al. Historical understanding and modern research on Papaver shell poison in traditional chinese medicine[J]. Pharmacology and Clinics of Chinese Materia Medica,2019,35(2):159.
8 中华人民共和国卫生部药典委员会.中华人民共和国卫生部 药品标准 维吾尔药分册[M].新疆:新疆科技卫生出版社,1998:180.
Pharmacopoeia Committee of the Ministry of Health of the People's Republic of China. Drug Standards of the Ministry of Health of the People's Republic of China:Uigher Medicine[M]. Xinjiang:Xinjiang Science and Technology Health Publishing House,1998:180.
9 刘新豫,唐辉,翟欣,等. RP-HPLC法测定热感赛比斯坦颗粒中3种生物碱成分的含量[J].药物分析杂志,2017,37(5):897.
LIU Xinyu,TANG Hui,ZHAI Xin,et al. Determination of 3 alkaloids in Regan Saibisitan Granules by RP-HPLC method[J]. Chinese Journal of Pharmaceutical Analysis,2017,37(5):897.
10 周钢,马方圆,单莲莲,等.高效液相色谱法测定尿通卡克乃其片中吗啡含量[J].中国药业,2023,32(17):83.
ZHOU Gang,MA Fangyuan,SHAN Lianlian,et al. Content determination of morphine in Niaotongkakenaiqi Tablets by HPLC[J]. China Pharmaceuticals,2023,32(17):83.
11 鄢长余,赵月然,姜范成,等. HPLC法同时测定桂灵片中6种生物碱的含量[J].中国药物评价,2019,36(3):184.
YAN Changyu,ZHAO Yueran,JIANG Fancheng,et al. Simultaneous determination of six alkaloids in Guiling Tablets by HPLC[J]. Chinese Journal of Drug Evaluation,2019,36(3):184.
12 杨丽蓉,隋海山,张筱,等.复方甘草片中可待因和吗啡的含量测定及分析[J].中国药品标准,2021,22(1):67.
YANG Lirong,SUI Haishan,ZHANG Xiao,et al. Determination and analysis of the contents of codeine and morphine in Compound Liquorice Tablets[J]. Drug Standards of China,2021,22(1):67.
13 刘学,刘欢欢,肖婷,等. HPLC同时测定咳清胶囊中吗啡、磷酸可待因和岩白菜素含量[J].中国现代应用药学,2022,39(6):783.
LIU Xue,LIU Huanhuan,XIAO Ting,et al. Simultaneous determination of morphine,codeine phosphate and bergenin in Keqing Capsules by HPLC[J]. Chinese Journal of Modern Applied Pharmacy,2022,39(6):783.
14 刘学,邱红燕,彭静,等.咳清胶囊的质量标准提高研究[J].中国药房,2020,31(5):595.
LIU Xue,QIU Hongyan,PENG Jing,et al. Study on the improvement of quality standard for Keqing Capsules[J]. China Pharmacy,2020,31(5):595.
15 李晶,陈超,文萍,等.一测多评法测定枇杷止咳软胶囊中硫酸吗啡和磷酸可待因的含量及其应用拓展[J].江西中医药大学学报,2019,31(6):67.
LI jing,CHEN Chao,WEN Ping,et al. Simultaneous assay of morphin sulfate and codeine phosphate in Pipa Zhike Soft Capsule through quantitative analysis of multi-components by single marker and its application[J]. Journal of Jiangxi College of Traditional Chinese Medicine,2019,31(6):67.
16 袁鹏,李蕊,杨瑞春.高效液相色谱-荧光法测定罂粟壳中罂粟碱[J].中国卫生检验杂志,2020,30(13):1 562.
YUAN Peng,LI Rui,YANG Ruichun. Determination of papaverine in poppy shell by high performance liquid chromatography with fluorescence detection[J]. Chinese Journal of Health Laboratory Technology,2020,30(13):1 562.
17 黄砚,刁灏瑒,张雁.克咳片中8个成分的含量测定[J].药物分析杂志,2020,40(2):337.
HUANG Yan,DIAO Haoyang,ZHANG Yan. Determination of 8 constituents in Keke Tablets[J]. Chinese Journal of Pharmaceutical Analysis,2020,40(2):337.
18 鲍实,孙春艳. HPLC法测定福尔可定原料中的吗啡及可待因杂质[J].中国药师,2019,22(12):2 361.
BAO Shi,SUN Chunyan. Determination of morphine and codeine in Pholcodine materials by HPLC[J]. China Pharmacist,2019,22(12):2 361.
引用本文: 蔡美玲,唐辉,庞克坚,等 . 高效液相色谱法测定热感赛比斯坦颗粒中吗啡含量[J]. 化学分析计量,2024,33(9):90. (CAI Meiling, TANG Hui, PANG Kejian, et al. Determination of morphine content in Regan Saibisitan Granules by high performance liquid chromatography[J]. Chemical Analysis and Meterage, 2024, 33(9): 90.)

来源:化学分析计量


