您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-11-20 08:38
摘 要: 利用超高效液相色谱-三重四极杆串联质谱(UPLC-MS/MS)法和电感耦合等离子体质谱(ICP-MS)法,分析了清代与明代黄色系古籍纸中的染料成分及其媒染剂。使用ZORBAX SB-C18色谱柱和0.1%(体积分数)甲酸-甲醇为流动相,通过UPLC-MS/MS构建不同植物染料特征成分的二级MS/MS数据库,鉴定出清代和明代黄色系古籍纸的主要染料成分为芦丁和槲皮素,均来源于槐米;此外,ICP-MS分析揭示了清代黄色系古籍纸使用铝盐作为媒染剂,以增强染色效果。研究结果可为古籍纸的科学认识和修复提供依据。
关键词: 超高效液相色谱; 质谱; 古籍纸; 染料; 清代; 明代
中国古代染料多以植物为来源,所形成的类别可通过几类主要颜色,即五色体系(赤、青、黄、黑、白)[1] 进行区分,不同色系的代表植物通过古文记载及前人的研究,已形成较为详细的体系[2]。五色体系中,黄色最为高贵[3]。秦朝时期虽以黑为尊,但在中华文明漫漫历史长河中,黄色逐渐成为了皇权的象征色。古代可染黄色的植物有黄檗、黄栌、槐米、栀子以及姜黄等,古人利用这些植物的不同部位,同时搭配不同的媒染剂,实现了书籍、纺织品等不同物品不同风格的染色[4]。
了解文物的实际染色来源对于文物的保护及修复至关重要。Han等[5]利用超高效液相色谱光电二极管阵列串联质谱对中国古代常见纺织染料成分进行了化学表征,建立了第一个中国古代常用染料化学成分质谱数据库。Zhang等[6]同样采用高效液相色谱二极管阵列质谱对美国马萨诸塞州收藏的黄色丝绸样品所用染料进行了分析,确定出其成分有姜黄素、类黄酮和原小檗碱,并推测染料来源为姜黄、槐米和黄藤。张林玉[3]采用飞行时间质谱对清代黄色系纺织品染料成分及可能的植物来源进行了鉴定。Dussubieux等[7]利用电感耦合等离子体质谱(ICP-MS)法对考古样本中的媒染剂进行了分析,成功鉴定出含有铜、铁、铝等元素的媒染剂,表明ICP-MS法可以作为判别考古染色样本所用媒染剂的检测手段。范鲁丹等[8]利用液相色谱-质谱对清代的小龙袍的染料成分进行了分析,通过多级质谱图等信息成功鉴定出6种植物染料。Bell等[9]利用拉曼光谱技术对公元9世纪《金刚般若波罗蜜经》上的黄色染料进行了完全无损鉴别,结果表明其主要含有盐酸小檗碱和黄藤素。目前,对于染料组分鉴定研究主要集中于古代纺织品,然而,有关古籍纸中的有机染料成分及来源分析的报道较少,因此,开展古纸中的染料成分鉴定,对于我国纸质文物保护及古籍修复工作的实施有较大的意义。
笔者采用超高效液相色谱-三重四极杆串联质谱(UPLC-MS/MS)及ICP-MS技术,对5种植物、清代黄色系古籍纸及明代黄色系古籍纸进行染料分析鉴定,通过构建不同植物染料特征成分的二级MS/MS数据库,结合元素分析,以确定样品中染料成分、潜在植物来源及媒染剂。
1、 实验部分
1.1 实验仪器与试剂
超高效液相色谱仪:1290型,美国安捷伦科技有限公司。
三重四极杆质谱仪:6460C型,美国安捷伦科技有限公司。
电感耦合等离子体质谱仪:7800型,美国安捷伦科技有限公司。
微波消解仪:MARS 6型,美国CEM公司。
氮吹仪:N-EVAP 112型,美国Organomation公司。
Milli-Q纯水系统:法国默克公司。
甲醇,色谱纯,美国赛默飞世尔科技公司。
N,N-二甲基乙酰胺,色谱纯,美国赛默飞世尔科技公司。
甲酸,色谱纯,美国赛默飞世尔科技公司。
氮气、氩气:体积分数均大于99.999%,北京北氧氧源商贸中心。
乙二胺四乙酸二钠(EDTA-2Na):分析纯,国药集团化学试剂有限公司。
浓硝酸、过氧化氢水溶液:优级纯,质量分数均为30%,国药集团化学试剂有限公司。
铝、钾、铁、铜、铬多元素混合标准溶液:各元素质量浓度均为10 mg/L,美国安捷伦科技有限公司。
植物样本:栀子,采自浙江湖州;槐米,采自河北石家庄;姜黄,采自云南西双版纳;黄檗,采自吉林长白山;黄栌,采自北京大学未名湖畔。
分析样品:清代官方法典、明代大型百科全书式文献。
实验用水为超纯水。
1.2 实验步骤
1.2.1 样品处理
UPLC-MS/MS法步骤:第一次萃取,分别称取20 mg清代黄色系古籍纸、100 mg明代黄色系古籍纸样品,向样品中加入1 mL提取液(甲醇、甲酸、10 mmol/L EDTA-2Na的体积比为90∶5∶5,下同),50 ℃超声提取50 min,用0.22 μm微孔滤膜过滤提取液转移至另一洁净氮吹管中,氮吹浓缩至100 μL后待UPLC-MS/MS测试;第二次萃取,向已完成第一次萃取的样品中再加入0.1 mL N,N-二甲基乙酰胺溶液,40 ℃超声提取30 min。除姜黄外,其余4种植物提取液均采用ESI+模式进行分析,姜黄采用ESI-模式进行分析,样品采用ESI+/ESI-两种模式进行分析。同时进行不含样品的空白实验。
ICP-MS法步骤:向经萃取后的样品中,加入1 mL浓硝酸,0.2 mL质量分数为30%的过氧化氢溶液,采用微波消解仪进行消解,消解完毕后用水定容至10 mL。同时进行不含样品的空白实验。
1.2.2 参比植物溶液的配制
分别称取上述5种植物(栀子、槐米、姜黄、黄檗、黄栌)各100 mg,置于1 mL提取液中,于50 ℃超声提取50 min,4 ℃保存待测。
1.3 仪器工作条件
1.3.1 液相色谱仪
色谱柱:ZORBAX SB-C18 (2.1 mm×50 mm,1.8 μm,美国安捷伦科技有限公司);柱温:30 ℃;进样体积:5.0 μL;流动相:A相为体积分数0.1%的甲酸,B相为甲醇,流量为0.250 mL/min;洗脱方式:梯度洗脱,洗脱程序见表1。
表1 梯度洗脱程序
Tab. 1 Gradient elution program

1.3.2 质谱仪
LC-MS/MS条件:MS2 Scan及Product Ion模式;扫描范围为m/z 100~m/z 1 000;裂解电压为135 V;脱溶剂气(氮气)温度为300 ℃;脱溶剂气流量为11 L/min;喷雾器压力为0.103 4 MPa;毛细管电压为3 500 V (正离子模式ESI+)、4 000 V (负离子模式ESI-);子离子模式碰撞能量为20 eV。
ICP-MS条件:射频功率为1 500 W;等离子体气流量为15 L/min;载气(氩气)流量为0.80 L/min;辅助气(氩气)流量为0.40 L/min;No gas模式;雾化室温度为2 ℃;实时内标校正。
2、 结果与讨论
2.1 超高效液相色谱-三重四极杆串联质谱构建5种植物特征染料成分二级MS/MS数据库
2.1.1 槐米组分分析
槐花是豆科植物槐的干燥花,其花蕾被称为槐米[3]。槐米中的色素成分是黄酮类化合物,其主要成分是芦丁、槲皮素等[10]。对槐米提取液质谱图提取m/z 303离子,在4.563 min处显示出色谱峰。据张林玉[3]报道,m/z 303[M+H]+的准分子离子峰物质为槲皮素,二级质谱包括m/z 229、153等。李宇航等[11]对槲皮素的质谱碎片进行了检测,在正离子扫描下槲皮素特征碎片离子还有m/z 285、257等。
实验结果如图1所示,槐米m/z 303的二级碎片出现了m/z 228.9、152.9的碎片离子,此外,产生了m/z 284.9、256.8、165.1、137.0等碎片离子,与相关文献[3]报道一致,表明该物质为槲皮素。此外,槐米提取液3.43 min左右的m/z 611准分子离子峰的二级质谱结果(见图2)显示,其特征碎片离子为m/z 303.1、465.2等,范鲁丹等[8]对龙袍中黄色纱线的分析显示:在质谱负离子模式下发现了准分子离子峰为m/z 609、二级质谱离子为m/z 301的化合物,最终确认为芦丁;若在正离子模式下,准分子离子和碎片离子应分别为m/z 611、303,与实验中准分子离子峰m/z 611的二级质谱结果一致。结合文献及实验结果,选择m/z 611[M+H]+、m/z 303[M+H]+及其二级碎片离子作为槐米中芦丁及槲皮素的特征离子,进行样品的染料成分筛选。
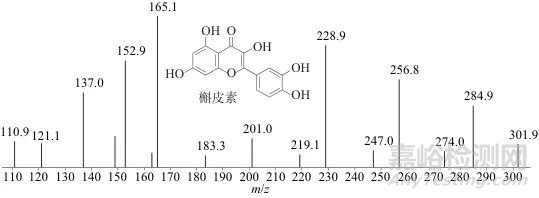
图1 槐米提取液特征化合物(m/z 303)的二级质谱图
Fig. 1 Mass spectrum of the characteristic compound (m/z 303) of the Sophora japonica flower extract

图2 槐米提取液特征化合物(m/z 611)的二级质谱图
Fig. 2 Mass spectrum of the characteristic compound (m/z 611) of the Sophora japonica flower extract
2.1.2 黄檗组分分析
据相关文献[2]报道,黄檗的主要染料成分为生物碱类化合物,代表性化合物有小檗碱、巴马汀、药根碱、木兰花碱以及黄檗碱等。实验中黄檗的特征染料成分及二级碎片离子如表2所示,与相关文献[2‒3]中报道的上述物质及其二级特征碎片离子吻合,因此,选择表2中的分子离子及碎片离子作为特征离子,进行样品的染料成分筛选。
表2 黄檗中特征染料成分及二级碎片离子
Tab. 2 Characteristic dye components and secondary fragment ions in Phellodendron amurense Rupr.

2.1.3 栀子组分分析
栀子的果实色素成分主要是藏红花酸酯类化合物,属于水溶性色素,代表性化合物有顺式-藏红花苷-Ⅰ、京尼平-1-β-龙胆双糖苷、反式-藏红花苷-Ⅰ、反式-藏红花苷-Ⅱ及顺式-藏红花苷-Ⅱ等[12‒13]。实验中栀子的特征染料成分及二级碎片离子如表3所示,与相关文献[2‒3]中报道的上述物质及其二级特征碎片离子吻合,因此,选择表3中的分子离子及碎片离子作为特征离子,进行样品的染料成分筛选。
表3 栀子中特征染料成分及二级碎片离子
Tab. 3 Characteristic dye components and secondary fragment ions in gardenia

2.1.4 姜黄组分分析
姜黄素类化合物为姜黄的主要染色成分,代表性化合物为姜黄素、去甲氧基姜黄素和双去甲氧基姜黄素[14]。实验中姜黄的特征染料成分及二级碎片离子如表4所示,与相关文献[3]中报道的上述物质及其二级特征碎片离子吻合,因此,选择表4中的分子离子及碎片离子作为特征离子,进行样品的染料成分筛选。
表4 姜黄中特征染料成分及二级碎片离子
Tab. 4 Characteristic dye components and secondary fragment ions in turmeric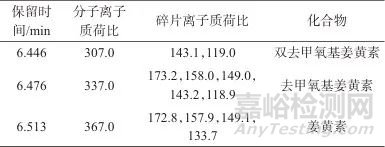
2.1.5 黄栌组分分析
黄栌提取物包含了有机酸类、糖苷类、漆黄素、硫磺菊素等[8,15-16]。实验中黄栌的特征染料成分及二级碎片离子如表5所示。漆黄素、硫磺菊素与相关文献[8]中报道的上述物质及其二级特征碎片离子基本吻合;保留时间为1.366 min的分子离子m/z 171.0应为没食子酸[M+H]+,其二级碎片离子分别为m/z 152.8[M-H2O]+、m/z 125.2[M-COOH]+等,与黄旭东等[17]的研究结果相一致;分子离子m/z 451.0为矢车菊素-3-O-半乳糖苷,其碎片离子m/z 288.8为矢车菊素-3-O-半乳糖苷的糖苷键断裂后的矢车菊色素所形成,m/z 179.0应为矢车菊色素丢失儿茶酚基团后所得。综上,选择表5中的分子离子及碎片离子作为特征离子,进行样品的染料成分筛选。推测的矢车菊素-3-O-半乳糖苷碎裂过程如图3所示。
表5 黄栌中特征染料成分及二级碎片离子
Tab. 5 Characteristic dye components and secondary fragment ions in Cotinus coggygria


图3 黄栌提取液中特征化合物(m/z 451.0)的二级质谱及其可能的碎裂途径
Fig. 3 Mass spectrum of the characteristic compound (m/z 451.0) of the Cotinus coggygria extract and its possible fragmentation pathway
2.2 清代和明代黄色系古籍纸特征染料成分分析
2.2.1 清代黄色系古籍染料分析
根据上述筛选出的5种植物染料特征成分的分子离子及二级离子碎片,对清代黄色系古籍样品提取液进行分析。结果表明,3.432 min中出现了槐米的特征成分芦丁(m/z 611.0[M+H]+),m/z 611的离子流图及二级质谱结果如图4所示,碎片离子为m/z 465.2、m/z 303.1等,其中m/z 465.2为[M+H-C6H10O4]+的碎片离子,m/z 303.1则为芦丁的糖苷键断裂后留下的槲皮素基团形成的碎片离子,这与相关文献[3,8,18-19]中所报道的芦丁二级碎片离子一致,表明清代黄色系古籍提取液中存在芦丁。

图4 清代黄色系古籍提取液特征化合物(m/z 611.0)的提取离子流色谱图及二级质谱图
Fig. 4 Extraction ion current chromatogram and secondary mass spectrum of the characteristic compound (m/z 611.0) of the extract from the yellow-paper ancient books of the Qing Dynasty
此外,清代黄色系古籍样品提取液在3.435 min、4.573 min出现了m/z 303.0分子离子峰,其中4.573 min的色谱峰面积很小,并且由于含量过低导致二级碎片离子无法与槲皮素的特征离子相对应。由于槲皮素不稳定,容易在光照、温度等影响因素下发生降解或某些化学反应,在古籍中随着时间流逝易转变为其他物质,相关文献[3]也报道了在古代纺织品中未直接检测到槲皮素,对清代黄色系古籍m/z 303.0在3.435 min的分子离子峰进行分析,结果如图5所示。由图5可见,出现了m/z 229.0、152.8、284.6、257.3、165.1、137.1等碎片离子,二级质谱结果与槐米中槲皮素的二级质谱图结果一致,因此推测该物质为槲皮素发生了结构变化后形成的同分异构体,导致了保留时间的变化。此外,相关文献[3]报道了一种槲皮素衍生物m/z 331,由槲皮素的—OH分子转变为—COOH而得,实验中清代黄色系古籍提取液得到了相似的结果,m/z 331.0在4.715 min的二级质谱如图6所示,主要碎片离子有m/z 313.1、274.9、256.9、192.8、180.8、137.0等,其余二级碎片离子与槲皮素的特征离子也均相同,因此,可以认定槲皮素存在于清代黄色系古籍的提取液中。此外,在清代黄色系古籍提取液中没有找到栀子、黄檗、姜黄及黄栌的特征染料分子离子及相对应的二级质谱碎片信息,空白实验中没有任一特征染料成分的分子离子质谱信息。
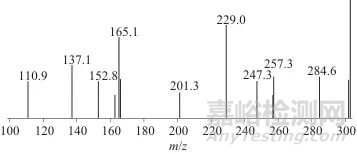
图5 清代黄色系古籍提取液特征化合物(m/z 303.0)的二级质谱图
Fig. 5 Secondary mass spectrum of the characteristic compound (m/z 303.0) of the extract from the yellow-paper ancient books of the Qing Dynasty

图6 清代黄色系古籍提取液特征化合物(m/z 331.0)的二级质谱图
Fig. 6 Secondary mass spectrum of the characteristic compound (m/z 331.0) of the extract from the yellow-paper ancient books in the Qing Dynasty
2.2.2 明代黄色系古籍染料分析
将筛选出的5种植物特征染料成分信息与明代黄色系古籍提取液的分析结果进行对比,在3.432 min得到了m/z 611.0的分子离子峰,表明此峰有可能是芦丁的分子离子峰。对m/z 611.0进行二级质谱验证,得到的碎片为m/z 303.2及m/z 70.7,m/z 303.2可能为芦丁分子离子峰经碰撞池轰击后糖苷键断裂所产生的槲皮素分子离子,而m/z 70.7同样也出现在了清代黄色系古籍提取液m/z 611.0分子离子的二级质谱图中。虽然芦丁的其余特征离子未出现在明代黄色系古籍提取液m/z 611.0的二级质谱图中,但从响应值可以看到明代黄色系古籍提取液m/z 303.2碎片离子响应值仅为清代黄色系古籍提取液m/z 303.2碎片离子响应值的1/100左右,因此这可能是由于样品极少,芦丁的含量过低导致的碎片信息差异。此外,在明代黄色系古籍提取液中没有找到栀子、黄檗、姜黄、黄栌的特征染料分子离子及相对应的二级质谱碎片信息,空白实验中没有任一特征染料成分的分子离子质谱信息。
2.3 利用ICP-MS法分析清代黄色系古籍纸的媒染剂
清代黄色系古籍外观呈亮黄色,相关文献[3‒4]报道若槐米直接染色时颜色偏淡,使用媒染则可以得到亮黄色。采用甲醇、甲酸、10 mmol/L EDTA-2Na体积比为90∶5∶5提取浓缩后的溶液颜色呈淡黄色,未显示出样品本身的亮黄色;样品继续使用N,N-二甲基乙酰胺溶液在40 ℃下进行第二次超声提取30 min,提取液经UPLC-MS/MS法分析,未检测到芦丁、槲皮素衍生物及其他特征染料成分的存在,而清代黄色系古籍样品仍带有黄色。这可能是清代黄色系古籍使用了较强的媒染剂,且该媒染剂所含金属元素(如Al等)很可能与EDTA-2Na反应较慢,另外N,N-二甲基乙酰胺不能对染料成分进行有效提取,同时表明了亮黄色不会来自于栀子这类提供亮黄色的水溶性色素植物。由于古代常用铬盐、铜盐、绿矾和明矾等作为媒染剂,为了验证样品是否添加了相关媒染剂,将提取过染料的剩余样品进行了消解处理,采用ICP-MS法进行了元素测试,通过归一法得出的5种元素含量结果见表6。由表6可见,Cr、Cu含量较低,因此排除使用了铬盐及铜盐媒染剂;Al含量的结果远高于其他元素,为781 μg/L;空白实验各元素均未检出,表明清代黄色系古籍使用了含铝的媒染剂进行了媒染,以提高染料与样品的结合能力,并使样品呈现出亮黄色的效果。
表6 清代黄色系古籍中元素含量
Tab. 6 Elemental contents of yellow-paper ancient books of the Qing Dynasty

3、 结语
通过构建不同植物染料特征成分的二级MS/MS数据信息,与两件古籍纸样品表面染料成分的UPLC-MS/MS结果进行比对,实现了对明清黄色系古籍纸所用染料成分进行鉴定的目的。清代黄色系古籍纸样品的染色成分含芦丁以及槲皮素,ICP-MS结果表明其染料工艺使用铝盐进行了媒染;明代黄色系古籍纸样品的染色成分含有芦丁,两件古籍纸样品染料来源植物均为槐米。鉴定结果提高了对明清古籍纸中染料成分的科学认知,同时为古籍纸的修复提供了科学依据。
参考文献:
1 陈金梅.中国传统五色学说体系探析[D].北京:北京服装学院,2007.
CHEN Jinmei. Exploring to the system of Chinese traditional “theory of five color”[D]. Beijing:Beijing Institute of Fashion Technology,2007.
2 李玉芳.几种常见中国古代天然植物染料的分析鉴定研究[D].北京:北京科技大学,2020.
LI Yufang. Analysis and identification of several common natural botanical dyes in ancient China[D]. Beijing:University of Science and Technology Beijing,2020.
3 张林玉.古代纺织品中染料成分的鉴定和染色工艺的探究[D].北京:北京化工大学,2017.
ZHANG Linyu. Characterization of natural dyes in ancient textiles of Qing Dynasty by UHPLC-Q-ToF and researching on dyeing technology[D]. Beijing:Beijing University of Chemical Technology,2017.
4 唐金萍.中国古代服饰中的黄色研究[D].北京:北京服装学院,2014.
TANG Jinping. The yellow research in ancient Chinese clothing[D]. Beijing:Beijing Institute of Fashion Technology,2014.
5 HAN J,WANROOIJ J,VAN BOMMEL M,et al. Characterization of chemical components for identifying historical Chinese textile dyes by ultra high performance liquid chromatography-photodiode array-electrospray ionization mass spectrometer[J]. Journal of Chromatography A,2017,1479:87.
6 ZHANG X,CORRIGAN K,MACLAREN B,et al. Characterization of yellow dyes in nineteenth-century Chinese textiles[J]. Studies in conservation,2007,52(3):211.
7 DUSSUBIEUX L,BALLARD M W. Using ICP-MS to detect inorganic elements in organic materials:a new tool to identify mordants or dyes on ancient textiles[J]. MRS Online Proceedings Library,2004,852:124.
8 范鲁丹,郭丹华,刘剑,等.高效液相色谱-质谱联用技术鉴别清代小龙袍染料[J].丝绸,2019,56(2):50.
FAN Ludan,GUO Danhua,LIU Jian,et al. Identification of dyes of small dragon robe in the Qing Dynasty with high performance liquid chromatography-mass spectrometry[J]. Journal of Silk,2019,56(2):50.
9 BELL S E J,BOURGUIGNON E S O,DENNIS A C,et al. Identification of dyes on ancient Chinese paper samples using the subtracted shifted Raman spectroscopy method[J]. Analytical Chemistry,2000,72(1):234.
10 李秋红,栾仲秋,王继坤.中药槐米的化学成分、炮制研究及药理作用研究进展[J].中医药学报,2017,45(3):112.
LI Qiuhong,LUAN Zhongqiu,WANG Jikun. The chemical components,Chinese medicine processing and pharmacological effect on Sophora flower bud[J]. Acta Chinese Medicine and Pharmacology,2017,45(3):112.
11 李宇航,戴海学,汪明明,等.槲皮素的电喷雾离子阱质谱分析[J].质谱学报,2009,30(6):374.
LI Yuhang,DAI Haixue,WANG Mingming,et al. Electrospray ion trap mass spectrometry analysis of quercetin[J]. Journal of Chinese Mass Spectrometry Society,2009,30(6):374.
12 高凤阳,高晓燕,张加余,等. HPLC-DAD-MS/MS对栀子中色素成分的研究[J].北京中医药大学学报,2012,35(5):343.
GAO Fengyang,GAO Xiaoyan,ZHANG Jiayu,et al. Pigment study in fruits of Gardenia jasminoide by HPLC-DAD-MS/MS[J]. Journal of Beijing University of Traditional Chinese Medicine,2012,35(5):343.
13 HAN Y,WEN J,ZHOU T T,et al. Chemical fingerprinting of Gardenia jasminoides Ellis by HPLC-DAD-ESI-MS combined with chemometrics methods[J]. Food Chemistry,2015,188:648.
14 斯琴,李景武.蒙药材姜黄的本草考证[J].中国民族民间医药,2007(1):51.
SI Qin,LI Jingwu. Textual research on the herbal medicine of Mongolian herb turmeric[J]. Chinese Journal of Ethnomedicine and Ethnopharmacy,2007(1):51.
15 王俊杰,江善青,王刚,等.黄栌植物化学成分、药理作用与临床应用研究进展[J].国际中医中药杂志,2015,37(3):283.
WANG Junjie,JIANG Shanqing,WANG Gang,et al. Progress of phytochemicals,pharmacological effects and clinical applications on Cotinus coggygria Scop.[J]. International Journal of Traditional Chinese Medicine,2015,37(3):283.
16 葛雨萱,周肖红,刘洋,等.黄栌属种质资源,栽培繁殖,化学成分,叶色调控研究进展[J].园艺学报,2014,41(9):1 833.
GE Yuxuan,ZHOU Xiaohong,LIU Yang,et al. Recent advances in germplasm,cultivation,propagation,chemical components and leaf color regulation of Cotinus[J]. Acta Horticulturae Sinica,2014,41(9):1 833.
17 黄旭东,王琳玲,秦咏九,等.液相色谱-质谱联用同时测定宁泌泰胶囊中没食子酸、盐酸小檗碱、盐酸巴马汀、连翘苷的含量[J].药物分析杂志,2018,38(6):979.
HUANG Xudong,WANG Linling,QIN Yongjiu,et al. Determination of the content of gallic acid,berberine hydrochloride,palmatine hydrochloride and forsyth in Ningmitai capsules by LC-MS[J]. Chinese Journal of Pharmaceutical Analysis,2018,38(6):979.
18 ZHANG X,LAURSEN R. Application of LC-MS to the analysis of dyes in objects of historical interest[J]. International Journal of Mass Spectrometry,2009,284(1/2/3):108.
19 MARQUES R,SOUSA M M,OLIVEIRA M C,et al. Characterization of weld (Reseda luteola L.) and spurge flax (Daphne gnidium L.) by high-performance liquid chromatography-diode array detection-mass spectrometry in Arraiolos historical textiles[J]. Journal of chromatography A,2009,1216(9):1 395.
引用本文: 张竞帆,曹沅,王建平,等 . 高效液相色谱质谱法鉴定古籍纸染料成分及媒染剂[J]. 化学分析计量,2024,33(10):79. (ZHANG Jingfan, CAO Yuan, WANG Jianping, et al. Identification of dye components and mordants of ancient paper by high performance liquid chromatography-mass spectrometry[J]. Chemical Analysis and Meterage, 2024, 33(10): 79.)

来源:化学分析计量


