您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-11-20 08:48
ICH M13A[1]于2024年7月23制定最终版,指导原则中认为空腹BE研究较餐后BE研究更能区分制剂之间的PK特征差异,除高风险制剂外,绝大多数口服固体速释仿制药可仅进行单个空腹BE研究。我国于2024年9月12日公开征求ICH M13A(含问答文件)实施建议和中文版意见的通知,还未正式实施;这意味着口服速释固体仿制药将进入单个BE研究时代,BE研发成本将降低近一半,极大的促进了仿制药的发展,但在政策尚未明确的过渡期,制药行业该如何应对口服固体速释仿制药BE政策变化?本文将从食物对药物吸收影响、各药监局的相关政策措施等方面进行分析为制药行业制定口服固体速释仿制药开发策略提供参考;
一、食物对药物吸收影响
口服药物被胃肠道吸收的过程非常复杂,首先药物制剂在胃肠道内崩解,然后溶解的药物经过胃排空和小肠转移,经肠膜跨膜吸收,最后经肝静脉进入体循环;在此过程药物的吸收会受各种因素的影响,而食物影响药物吸收的因素包括:食物中的成分与药物发生化学反应例如螯合反应,影响药物的溶解;食物影响胃肠道生理条件如改变胃肠道的pH值,影响药物溶解和渗透;食物也可能影响胃肠道的生理条件例如胃排空和小肠转运时间,影响药物的转运等等[2]。口服药物吸收过程及各阶段的影响因素如下图1所示:
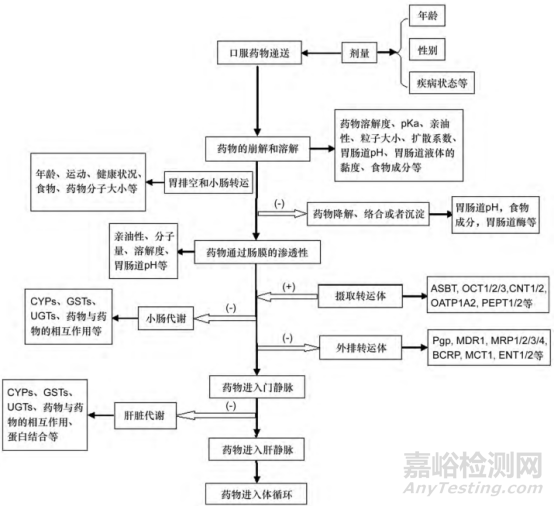
图1 口服药物吸收过程及影响因素
食物可以从药物的溶解、渗透和转移等多个方面影响药物的吸收,因而新药研发必须要考虑食物效应;从风险等级划分的角度考虑,食物对药物的影响可以划分为具有临床意义的影响和不具有临床意义的影响,是否需同食物一起服用药物需从安全性、有效性方面综合考虑,新药的处方和工艺有时也会为避免食物效应进行调整创新;
二、各药监局仿制药BE指南对比
各国药监局对仿制药BE研究空腹和餐后条件持有不同观点,一般情况下我国和美国要求空腹和餐后BE均需进行,欧洲和日本要求仅空腹BE研究即可;NMPA、FDA、EMA及PMDA生物等效性指导原则与ICH M13A对比如下表所示:
表1 仿制药BE指南对比
*英文翻译版本
从各国药监局仿制药的生物等效性指南对比可知,实施ICH M13A对我国和美国的口服固体速释仿制药BE研究将有巨大调整,需从空腹和餐后BE均研究的情形进入单BE研究时代,必将遇到很多问题和挑战;目前各国暂未正式开始实施ICH M13A;EMA计划2025年1月25日正式实施,FDA在2024年10月31日公布了825篇依据ICH M13A修订的口服固体速释仿制药BE指南。
三、讨论
ICH M13A虽然推荐大多数口服固体速释制剂可进行单个空腹BE研究,但高风险制剂和RLD说明书标明只能同食物服用的品种仍需制药行业研究人员评估确认BE研究方案,可参考下述决策树进行评估;

图2 口服固体速释仿制药BE研究方案决策树
ICH M13A对于高风险制剂定义是采用复杂处方工艺,致使体内性能更有可能受到空腹和餐后条件下胃肠道状态不同的影响。食物影响药物吸收的因素存在多种方面,调整食物效应的处方工艺的原理并不明确,目前控制食物效应的处方工艺技术旨在改善水溶性差的药物,提高生物利用度[7],除了指导原则中明确提及的处方工艺技术外,环糊精包裹技术也可提高亲脂性和低水溶性药物的生物利用度,例如Sporanox®(依曲康唑)环糊精溶液比Sporanox®胶囊在餐后状态生物利用度高,制药行业研究人员在评估高风险制剂时,也需考虑环糊精包裹技术。
ICH M13A仅开展餐后BE的建议是依据说明书中标明只能与食物同服且是因PK原因,其他非PK原因可选择进行空腹或餐后单个BE研究;EMA仿制药BE指南对于说明书标明只能与食物同服的,可忽略原因,仅开展餐后BE即可;而PMDA仿制药BE指南中只有空腹生物利用度或空腹有严重不良反应,才建议仅进行餐后BE;在FDA修订825篇的口服固体速释仿制药BE指南中,其中118篇依据ICH M13A去除了空腹BE研究,绝大多数品种RLD说明书中标明仅同餐服用,同餐服用的原因包括PK原因、耐受性原因以及临床实验绝大多数是在餐后条件下进行等等;少数品种RLD说明中未明确是否同餐服用或建议餐前服用,例如:富马酸比索洛尔片、十二烷基硫酸芬戈莫德口崩片、瑞格列奈片、苯丁酸钠和牛磺酸二醇口服混悬液,这些品种可能是出于安全性原因建议开展餐后BE。因而制药行业研究人员在评估餐后BE研究方案时除参考RLD说明书中用法用量外,还需考虑品种开展BE的安全性问题。
参考文献
[1] ICH. M13 Bioequivalence for Immediate-Release Solid Oral Dosage Forms. [EB /OL]. https://database.ich.org/sites/default/files/ICH_M13A_Step4_Final_Guideline_2024_0723.pdf
[2] 陈艳君,刘梅,靳倩. 食物影响口服药物吸收的研究进展. [J]. 中国新药杂志,2018,27(10):1137-1143
[3] 国家药品监督管理局药品审评中心. 以药动学参数为终点评价指标的化学药物仿制人体生物等效性研究技术指导原则. [EB /OL]. https://www.cde.org.cn/zdyz/domesticinfopage?zdyzIdCODE=1e218f70d9b7c99c2663de9f6655bc5b
[4] FDA U.S. Food and Drug Administration. Bioequivalence Studies With Pharmacokinetic Endpoints for Drugs Submitted Under an ANDA Guidance for Industry. [EB /OL]. https://www.fda.gov/media/87219/download
[5] EUROPEAN MEDICINES AGENCY. Guideline on the investigation of bioequivalence. [EB /OL]. https://www.ema.europa.eu/en/documents/scientific-guideline/guideline-investigation-bioequivalence-rev1_en.pdf
[6] Pharmaceuticals and Medical Devices Agency. Guideline for Bioequivalence Studies of Generic Product. [EB /OL]. https://www.pmda.go.jp/files/000244288.pdf
[7] Joseph P. O’Shea, René Holm, Caitriona M. O’Driscoll, et al. Food for thought: formulation away the food effect-a PEARRL review. [J]. Journal of pharmacy and pharmacology, 71(2019), pp.510-535

来源:药研


