您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-11-27 08:36
1、什么是临床试验审批?
临床试验审批是指国家药品监督管理局根据申请人的申请,对拟开展临床试验的医疗器械的风险程度、临床试验方案、临床受益与风险对比分析报告等进行综合分析,以决定是否同意开展临床试验的过程。
2、根据《需进行临床试验审批的第三类医疗器械目录(2020年修订版)》。

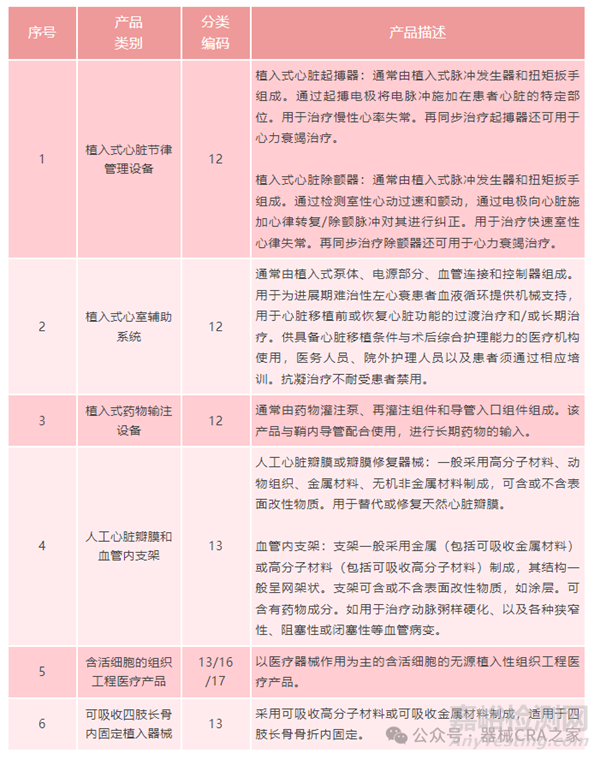
解读:
(1)以上六种器械一定需要审批吗?
答案:是否定的。必须同时满足共性原则和个性原则才需要审批。
共性原则:与境内外已上市产品相比,采用全新设计、材料或机理,和/或适用于全新适用范围,且对人体具有较高风险的医疗器械,应当经临床试验审批后方可在中国开展临床试验。
个性原则:即具体的品类。
譬如:开展了一款人工心脏瓣膜的临床试验,如果瓣膜没有采用全新设计、材料或者机理,就不要审批。只满足了品类,没有满足共性原则。
譬如: 开展了一款全新设计的麻醉机。满足了共性原则全新设计,但不满足品类,就不需要审批。
(2)品类六,已经进行了更改?
与境内外已上市产品相比,采用全新设计、材料或机理,适用于四肢长骨骨干骨折内固定的可吸收植入器械需要经临床试验审批后开展临床试验。
3、临床试验审批的沟通交流
申请人在提出临床试验审批申请前,可以根据《关于需审批的医疗器械临床试验申请沟通交流有关事项的通告(2017年第184号)》与国家药品监督管理局医疗器械技术审评中心(以下简称器审中心)进行沟通。
4、临床试验审批默示许可?会颁发临床试验批件吗?
根据《关于调整医疗器械临床试验审批程序的公告(2019年第26号)》,自临床试验审批申请受理并缴费之日起60个工作日内,申请人在预留联系方式、邮寄地址有效的前提下,未收到器审中心意见(包括专家咨询会议通知和补充资料通知)的,可以开展临床试验。对于同意开展临床试验的,器审中心将受理号、申请人名称和住所、试验用医疗器械名称、型号规格、结构及组成在器审中心网站公布,并将审查结果通过器审中心网站告知申请人,不再发放临床试验批件。

来源:Internet


