您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-12-04 20:21
在药品研发阶段,溶出度被广泛用来评估药物制剂的释放速率、药物的稳定性和制剂的变化。溶出度还用来建立体内体外相关性(IVIVC),预测产品的生物利用度及生物等效性。此外,溶出度还可以用来保证生产和产品的一致性,也用于小规格产品BE豁免及获批后的生产变更的批准。
溶出度是口服固体制剂的关键质量属性,通过建立原料药性质(粒度、晶型)、处方变量(辅料种类与用量)、工艺参数(混合参数、压片压力等)与溶出度之间的关系,保障药品质量的稳定性。溶出方法的开发至关重要。
下面从以下几个方面阐述药品溶出方法开发的关键点。
一、药物的分类与表征
了解药物的BCS分类情况进行处方设计,可用于评估体内-体外相关性(IVIVC) 的可能性。
对于难溶性药物的速释制剂,产品的崩解通常是迅速的,口服后的吸收主要受溶出速率和/或渗透速率(渗透性)以及溶解度的限制。当溶出速率远远大于渗透的摄取速率时,胃肠道中药物浓度接近其溶解度极限。因此,药物粒径和/或溶解度可导致溶出缓慢。所以,渗透性、溶解度和/或溶出可限制难溶性药物的吸收。
对于溶出速率限制吸收的难溶性药物,常用来克服溶出缓慢的制剂手段是通过减小粒径来增加比表面积。体外溶出测试对于粒径减小效果的评价具有预测性。但是,粒径非常小时可能使溶出方法的开发变得复杂,因为小颗粒能通过滤膜而造成溶出完全的假象。这种情况下就需要微孔滤膜、离心、超滤或多波长紫外检测等手段。
对于溶解度限制吸收的难溶性药物,可用的制剂手段是使用无定型原料、固体分散体、脂质体技术、包合或其他技术。这些制剂技术会影响溶出方法的选择。在使用无定型原料的制剂中,应考虑溶出过程中可能的晶型转变、溶出液的乳化、稀释后的析出等情形。
二、溶出介质
2.1 一般介质
溶出介质的选择取决于溶出试验的目的,对于批间质量控制,溶出介质的选择依据溶解度数据和药品的剂量范围,以确保达到漏槽条件。如药物溶解度有pH依赖性,溶出介质可能选择某一pH下的缓冲液,但pH一般1.0~6.8之间,该pH条件与人体具有生理相关性,FDA溶出方法数据库中有极少数使用高于pH6.8的介质。
溶解度极低的药物通常采用添加表面活性剂或酶促进药物的溶解。溶出方法中常用的表面活性剂包括十二烷基硫酸钠(SLS)、聚山梨酯、十六烷基三甲基溴化铵(CTAB)或曲拉通(Triton)等,其中,SLS是最常用的表面活性剂。通常表面活性剂的加入量通过漏槽条件进行考察。如表面活性剂过量,溶出方法可能会掩盖药物多晶型或粒径的变化的影响。
2.2 体液模拟液
人的胃液或小肠液相匹配的生物相关性溶出介质(人工胃液、人工肠液)可用于预测药物在体内的释放。空腹状态模拟胃液(FaSSGF)改善了弱碱性药物溶出的预测性,但对中性药物没有预测性。模拟空腹和饱腹状态小肠液的溶出介质,可用于模拟食物的影响、同种活性物质不同产品的吸收差异。
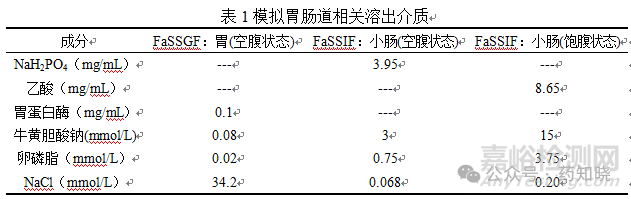
三、溶出装置
常用溶出装置包括篮法装置和桨法装置,转速设置通常为篮法100r/min,桨法50r/min。也有方法选择桨法转速75r/min,以减少杯底物料堆积。单纯从溶解的角度,转速不会影响低溶解度药物的溶解度,但满足漏槽条件的溶出介质中,流体动力学对药物溶出速度可产生较大影响,转速增加溶出速率增加。其他溶出装置往复桶法、流通池法常用于产品开发过程。
四、可接收限度
FDA速释与缓释药品工业指南中包含3种溶出度限度设置方式:
单点法:常用于高溶解性、速释产品的质量控制。
两点法:对于缓慢溶出或者难溶性(BCS Ⅱ类)药物,推荐使用两点法表征产品质量。比如一点在15min溶出度处于某一范围,另一点在其他时间点(30min、45min或60min)溶出度在85%以上。
溶出曲线比较:
FDA速释制剂溶出指南建议低溶解性药物采用2点限度,实际应用中绝大多数难溶性药物的速释制剂均采用单点法。仿制药的生物等效性试验通常可通过体外溶出行为进行确认,但如果仿制产品溶出行为与参比制剂不同,但体内生物等效,则需要设置不同的溶出方法来进行保证产品质量。
五、案例
5.1 不同晶型的药物溶出方法选择
不同晶型的原料药制备的甲苯咪唑片,在含过量表面活性剂的溶出介质中,溶出行为差异被掩盖。
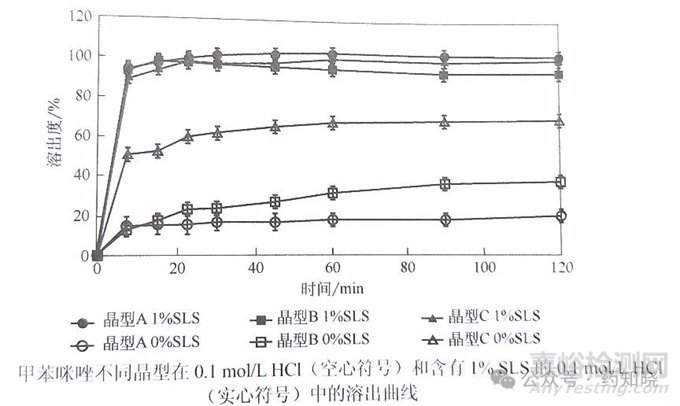
图1 不同晶型的甲苯咪唑片的溶出曲线
5.2 表面活性剂用量的选择
某BCS Ⅱ类药物的溶出方法选择。桨法50r/min介质中:pH4.5缓冲液、pH7.5缓冲液、0.1mol/LHCl和含有25mmol/LSLS的0.1mol/L HCl。
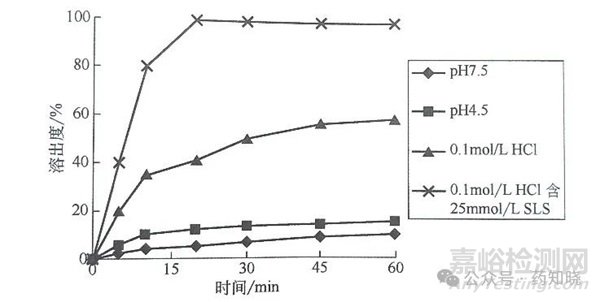
图2 药物在不同溶出介质中的溶出曲线
因含25mmol/LSLS的0.1mol/LHCl介质中药物释放过快,溶出过程的区分性不够明显,因此降低SLS的浓度进行考察。
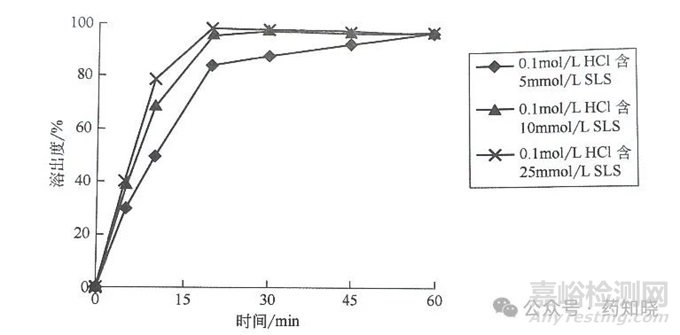
图3 不同浓度的SLS中溶出曲线
降低SLS的浓度时,药物溶出速度相应降低,在含有5mmol/LSLS的介质中药物逐步释放,该介质对产品质量变化有良好指示作用,最终选择含有5mmol/L SLS的0.1mol/LHCl作为溶出介质。
六、小结
溶出方法开发通常需考虑方法设置的目的,是用于质量检测的工具,还是指导处方开发并预测体内释放的体外替代方法。一般情况下,适用于质量控制的方法,可能不适于建立IVIVC;质量控制适用的溶出方法应对产品相关变化有足够敏感度,保证产品的质量一致性;用于体内外相关性的溶出方法应可预测药品在体内的释放更适用于药品研制和获批后生产工艺的变更。两种方法能否合二为一本,在难溶性药物的溶出方法开发中仍存在很大挑战,本文概述的几个方法开发的关键点,希望能对从业者有所启发。

来源:药知晓


