您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-12-11 17:27
目的:梳理信使核糖核酸(mRNA)疫苗的开发、应用现状及产业化挑战,为国内此类产品的开发提供参考。方法:针对mRNA疫苗的设计、特点、生产及应用现状的相关研究进行整理、分析,介绍国内外对mRNA疫苗的监管采取的相关举措,并对这一突破性平台技术未来产业化应用将面临的关键问题进行总结分析。结果与结论:mRNA技术凭借其通用、快速、灵活的特点应用于不同领域的疫苗/药物开发,尤其是mRNA疫苗在抗击新型冠状病毒肺炎疫情上取得了迅速且显著的成效,开启了核酸药物发展的新时代。为了保障mRNA疫苗的安全、有效、可及,部分国家及地区制定了配套的相关法规,并设立了特别审评部门加强对mRNA疫苗的上市监管。由于产品特性、生产工艺的原因,mRNA疫苗产业化在疫苗可及性、生产管理、质量控制、共线生产导致的系统污染风险、知识产权风险以及新病毒变体的开发等多方面均存在挑战。
2020年以来,新型冠状病毒肺炎(CoronaVirus Disease 2019,COVID-19)疫情的发生促成了历史上最快速的疫苗开发[1-3]。信使核糖核酸(Messenger Ribonucleic Acid,mRNA)技术由于其灵活的设计方式、低免疫原性、易于大规模生产的特点被迅速地应用于新冠疫苗开发,并且通过脂质纳米颗粒(Lipid Nanoparticles,LNPs)递送的mRNA疫苗技术路线在预防COVID-19方面已成为现实[4-5]。
本文对mRNA疫苗的结构设计和特点进行分析,并结合近年来国内外监管情况,探讨这一突破性技术平台未来应用产业化将面临的关键问题。
1、mRNA技术
mRNA技术通过核酸在细胞内表达外源蛋白从而达到表达抗原,激活免疫反应或表达功能正常蛋白,修复受损基因的目的[6]。1990年,Jon Wolff团队将体外合成的 mRNA经肌肉注射至小鼠骨骼肌内,首次发现在骨骼肌细胞内有特定蛋白质的表达[7]。但是,由于mRNA的不稳定性、高先天免疫原性和较低的体内递送效率,导致该技术当时并未受到资本的青睐。直至2005年,尿苷修饰mRNA的发现以及递送技术的不断发展才给该领域带来新的生机。2021年,拉斯克奖宣布将临床医学研究奖授予Katalin Karikó和Drew Weissma,以表彰他们发现了基于mRNA修饰的新治疗技术。
基于mRNA技术的治疗手段,根据其潜在作用机制可用于预防性疫苗、治疗性疫苗和治疗性药物[8]。
预防性疫苗,主要应用于感染性疾病的预防,通过mRNA来表达病原体的抗原蛋白,从而激发宿主的获得性免疫反应,产生中和抗体以抵抗病原体的入侵。目前,最为人熟知的预防性mRNA治疗临床实例就是新冠病毒的预防性疫苗,包括2款已经获得美国食品药品管理局(Food and DrugAdministration,FDA)批准上市的疫苗和众多国内外处于临床阶段的疫苗。随着mRNA序列设计、递送技术的不断完善,mRNA技术将不仅在新冠疫苗领域获得突破性进展,在其他传染病预防性疫苗例如预防巨细胞病毒(Cyto-megalo Virus,CMV)、寨卡病毒、呼吸道合胞病毒(Respiratory SyncytialVirus,RSV)、流感病毒、狂犬病毒、人类免疫缺陷病毒(Human Immunodeficiency Virus,HIV)等也都已经进入临床开发阶段[9-11]。其中,季节性流感疫苗也被多家公司布局,如Moderna公司首款进入临床开发阶段的季节性流感疫苗候选产品mRNA-1010的Ⅰ/Ⅱ期临床试验已完成首批受试者接种[12]。
治疗性疫苗,是通过打破机体的免疫耐受,提高机体的特异性免疫反应,对一些目前尚无有效治疗药物的疾病起到治疗作用。其中包括很多处于临床研究阶段的以肿瘤新生抗原为靶点的个性化癌症mRNA治疗疫苗[13]。这些治疗性疫苗通过表达癌症新生抗原蛋白来激活特异性识别癌细胞新生抗原的细胞免疫,从而杀伤癌细胞达到治疗效果。
基于mRNA技术的治疗性药物,其覆盖范围则更加广泛,它们的共同点就是mRNA翻译产物可以作为发挥治疗作用的分子。例如在基于mRNA的基因治疗中,mRNA被递送到有基因缺陷的细胞中,翻译产生正常功能的蛋白从而补偿缺陷基因的部分功能,达到治疗效果。Moderna公司研发的针对VEGF-A靶点的mRNA疗法正在进行2型糖尿病患者治疗的临床实验[14]。此外,BNT141也是由BioNTech公司开发的一款编码Claudin 18.2抗体的mRNA治疗药物,目前正在开展实体瘤治疗的Ⅰ/Ⅱ期临床试验[15]。国内外多家企业还布局了治疗性疫苗(主要为癌症疫苗)和创新mRNA疗法等多个管线,为癌症、罕见疾病、神经系统疾病等提供更有效、更安全的治疗选择[16-17]。
2、mRNA疫苗
mRNA疫苗的基本概念是利用mRNA编码抗原,通过体外转录技术合成mRNA分子,利用合适的递送系统将mRNA运输进入人体,依靠细胞自身的翻译系统将mRNA翻译成目标蛋白,从而达到临床治疗或预防的目的[18-19]。
2.1mRNA疫苗的设计
目前研制的mRNA疫苗主要有2种,从结构可分为非复制mRNA和自扩增mRNA。非复制mRNA序列相对较短,有5个关键组件构成:5’帽结构(Cap)、5’和3’非翻译区(UntranslatedRegion,UTR)、开放阅读框(Open ReadingFrame,ORF)区和3’Poly(A)尾。自扩增mRNA一般基于甲病毒基因组改造而来,其在非复制mRNA的序列基础上还具有编码一种RNA依赖的RNA聚合酶复合物的序列。传统的mRNA疫苗编码目的抗原,而自扩增mRNA利用一种病毒复制机制,使该种mRNA在细胞内扩增并增加蛋白表达,从而最小化mRNA所需剂量[20-22]。
许多因素会影响mRNA在细胞中的稳定性和蛋白表达,例如:5’UTR 或3’UTR 的选择、mRNA的二级结构、Poly(A)尾的优化、mRNA 密码子的优化、修饰核苷酸的选择等。但是,可以通过修改或更改这些组件以提高mRNA的稳定性、翻译效率和免疫刺激特征。因此,设计mRNA分子时需综合考虑这些因素的影响,例如CureVac公司的新冠疫苗CVnCoV,为防止其mRNA被模式识别受体发现的策略就是通过序列工程化和密码子优化来消除疫苗mRNA中的尿嘧啶,同时提高鸟嘌呤和胞嘧啶占所有碱基的比例[23]。
2.2mRNA疫苗的特点
①与DNA疫苗相比,由于抗原翻译发生在细胞质而不是细胞核中,不会整合到基因组,没有造成插入突变的风险,因此,mRNA 疫苗具有更高的生物安全性;
②与基于病毒载体的疫苗相比,mRNA仅具有瞬时活性,通过生理代谢途径可完全降解,使得mRNA不会长期存留在体内,产生毒性;
③mRNA是通过无细胞酶促转录反应产生的,该反应能够实现快速和可扩展的生产。由于其平台化的生产方式,编码不同抗原的mRNA在物理和化学上性质相似,新mRNA疫苗的配方设计和制造过程遵循相同的步骤,因此,更加易于开发且生产工艺相对稳定[24]。
2.3mRNA疫苗的生产方式
mRNA疫苗的技术步骤包括:DNA 质粒构建→体外转录→递送系统装载。该技术具有平台化的生产方式,其中最关键的步骤就是mRNA的设计以及递送系统的装载。由于mRNA是一个包含负电荷的大分子且极不稳定,无法穿过由阴离子脂质构成的细胞膜,且在体内易被核酸酶降解,因此需要创新的递送载体[25]。如前文所说,mRNA的设计方式将影响mRNA在细胞中的稳定性和翻译效率,而递送系统的装载则直接影响最终产品的稳定性、均一性。这些载体技术主要包括:LNPs、脂质多聚物纳米载体技术(Lipopolyplex,LPP)、鱼精蛋白载体技术等[26-27]。因此,研发具有自主知识产权的脂质载体也成为mRNA领域研究的热点和难点。Moderna公司和BioNTech公司开发的2种mRNA新冠疫苗均采用了LNPs递送技术[28],将药物包封于类脂质双分子层内而形成微型泡囊体,通过非共价亲和力和细胞膜结合并通过内吞作用被摄取,进入细胞后,mRNA逃离内吞小泡,被释放到细胞质中表达靶蛋白。但是,这种技术也存在稳定性较差的问题。因此,新型载体的开发以及多种递送体系的有机结合方式有望能够更好地解决递送系统的细胞毒性以及内吞、逃逸、蛋白表达上所面临的问题。
3、mRNA疫苗的国内外监管现状
根据mRNA疫苗作用效果的不同可分为预防性和治疗性。通常预防性疫苗的审评主要由各国/地区的药品监管机构(如FDA)的疫苗组负责,治疗性药品/疫苗由药品组负责,并且在新冠疫情的特殊时期,部分国家和地区也成立了特别审评部门,例如欧洲药品管理局(European MedicinesAgency,EMA)为新冠疫苗开发成立了COVID-19特别工作组(COVID-19 EMA Pandemic TaskForce,ETF),我国也成立了国务院联防联控机制科研攻关组疫苗研发专班专家组,对新冠疫苗的审批实行“统一指挥、提前介入、随到随评、科学审评”的原则,做好应急审批的工作。
3.1国内mRNA疫苗监管相关法规和指导原则
由于新型冠状病毒肺炎疫情防控的应急工作需要,2020年8月,国家药品监督管理局药品审评中心(Center for Drug Evaluation,CDE)集中颁布了5个关于新型冠状病毒预防用疫苗研发技术指导原则,涉及药学研究、非临床研究和临床研究等多个方面(见表1)[29-33]。其中,《新型冠状病毒预防用mRNA疫苗药学研究技术指导原则(试行)》[30]主要针对非复制型mRNA疫苗药学研制制定的技术指导意见,包括模板设计、质粒构建、生产工艺、制剂处方、质量特性及标准制定、稳定性研究、申报临床阶段的考量等多个方面。研发者需根据自身产品相关特点和属性开展相应的研究,针对mRNA新冠疫苗的申报可与CDE提前沟通,进行申报资料的滚动递交。截至2021年9月,艾博生物、斯微生物、丽凡达生物均已有新冠mRNA疫苗产品进入临床试验阶段。
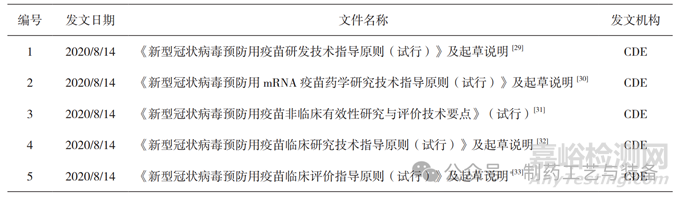
表1 国内mRNA疫苗相关技术监管文件
3.2国外mRNA疫苗监管相关法规和指导原则
2020年12月22日,WHO生物制品标准化委员会(WHO Expert Committee on BiologicalStandardization,ECBS)公开征求对《预防传染病mRNA疫苗的质量、安全性及有效性评价的法规考虑要点》(Evaluation of the Quality, Safety andEfficacy of Messenger RNA Vaccines for the Preventionof Infectious Diseases:Regulatory Considerations)的修订意见[34],ECBS起草小组根据反馈的425条意见于2021年7月再次征求公共意见。该指导原则共有10章,从通用考量、特殊考量、mRNA疫苗生产及质控、非临床评价和临床评价等方面提出对mRNA技术的法规考量点。与前述CDE发布的《新型冠状病毒预防用mRNA疫苗药学研究技术指导原则(试行)》[30]不同的是,这份文件草案的范围不仅限于包装在LNPs 中的mRNA,还包括自扩增型mRNA(sa-mRNA)。同时,WHO明确表示,不应将文件草案视为仅针对新冠疫苗提供指导,并且概述了在适当情况下的具体考虑,以帮助申办人开发多价mRNA疫苗或针对某些病原体改变现有疫苗株。因此,针对mRNA预防性疫苗的开发策略,该草案的适用范围更广,为申请人做全球申报时提供了很重要的参考依据。
FDA于2021年1月19日以及2021年10月1日分别发布了《COVID-19 公共卫生紧急事件期间药品许可及细胞和基因治疗产品的生产考虑》(Manufacturing Considerations for Licensed andInvestigational Cellular and Gene Therapy ProductsDuring COVID-19 Public Health Emergency)和《关于Comirnaty问答(COVID-19 mRNA疫苗)》[Q&Afor Comirnaty(COVID-19 Vaccine mRNA)],对申请人在新冠相关mRNA疫苗申报时做出指导[35-36]。EMA也于2021年9月16日发布了《EMA 关于加速COVID-19治疗和疫苗开发支持和评估程序的举措》(EMA Initiatives for Acceleration of DevelopmentSupport and Evaluation Procedures for COVID-19Treatments and Vaccines)[37],但这些举措都仅限于与新冠疫苗相关的产品。见表2。

表2 国外mRNA疫苗相关技术监管文件
3.3其他相关法规和指导原则
mRNA具有的递送系统通常包括LNPs、LPP等。在制剂的质量研究、药代动力学、非临床安全性研究方面,可以借鉴有关纳米药物指导原则。
此外,治疗型mRNA疫苗是在体内通过表达特定蛋白,刺激机体产生特异性免疫反应,可借鉴基因治疗产品相关的部分要求。但是,该类疗法与基因治疗产品的风险不同,目前国内外尚无先例可循,并不完全适用所有基因治疗产品的技术要求,期待监管部门和企业共同努力,建立mRNA疗法适用的监管要求和指导原则。
3.4mRNA疫苗的监管现状
mRNA疫苗作为一种新兴技术,目前暂无监管案例可循。在Moderna公司和辉瑞/BioNTech公司的mRNA新冠疫苗获得FDA、EMA等监管机构紧急授权使用以来,EMA于2021年8月11日已发出相关警告:mRNA疫苗可能有更多危险副作用,这些症状包括多形红斑、肾小球肾炎或肾脏炎症、肾病症候群等[38]。美国疾病控制与预防中心也发现,青少年群体中罕见的心脏炎症,可能与使用了mRNA技术的新冠疫苗接种存在关联。从疫苗临床安全性角度出发,应持续监测产品上市后不良反应,以及对生理功能潜在的非期望作用,包括但不限于对中枢神经系统、心血管系统、呼吸系统等多方面的影响。由于mRNA疫苗供应需求的激增,疫苗生产场地遍布全球各地,在目前全球国际交通受限的情况下,监管机构对各个生产场地的现场核查挑战无疑是巨大的。事实上,FDA授权新冠疫苗之前并没有做批准前检查;而对于部分原液及重要辅料,包括LNP的生产场地,也均未开启GMP检查。因此,从疫苗质量及生产角度出发,国内疫苗生产企业尚可派驻驻厂员监管,但对于全球其他国家/地区的生产场地,无疑需要远程核查方式的进一步探索,包括检查的频次和内容均需要全球监管机构进行深入探究。
4、mRNA疫苗产业化存在的相关问题
由于产品特性、生产工艺的原因,mRNA疫苗产业化存在多方面挑战。包括:
4.1疫苗的可及性
现有mRNA疫苗对冷链运输要求较高,例如Moderna公司和BioNTech公司开发的2种mRNA新冠疫苗分别需要在-15~-25℃和-60~-90℃的条件下进行储存和运输,较高的运输成本无疑给疫苗的跨国供应带来困难。可以通过持续的工艺优化稳定递送系统的包封率提高产品的稳定性,开发耐热性更好的疫苗。
4.2mRNA疫苗的生产管理及质量控制
从质粒生产、体外转录中复杂物料体系的混合和控制(包含多种酶的参与)、递送系统装载时mRNA-LNP的纯化工序以及生产过程中各级中间产品/成品的质量评价,mRNA疫苗生产时所面临的挑战贯穿于各个环节,都需要在疫苗完成最初的结构设计之后对工艺进行持续的优化和质量的提升[39]。
4.3防止共线生产导致的系统污染风险
由于国际生产产能紧缺以及已上市品种数目较少的原因,尚无产品存在共线生产的情况。但是,由于mRNA疫苗模块化、平台化的生产特点,未来,新mRNA疫苗的生产将很有可能采用同一生产车间或生产线,如何建立全封闭mRNA疫苗生产方式,以及对清洁验证的挑战是企业必须要提前思考的问题。
4.4开发拥有自主知识产权的mRNA疫苗
核酸递送系统、基因修饰、加帽技术是mRNA开发的几个高壁垒,其核心专利仍掌握在少数几家企业手中,因此,mRNA技术在中国的产业化落地必须考虑可能面临的知识产权风险。
4.5新出现病毒变体的疫苗开发
病毒基因组在复制时常常会发生突变,新型冠状病毒尤其如此。目前,正处在早期开发阶段的新冠mRNA疫苗研发单位均已开始针对各类病毒突变株进行研究,CureVac公司也于2021年10月宣布退出其第一代COVID-19候选疫苗的开发,转移到二代疫苗的开发上。从长远角度来看,能够开发一种预防新冠病毒和其他未来冠状病毒的泛冠状病毒疫苗非常重要。可以针对不同冠状病毒中的保守位点,加快抗原发现和疫苗设计。
5、结 语
由于mRNA设计和核酸递送技术数十年来的发展,这些多方面的技术创新结合在一起,克服了mRNA疫苗生产方面的诸多挑战,促进了简易、有效、灵活机动、可扩大化的平台化合成流程的诞生。目前,辉瑞制药公司/BioNTech制药公司的新冠疫苗已于2021年8月获得FDA的正式批准(16岁以上人群)[40],Moderna公司也已完成FDA的生物制品许可申请。我国自COVID-19疫情发生以来,涌现了多家基于mRNA技术的新锐公司,但是到目前为止,国内尚无已批准上市的mRNA疫苗产品,除了复星医药引进BioNTech公司的mRNA疫苗产品外,我国多家公司的mRNA产品均处于临床或早期开发阶段。如前文所述,作为一种新兴技术,使用mRNA作为疫苗/疗法仍然面临诸多挑战,仍需克服mRNA开发核心技术的高壁垒。同时,对监管机构而言,与产品特性相匹配的相关法规和技术指导原则仍有待完善。随着生物技术的飞速发展,相信在不久的将来,基于mRNA技术的产品将在生物制品领域占有重要的地位。本文对近年来mRNA技术的应用领域、mRNA疫苗的设计和特点,并结合国内外监管情况进行综述,探讨该平台产业化应用目前存在的一些关键问题,以期为国内此类产品的开发提供参考。
参考文献
[1] Thanh Le T, Andreadakis Z, Kumar A, et al. The COVID-19Vaccine Development Landscape[J]. Nat Rev DrugDiscov,2020,19(5):305-306.
[2] Huang Q, Zeng J, Yan J. COVID-19 mRNA Vaccines[J]. JGenet Genomics,2021,48(2):107-114.
[3] Lamb Y N. BNT162b2 mRNA COVID-19 Vaccine: FirstApproval[J]. Drugs,2021,81(4):495-501.
[4] Teo S P. Review of COVID-19 mRNA Vaccines:BNT162b2 and mRNA-1273[J]. J Pharm Pract, 2021,DOI:10.1177/08971900211009650.
[5] Skowronski DM, De Serres G. Safety and Efficacy of theBNT162b2 mRNA Covid-19 Vaccine[J]. N Eng J Med,2021,384(11):10.
[6] Dolgin E. The Tangled History of mRNA Vaccines[J].Nature,2021,597(7876):318-324.
[7] Wolff JA, Malone RW, Williams P, et al. Direct GeneTransfer into Mouse Muscle in Vivo[J]. Science,1990,247(4949 Pt 1):1465-8.
[8] Wang Y, Zhang Z, Luo J, et al. mRNA Vaccine: A PotentialTherapeutic Strategy[J]. Mol Cancer,2021,20(1):33.
[9] Pardi N, Hogan MJ, Weissman D. Recent Advances inmRNA Vaccine Technology[J]. Curr Opin Immunol, 2020(65):14-20.
[10] Flemming A. mRNA Vaccine Shows Promise inAutoimmunity[J]. Nat Rev Immunol,2021,21(2):72.
[11] Jeeva S, Kim KH, Shin CH, et al. An Update on mRNABased Viral Vaccines[J]. Vaccines (Basel),2021,9(9):965.
[12] Moderna. Moderna Announces First Participant Dosed inPhase 1/2 Study of Its Quadrivalent Seasonal Flu mRNAVaccine[EB/OL].(2021-07-07)[2021-10-18]. https://investors.modernatx.com/news/news-details/2021/Moderna-Announces-First-Participant-Dosed-in-Phase12-Study-of-Its-Quadrivalent-Seasonal-Flu-mRNAVaccine-07-07-2021/default.aspx.
[13] Miao L, Zhang Y, Huang L. mRNA Vaccine for CancerImmunotherapy[J]. Mol Cancer,2021,20(1):41.
[14] Anttila V, Saraste A, Knuuti J, et al. Synthetic mRNAEncoding VEGF-A in Patients Undergoing Coronary ArteryBypass Grafting: Design of a Phase 2a Clinical Trial[J]. MolTher Methods Clin Dev,2020(18):464-472.
[15] ClinicalTrials.gov. Safety, Pharmacokinetics, Pharmacodynamics,and Preliminary Efficacy Trial of BNT141[EB/OL].(2020-12-24)[2021-10-18]. https://www.clinicaltrials.gov/ct2/show/NCT04683939.
[16] Zhang C, Maruggi G, Shan H, et al. Advances in mRNAVaccines for Infectious Diseases[J]. Front Immunol,2019(10):594.
[17] Khalid K, Padda J, Khedr A, et al. HIV and Messenger RNA(mRNA) Vaccine[J]. Cureus,2021,13(7):e16197.
[18] Lavarone C, O’Hagan DT, Yu D, et al. Mechanismof Action of mRNA-based Vaccines[J]. Expert RevVaccines,2017,16(9):871-881.
[19] Uchida S, Perche F, Pichon C, et al. Nanomedicine-BasedApproaches for mRNA Delivery[J]. Mol Pharm,2020,17(10):3654-3684.
[20] Liu T, Liang Y, Huang L. Development and DeliverySystems of mRNA Vaccines[J]. Front Bioeng Biotechnol,2021(9):718-753.
[21] Karpenko LI, Rudometov AP, Sharabrin SV, et al. Deliveryof mRNA Vaccine against SARS-CoV-2 Using aPolyglucin: Spermidine Conjugate[J]. Vaccines (Basel),2021,9(2):76.
[22] Verbeke R, Lentacker I, De Smedt SC, et al. Three Decadesof Messenger RNA Vaccine Development[J]. Nano Today,2019(28):100766.
[23] Chaudhary N, Weissman D, Whitehead K A. mRNAVaccines for Infectious Diseases: Principles, Delivery andClinical Translation[J]. Nat Rev Drug Discov,2021,20(11):880.
[24] Topol EJ. Messenger RNA Vaccines Against SARS-CoV2[J]. Cell,2021,184(6):1401.
[25] Reichmuth AM, Oberli MA, Jaklenec A, et al. mRNAVaccine Delivery Using Lipid Nanoparticles[J]. TherDeliv,2016,7(5):319-334.
[26] Kramps T, Probst J. Messenger RNA-Based Vaccines:Progress, Challenges, Applications[J]. Wiley InterdiscipRev RNA,2013,4(6):737-49.
[27] Iavarone C, O'hagan DT, Yu D, et al. Mechanism of Actionof mRNA-Based Vaccines[J]. Expert Rev Vaccines,2017,16(9):871-881.
[28] Kim J, Eygeris Y, Gupta M, et al. Self-Assembled mRNAVaccines[J]. Adv Drug Deliv Rev,2021(170):83-112.
[29] 国家药品监督管理局. 新型冠状病毒预防用mRNA疫苗药学研究技术指导原则(试行)[EB/OL].(2020-08-14)[2021-10-18]. http://www.gov.cn/xinwen/2020-08/15/content_5535069.htm.
[30] 国家药品监督管理局.《新型冠状病毒预防用疫苗临床研究技术指导原则(试行)》及起草说明[EB/OL].(2020-08-14)[2021-10-18]. http://www.gov.cn/xinwen/2020-08/15/content_5535069.htm.
[31] 国家药品监督管理局.《新型冠状病毒预防用疫苗临床评价指导原则(试行)》及起草说明[EB/OL].(2020-08-14)[2021-10-18]. http://www.gov.cn/xinwen/2020-08/15/content_5535069.htm.
[32] 国家药品监督管理局.《新型冠状病毒预防用疫苗研发技术指导原则(试行)》及起草说明[EB/OL].(2020-08-14)[2021-10-18]. http://www.gov.cn/xinwen/2020-08/15/content_5535069.htm.
[33] 国家药品监督管理局. 新型冠状病毒预防用疫苗非临床有效性研究与评价技术要点(试行)[EB/OL].(2020-08-14)[2021-10-18]. http://www.gov.cn/xinwen/2020-08/15/content_5535069.htm.
[34] WHO. Evaluation of the Quality, Safety and Efficacy ofMessenger RNA Vaccines for the Prevention of InfectiousDiseases: Regulatory Considerations[EB/OL].(2021-07-14)[2021-10-18]. https://prais.paho.org/en/publicconsultation-on-evaluation-of-the-quality-safety-andefficacy-of-messenger-rna-vaccines-for-the-preventionof-infectious-diseases-regulatory-considerations/.
[35] FDA. Manufacturing Considerations for Licensed andInvestigational Cellular and Gene Therapy ProductsDuring COVID-19 Public Health Emergency[EB/OL].(2021-01-19)[2021-10-18]. https://www.fda.gov/regulatory-information/search-fda-guidancedocuments/manufacturing-considerations-licensed-andinvestigational-cellular-and-gene-therapy-productsduring.
[36] FDA. Q&A for Comirnaty(COVID-19 Vaccine mRNA)[EB/OL].(2021-10-18)[2021-10-18]. https://www.fda.gov/vaccines-blood-biologics/qa-comirnaty-covid-19-vaccine-mrna.
[37] EMA. EMA Initiatives for Acceleration of DevelopmentSupport and Evaluation Procedures for COVID-19Treatments and Vaccines[EB/OL].(2021-09-16)[2021-10-18]. https://www.ema.europa.eu/en/documents/other/ema-initiatives-acceleration-development-supportevaluation-procedures-covid-19-treatments-vaccines_en.pdf.
[38] EMA. Safety Updates for Authorised COVID-19 Vaccines[EB/OL].(2021-08-11)[2021-10-18]. https://www.ema.europa.eu/en/human-regulatory/overview/public-healththreats/coronavirus-disease-covid-19/treatmentsvaccines/vaccines-covid-19/safety-covid-19-vaccines.
[39] Rosa SS, Prazeres DMF, Azevedo AM, et al. mRNAVaccines Manufacturing: Challenges and Bottlenecks[J].Vaccine,2021,39(16):2190-2200.
[40] FDA. Summary Basis for Regulatory Action- Comirnaty[EB/OL].(2021-08-11)[2021-10-18].https://www.fda.gov/media/151733/download.
本文作者孙程洁、成殷、王冲,上海药品审评核查中心,来源于中国药事,仅供交流学习。

来源:Internet


