您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-12-14 14:38
介绍
血流导向装置(FDs)的引入显著改善了未破裂颅内动脉瘤(IAs)患者的治疗效果。然而,目前可用的FDs采用非生物可吸收金属构造,长期使用可能面临金属残留带来的潜在并发症。为了解决这些问题,使用不同类型的可吸收材料已经开发出了多种类型的生物可吸收血流导向装置(BRFDs)。镁作为生物可吸收材料的优势有几个方面。首先,镁支架比聚合物支架更为刚性,且不易发生蠕变变形(支架因应力而缓慢变形的过程)。其次,镁在降解过程中由于其负电荷特性,具有抗血栓的优势。第三,镁支架在多项临床研究中已显示出优良的安全性和生物相容性。
生物可吸收支架的研究已经在冠状动脉疾病的治疗中取得了先驱性进展。尽管生物可吸收聚合物冠状动脉支架因支架内血栓形成而退出市场,但基于镁的支架已发展到第三代。最近的一项研究显示,生物可吸收镁支架在症状性冠状动脉疾病患者中,1年结果与非生物可吸收支架相当。因此,镁应成为生物可吸收血流导向装置(BRFDs)中合适的材料。
尽管这一积极结果,镁生物可吸收血流导向装置(MgBRFDs)的开发仍受到材料限制的阻碍。两个主要挑战是镁的强度和其快速吸收率。镁的强度低于钴铬合金和镍钛合金,因此,生产细镁丝并将其编织以构造血流导向装置是困难的。其快速生物吸收周期令人担忧,因为MgBRFD可能在动脉瘤愈合之前就被吸收。2023年的一项概念验证研究中对MgBRFD的体外吸收分析显示,其在5周内完全吸收,这突显了延长其吸收时间的解决方案的必要性。
我们开发了一种镁合金(KUMADAI Magnesium),采用快速固化粉末冶金工艺,具有独特的长周期堆垛有序结构。与传统镁合金相比,这种合金表现出优越的强度、增强的加工性和改善的耐腐蚀性。这种合金的独特性质使得生产细丝成为可能,并成功开发出镁生物可吸收血流导向装置(MgBRFD)。由于根据之前的研究,吸收时间可能较快,我们还开发了一种将聚-L-乳酸(PLLA)涂覆在镁丝上的方法,以提高耐腐蚀性并延长吸收时间。本研究旨在比较兔血管模型中涂覆PLLA和未涂覆(裸)MgBRFD的生物相容性和生物吸收性。我们的最终目标是确定哪种类型的MgBRFD在人类临床应用中更具可行性。
方法
MgBRFD的设计和力学测试
镁合金的元素组成如图1所示。裸MgBRFD是通过编织48根直径为46微米的镁合金线制成的(图1A–D)。PLLA涂层的厚度为5微米,涂覆后的丝径为56微米。使用了一种高分子量的PLLA(BMG, Kyoto, Japan),其加权平均分子量为220,000 g/mol,作为PLLA涂层。两个MgBRFD的直径均为4.0毫米。支架根据下面描述的每个实验的需要切割到所需的长度。每个装置的两端都附有三个不透射线黄金标记。
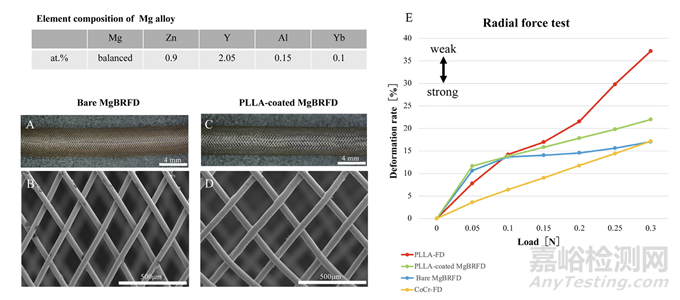
图1:镁基生物可吸收血流导向装置(MgBRFDs)的结构和机械性能。裸MgBRFD的外观和扫描电子显微镜图像(分别为A和B)以及聚乳酸(PLLA)涂层MgBRFD的外观和扫描电子显微镜图像(分别为C和D)。(E) PLLA血流导向装置、PLLA涂层MgBRFD、裸MgBRFD和钴铬血流导向装置的径向力测试结果。
在两个MgBRFD中进行了径向力测试以及孔隙率和孔隙密度评估,具体方法如之前的研究所述。此外,还在改进的钴铬(CoCr)FD模型和生物可吸收PLLA FD中进行了径向力测试,这些支架是在我们之前的研究中开发的,目的是进行比较。
活体动脉实验
动物研究方案已获得京都大学医学院机构动物护理委员会的批准(Med Kyo 21592, 23264)。实验中使用了26只雌性新西兰白兔(2.6–3 kg; Kitayama Labs, Ina, Japan)。
MgBRFD植入和解剖
研究流程图见在线补充图1。动物在FD植入前1周开始口服阿司匹林(30 mg/天)和氯吡格雷(30 mg/天),具体方法如前所述。通过右侧股动脉将单个MgBRFD植入每只兔的腹主动脉(13个裸MgBRFD植入在13只兔子中,13个带PLLA MgBRFD植入在13只兔子中)。常规进行球囊成形术,以改善与血管壁的贴壁性。
补充图1:研究流程图
兔子在14天、30天和90天时随机处死(每个时间点n=4)。通过左侧股动脉置入5 F鞘管,进行光学相干断层成像(OCT; ILUMIEN OPTIS; Abbott Vascular, Santa Clara, California, USA)和血管造影。随后对兔子进行安乐死,并收集血管。更多细节请参见在线补充方法。
血管造影和OCT分析
在FD植入前、后及随访期间进行了血管造影,以评估被覆盖的腰动脉的闭塞情况。植入后的即刻以及随访时进行了光学相干断层成像(OCT),以评估支架的吸收、被覆盖微血管的通畅性和支架内狭窄。由于之前的研究表明,OCT衰减评分与镁支架的生物吸收相关,因此我们计算了MgBRFD的原始OCT衰减评分以评估其生物吸收。衰减评分定义如下:2:支柱轮廓清晰可见,支柱后完全衰减;1:支柱模糊可见,但支柱后没有衰减;0:无法检测到支柱或支柱后有衰减。评分通过对FD中间横截面视图上每个支柱的评分进行求和计算(图2A,B)。由于植入沿分支血管段的FD部分是最容易因持续的垂直血流而降解/吸收的部位,因此在该部位使用OCT评估降解/吸收(图3A)。OCT还用于评估小分支血管(直径小于500微米)的通畅性。支架腔狭窄的计算方法如之前的研究所述。
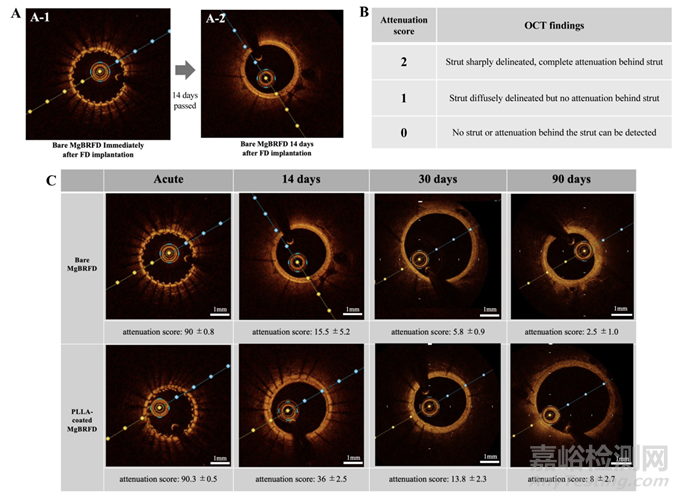
图2:光学相干断层扫描(OCT)衰减评分。OCT衰减评分是在血流导向装置中部的OCT横截面视图中测量的。(A-1) 植入后立即,支架支柱清晰可见,向后完全衰减。(A-2) 随着降解的进展,支架支柱和向后衰减变得模糊不清。(B) 为了量化这种变化,OCT衰减评分通过对每个支柱的评分进行求和来计算。(C) 随时间变化的评分和代表性的横截面OCT图像。数据显示为均值±SE。在14天和30天时,聚乳酸(PLLA)涂层的镁基生物可吸收血流导向装置(MgBRFD)显示出比裸MgBRFD更多的支架支柱和衰减,因此PLLA涂层MgBRFD的衰减评分显著更高(14天时P=0.01;30天时P=0.02)。在90天时,PLLA涂层MgBRFD的衰减评分仍显著更高(P=0.04);然而,绝对值较低,且在裸MgBRFD和PLLA涂层MgBRFD中均未能观察到支架支柱。
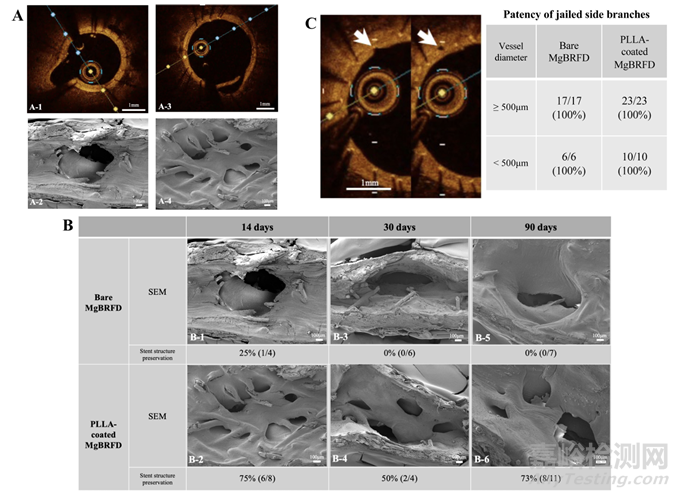
图3:支架结构的降解分析及被覆盖侧支的通畅性。植入裸镁基生物可吸收血流导向装置(MgBRFD)14天后,侧支处的横截面光学相干断层扫描(OCT)图像(A-1)和聚乳酸(PLLA)涂层MgBRFD的图像(A-3)。相应的扫描电子显微镜(SEM)图像显示了侧支部位血管腔内表面,分别为A-2和A-4。这些图像清晰地描绘了侧支部位支架结构的破坏或保留情况。(B) 使用SEM和OCT图像对侧支部位支架结构的降解分析。植入后14天、30天和90天的SEM图像显示。百分比表示在每个时间点上,OCT图像所示支架结构的保留率。在所有时间点上,PLLA涂层MgBRFD在侧支部位的支架结构保留情况更好。(C) 两幅连续的OCT图像显示了直径约为100微米的分支血管的通畅性(白色箭头)。右侧的表格显示了根据血管直径被覆盖侧支的通畅性百分比。
Micro-CT(µCT)分析
使用SkyScan 1172扫描仪(Bruker, Kontich, Belgium)对植入后0、14、30和90天选定的mgbrfd进行µCT扫描,以评估石蜡包埋后支架结构的保存情况(见在线补充图1)。成像参数的详细信息在在线补充方法中描述。
扫描电子显微镜(SEM)和能量色散X射线光谱(EDX)分析
在植入后14天、30天和90天,对选定的MgBRFD进行了扫描电子显微镜(SEM)和能量色散X射线光谱(EDX)分析(每个时间点n=1或2;见在线补充图1)。通过SEM观察支架表面的新生内膜覆盖情况来评估生物相容性。使用EDX对支架中心横截面的代表性支架支柱进行元素分析,以评估降解状态和降解产物。对代表性支架支柱进行了映射分析。随机选择了八个代表性支架支柱,并在每个支柱的中心进行了点分析。SEM和EDX的组织处理及成像细节在在线补充方法中描述。
组织病理学处理和分析
在植入后14天、30天和90天,对选定的MgBRFD进行了组织病理学分析(每个时间点n=2或3;见在线补充图1)。每个收集的FD被分为三个部分(近端、中段和远端),每个横截面使用苏木精-伊红、Elastica van Gieson染色和马松三色染色。
还在同一部分进行了钙结合蛋白1(Iba-1)、Ki67和α-平滑肌肌动蛋白(α-SMA)的免疫组化染色。组织病理学标本的处理和染色细节在在线补充方法中描述。新生内膜厚度的测量方法参照之前的报告进行。对新生内膜中Iba-1阳性细胞的细胞计数用于评估局部炎症。由于Iba-1无法染色侵入支架支柱的巨噬细胞,因此通过苏木精-伊红染色测量被巨噬细胞浸润的支架支柱的百分比,以作为局部炎症的另一项评估。Ki67细胞计数用于评估新生内膜中的增殖状态。α-SMA染色用于评估新生内膜的成熟度。所有测量均以盲法进行。组织病理学组织处理和分析的详细信息在在线补充方法中描述。
统计分析
统计分析使用JMP Pro 17(SAS Institute, Cary, North Carolina, USA)或Prism 10(GraphPad Software, San Diego, California, USA)进行。连续变量用SD表示平均值,并使用未配对双尾t检验或单因素方差分析与Tukey事后检验进行比较。分类数据使用卡方检验或Fisher精确检验进行比较。P值<0.05被认为具有统计学意义。
结果
MgBRFD的物理力学性能
裸MgBRFD的孔隙率和孔密度分别为64%和16 pores /mm²;而PLLA涂层MgBRFD的对应值为63%和12 pores /mm²。径向力测试结果如图1E所示。裸MgBRFD和PLLA涂层MgBRFD的强度高于PLLA-FD,但低于CoCr-FD。
血管造影和OCT结果
血管造影显示,在所有时间点,两种类型的MgBRFD的腰动脉均保持通畅(见在线补充图2)。OCT衰减评分结果如图2C所示。在所有时间点,PLLA涂层MgBRFD的OCT衰减显著高于裸MgBRFD(14天,P=0.01;30天,P=0.02;90天,P=0.004)。然而,90天时两种类型的衰减评分绝对值均较低。支架结构在侧支血管起始处的保存情况如图3B所示。在所有时间点,PLLA涂层MgBRFD的支架结构保存情况更好。PLLA涂层和裸MgBRFD的整体结构保存率分别为73%和5%。所有直径小于500 µm的小侧支血管在两种类型中均保持通畅(见图3C)。OCT显示支架腔轻微狭窄:每种类型MgBRFD的最大狭窄均小于10%(见在线补充图3)。
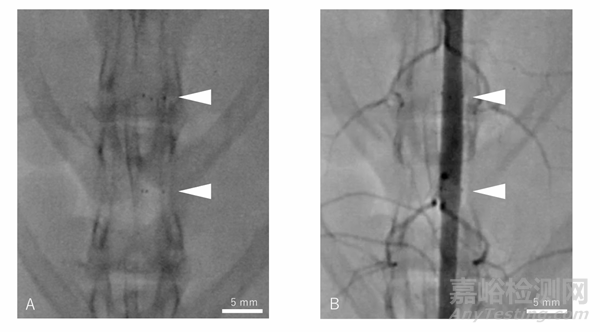
补充图2:PLLA涂层MgBRFD植入后3个月的血管造影。A:透视图像。显示支架本身不具显影性,仅在两端有显影标记。B:血管造影图像。显示主动脉及其侧支的通畅性,支架覆盖在这些血管上。白色箭头:指示显影标记的位置。
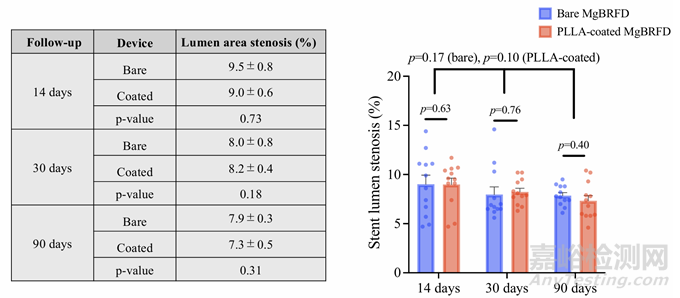
补充图3:OCT证实管腔狭窄率
μCT结果
μCT结果如在线补充图4所示。在14天和30天时,裸MgBRFD表现出更多的支柱断裂。
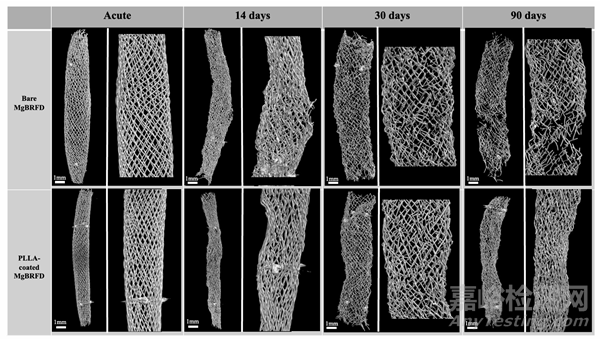
补充图4:MgBRFDs的μCT结果随时间变化。在每个MgBRFD的各个随访时间点,图像左侧为整体图像,右侧为放大图像。在14天时,裸MgBRFD在放大图像中显示了侧支上方已破坏的支架结构。在30天时,裸MgBRFD在放大图像中显示出比PLLA涂层MgBRFD出现更多断裂的支架支柱。在90天时,裸MgBRFD显示出大面积已损失的支架结构。
在90天时,裸MgBRFD观察到大量的支架结构损失,而PLLA涂层支架则没有出现这种情况。
SEM和EDX结果
SEM图像显示,在14天时,每个MgBRFD的整个腔面均有出色的新生内膜覆盖(见图4A)。PLLA涂层MgBRFD的支架支柱表面也观察到了良好的新生内膜覆盖,即使在侧支起始处,这里通常是最难实现覆盖的区域(见图3B-2)。在侧支位置,PLLA涂层MgBRFD的支架结构保存情况更好(见图3B)。EDX元素分析结果如图5和在线补充表1所示。在14天的映射分析中,仅在PLLA涂层MgBRFD的支架支柱中心观察到镁。然而,在30天后,镁在两种类型的MgBRFD中几乎不可识别。分解为钙的过程与此类似。在点分析中也观察到了相同的趋势。镁合金的分解产物被推测为磷酸钙。
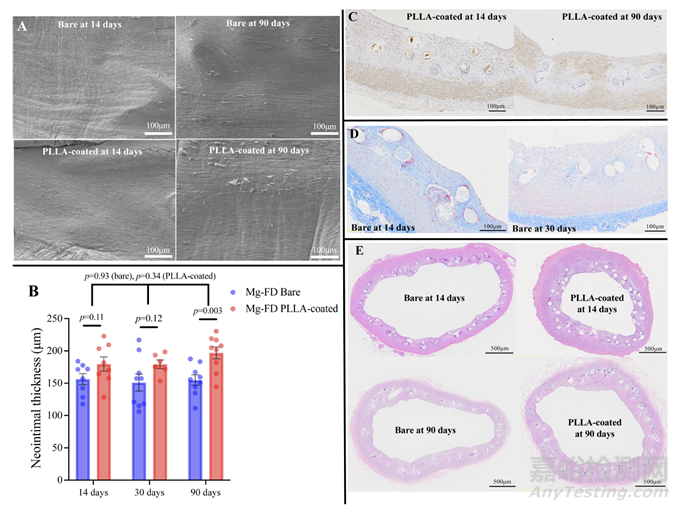
图4:(A) 扫描电子显微镜图像。植入的裸镁基生物可吸收血流导向装置(MgBRFDs)和聚乳酸(PLLA)涂层MgBRFD的腔内表面图像。14天时,两个支架的整个表面均覆盖着光滑的新内膜;观察到未成熟的内皮细胞呈鹅卵石状排列。内皮细胞完全成熟,具有明确的细长细胞,沿着血流方向排列。(B) 新内膜厚度变化。点图显示每个切片的新内膜厚度。数据显示为均值±SE。(C) α-平滑肌肌动蛋白(α-SMA)免疫反应性。14天和90天的新内膜中α-SMA免疫反应性的代表性图像。14天时,多个α-SMA阳性的平滑肌细胞浸润新内膜,并随着时间的推移而增加。(D) 植入裸MgBRFD的横截面组织学图像。在14天和30天(马松三色染色)时的横截面组织学图像。14天时,新内膜内的细胞外基质丰富。到30天时,细胞外基质减少,并观察到细胞成分的浸润。(E) 植入裸MgBRFD和PLLA涂层MgBRFD的横截面组织学图像(苏木精-伊红染色)。
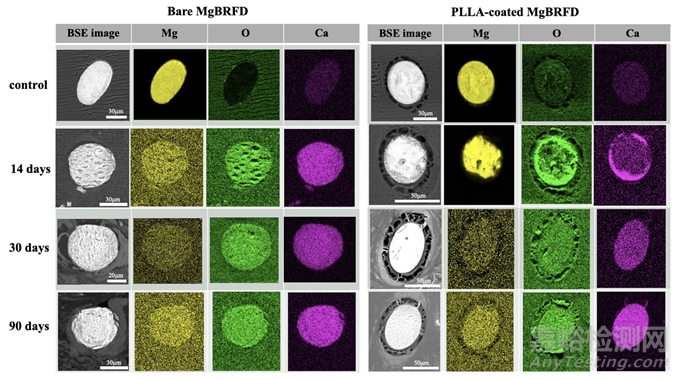
图5:能量色散X射线光谱映射分析结果显示了代表性支架支柱的横截面。在14天时,聚乳酸(PLLA)涂层的镁基生物可吸收血流导向装置(MgBRFD)中,支架支柱的大部分区域可以看到镁的存在,并且从周围区域逐渐转变为降解产物。相比之下,在裸MgBRFD中,支架支柱中的镁浓度在14天时几乎与背景相同,降解产物完全替代了整个支柱。30天后,无论是裸支架还是PLLA涂层支架,几乎都未观察到镁的存在,降解产物完全替代了整个支柱。BSE,背散射电子。
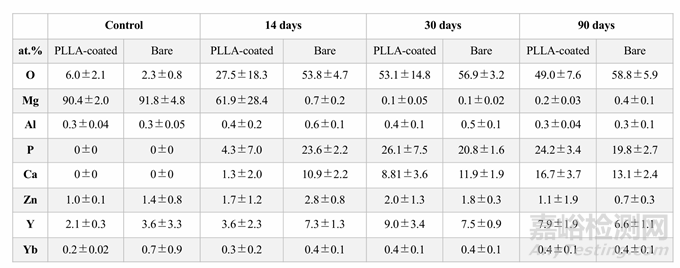
补充表1:EDX对MgBRFDs截面上降解产物随时间变化的点分析结果。数据为平均值±标准差。点分析与映射分析呈现相同的趋势。在长达14天的时间里,PLLA涂层的MgBRFD中仍然有更多的Mg元素,但在30天后,两种MgBRFD之间没有观察到差异。推测镁合金的分解产物为磷酸钙。
组织病理学结果
植入14天后,两种MgBRFD中的新生内膜内开始出现α-SMA阳性的分化平滑肌细胞,内皮细胞几乎覆盖了新生内膜的整个表面。尽管在14天时,两种类型的新生内膜中细胞外基质(在马松三色染色中呈蓝色)占据了大部分,但随着时间的推移,细胞外基质减少,而由α-SMA阳性分化平滑肌细胞组成的细胞成分增加,表明新生内膜进一步成熟(见图4C、D)。两种MgBRFD之间的新生内膜成熟程度没有显著差异。
新生内膜厚度的时间变化如图4B、E和在线补充表2所示。在14天和30天时,两组之间的厚度没有显著差异;然而,在90天时,PLLA涂层组的新生内膜显著更厚(P=0.003)。在两种类型中,新生内膜的厚度随时间变化不显著(裸MgBRFD,P=0.93;PLLA涂层,P=0.34)。
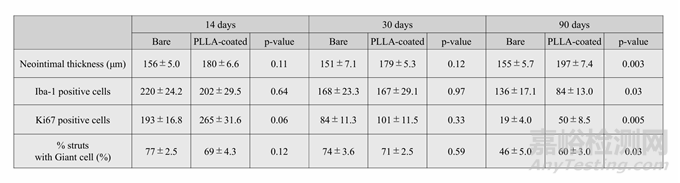
补充表2:组织病理学结果
Iba-1和Ki67的细胞计数以及被巨噬细胞浸润的支架支柱百分比如图6和在线补充表2所示。在90天时,裸MgBRFD组的Iba-1阳性细胞数量显著高于其他时间点(14天,P=0.64;30天,P=0.97),但在90天时显著增加(P=0.03)。两组中Iba-1阳性细胞数量随时间显著减少(裸MgBRFD,P=0.04;PLLA涂层,P=0.005)。裸MgBRFD组中,带有巨噬细胞的支柱百分比随时间显著减少(30天与90天比较,P=0.008;14天与90天比较,P<0.001)。在PLLA涂层MgBRFD组中也观察到类似趋势,但差异不显著(P=0.12)。尽管在14天和30天时Ki-67阳性细胞数量在两组之间没有显著差异(14天,P=0.06;30天,P=0.33),但在90天时PLLA涂层组的数量显著更高(P=0.005)。裸MgBRFD组的Ki-67阳性细胞数量随时间显著减少(14天与30天比较,P=0.001;30天与90天比较,P=0.002),PLLA涂层组也是如此(14天与30天比较,P=0.008;30天与90天比较,P=0.02)。
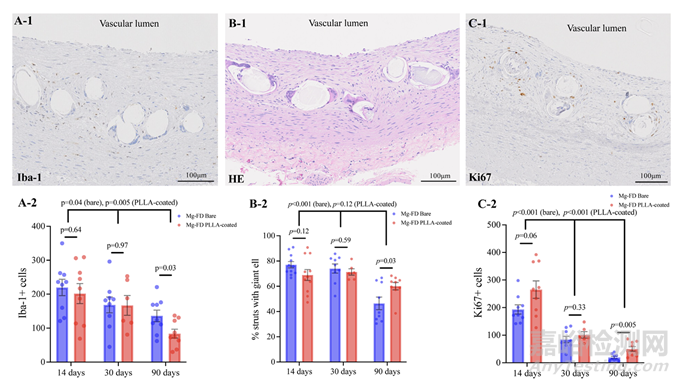
图6:(A-1) Iba-1免疫反应性的代表性图像。显示了新内膜中Iba-1的免疫反应。(A-2) Iba-1阳性细胞计数。点图显示每个切片中的Iba-1阳性细胞数量。(B-1) 巨噬细胞浸润的支架支柱代表性图像。显示了被巨细胞浸润的支架支柱。(B-2) 巨细胞占据支柱的百分比。点图显示每个切片中巨细胞占据的支柱百分比。(C-1) Ki67免疫反应性的代表性图像。显示了新内膜中Ki67的免疫反应。(C-2) Ki67阳性细胞计数。点图显示每个切片中的Ki67阳性细胞数量。数据说明:图表中的数据表示均值±SE。
讨论
在这项关于兔血管模型中MgBRFD的研究中,早期达到了相对成熟的新生内膜覆盖,确认了其良好的生物相容性。此外,应用PLLA涂层延缓了其降解。以往对MgBRFD的动物动脉瘤模型研究使用了冠状动脉支架设计,与FDA批准的永久性FD设计完全不同。在Oliver等人设计的MgBRFD的体外研究中,孔隙率为81%,孔隙密度为4.3 pores /mm²。这些特性远未理想,难以实现足够的流量分流效果。相比之下,我们的MgBRFD的孔隙率和孔隙密度与FDA批准的永久性FD相当。根据我们所知,本研究首次确认了具有与传统永久FD相似结构的MgBRFD的体内反应和吸收行为。我们的发现应有助于进一步研究和开发BRFD,这可能是血管内治疗器械的下一个突破点。
最初报道的BRFD是由PLLA构成的,但最近的设计则采用了铁和镁合金。金属BRFD相较于聚合物构建的支架具有多个优势。它们更为刚性,并且在接受经皮冠状动脉介入治疗的患者中显示出更好的机械性能。此外,镁支架在两项临床研究中表现出优异的安全性和生物相容性。在降解过程中,它们还会获得负电荷,这可能赋予其抗血栓特性。然而,镁支架的快速吸收是一个问题;需要通过增加涂层或调整合金成分来延缓吸收速度。
尽管我们的MgBRFD通过PLLA涂层延长了吸收周期,但其仍短于永久FD闭塞动脉瘤所需的6-12个月。元素分析显示,未覆盖的涂层在2周内完成吸收。即使有PLLA涂层,镁在1个月内几乎完全消失。然而,一旦新生内膜覆盖了支架结构,覆盖的降解产物似乎仍然保持支架结构。因此,元素的损失并不一定意味着支架结构的丧失。BRFD的理想吸收周期是支架结构保持完整的时间内直到动脉瘤颈部被新生内膜覆盖。为了评估该MgBRFD的理想吸收周期,需要在动脉瘤模型中植入器械进行实验。之前一项关于MgBRFD吸收的体外研究报告的结果与我们的结果显著不同。此外,镁支架的体外和体内吸收时间可能大相径庭,这可能是因为在体外回路中复制复杂的体内条件和环境非常困难。动物研究在模拟人类镁吸收行为方面仍然至关重要。
裸MgBRFD和PLLA涂层MgBRFD的新生内膜厚度均大于以往关于PLLA和CoCr FD的研究报告的厚度。然而,它与第一代和第二代FD的临床前研究中报告的厚度(100-200 µm)相似。此外,支架腔狭窄仅为轻度。尽管我们仅在90天内检查了新生内膜的厚度,但我们预计在此时间点之后会减少,因为裸MgBRFD和PLLA涂层MgBRFD组中新生内膜中的增殖和炎症细胞数量持续减少。两种MgBRFD类型的新生内膜覆盖速度较快,在2周时几乎完全覆盖了支架表面,包括血管壁和侧支血管。由于侧支血管位置未附着于血管壁,并且以垂直方向接受持续的血流,因此实现侧支血管的覆盖具有挑战性。在以往的永久FD中,尚未观察到在侧支血管位置有如此显著的新生内膜覆盖。
实际上,PLLA涂层MgBRFD在侧支血管的新生内膜覆盖明显优于我们之前研究中植入的CoCr-FD(见在线补充图5)。如果MgBRFD能够快速实现足够的新生内膜覆盖,动脉瘤的闭塞应会在早期发生且发生率较高。因此,短于估计的6-12个月的吸收周期可能是可接受的。快速的新生内膜覆盖也将允许早期停止抗血小板治疗。即使在血栓形成风险高的侧支位置也能实现优异的新生内膜覆盖,这进一步增强了MgBRFD的优势。需要在动脉瘤动物模型中进一步研究PLLA涂层MgBRFD,包括与永久FD的比较。裸MgBRFD和PLLA涂层MgBRFD迅速实现了厚实的新生内膜覆盖,而未阻塞直径小于500 µm的分支血管,确认了其安全性。在覆盖裸MgBRFD和PLLA涂层MgBRFD的新生内膜中,早期存在大量炎症细胞。一项关于裸金属冠状动脉支架的研究报告显示,巨噬细胞的比例最多为20%,这远低于我们研究中两种MgBRFD的比例。因此,MgBRFD引发的炎症反应可能高于永久FD引起的反应。之前的猪模型研究报告称,可吸收镁冠状动脉支架的炎症反应大于永久支架,这被归因于镁降解产物对巨噬细胞的诱导和激活。由于MgBRFD的细支柱设计,两种MgBRFD的降解/吸收速率较快,这可能导致降解产物积累时,早期诱导更多的炎症细胞。巨噬细胞在新生内膜形成中发挥着关键作用,早期强烈的炎症反应可能解释了MgBRFD为何能够诱导出优异的新生内膜覆盖。随着时间的推移,尽早完成镁的吸收可以减少新生内膜炎症反应;然而,仍需长期数据来确认这一点。

补充图5:腹主动脉侧支(腰动脉)支架支柱的新内膜覆盖情况的扫描电子显微镜结果:A和B:分别显示PLLA涂层MgBRFD植入14天后的低倍和高倍放大下的新内膜覆盖情况。C和D:分别显示CoCr-FD植入6个月后的低倍和高倍放大下的侧支新内膜覆盖情况。E和F:分别显示CoCr-FD植入24个月后的低倍和高倍放大下的侧支新内膜覆盖情况。与CoCr-FD相比,MgBRFD早期观察到优异的新内膜覆盖,甚至在那些难以实现新内膜覆盖的侧支上也表现出色。
局限性
本研究存在几个局限性。首先,我们没有使用兔动脉瘤模型,也没有将永久FD作为对照。然而,我们的器械是样机,主要关注其可行性评估。其次,样本量较小。第三,器械在多个方面需要改进。尽管有PLLA涂层,但吸收时间比预期快,且30%的支架结构在侧支血管处未能保持。可能需要改善合金成分和涂层方法,以进一步延长吸收周期并防止因支架降解而导致的碎片化。此外,器械的不透射线性不足,因此我们正在考虑将其与不透射线性材料结合,这与其他BRFD的做法相似。此外,由于无法在透视下确认器械与血管的紧密贴合,术后常规进行了球囊成形术。预计引入显影丝也将解决这一问题。最后,我们没有评估降解相关的器械碎片化是否会导致栓塞现象。
然而,未观察到大分支或外周血管的闭塞。最后,我们的观察仅限于植入后的90天。长期数据对于确认新生内膜厚度和炎症反应的变化以及器械降解产物的最终命运至关重要。
总结
裸MgBRFD和PLLA涂层MgBRFD在兔血管模型中均表现出优良的生物相容性。PLLA涂层MgBRFD具有更大的临床可行性,因为涂层延缓了生物吸收。因此,未来需要进行验证研究。

来源:TRA of Neuro


