您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-12-24 09:03
DHF是设计历史文件(Design History File)的缩写,主要适用于医疗器械行业。它是根据FDA 21CFR P820.30规定的医疗器械质量体系的一部分,特别是在医疗器械设计开发阶段要求建立的文档集合。
1.什么是DHF(设计历史文件)
DHF文件是指记录医疗器械设计开发过程的所有文档和记录,目的是确保产品的设计符合法规要求和预期用途,并展示设计开发活动的透明性和可追溯性。
1)作用:
证明医疗器械的设计过程符合法规要求。
确保产品满足用户需求和安全性能要求。
提供产品生命周期中设计开发的可追溯性记录。
2)适用法规:
FDA 21CFR P820.30(设计控制)
ISO13485:2016(质量管理体系–医疗器械要求)
2.DHF的组成部分
DHF包含设计开发过程中的所有关键文档,具体可以分为以下几部分:
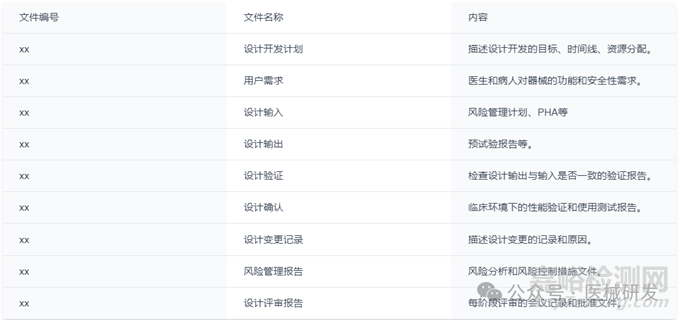
(1)设计开发计划
描述整个设计开发的过程,包括里程碑、时间表、资源分配等。
示例内容:
项目目标与范围
设计团队与职责分配
项目计划与时间线
(2)用户需求(User Needs)
收集、定义并记录用户对产品的具体需求。
示例:患者和医生对手术器械的安全性、尺寸、材料等需求。
(3)设计输入(Design Inputs)
将用户需求转化为具体的技术要求、法规标准等。
示例:
尺寸、重量、材料
功能要求(如电源输入输出)
安全性要求(符合ISO14971风险管理标准)
(4)设计输出(Design Outputs)
设计过程的结果,如测试报告等。
(5)设计验证(Design Verification)
确保设计输出符合设计输入的要求。
示例:
设计输入与输出的比对检查
功能性测试报告
(6)设计确认(Design Validation)
确保最终产品满足用户需求,并在实际使用环境中验证。
示例:
临床模拟测试
临床方案/报告
过程确认方案/报告:实际操作环境下的产品性能测试
(7)设计变更控制(Design Changes)
记录设计变更的原因、验证和确认。
示例:
修改材料规格的原因与评估
变更验证的测试结果与批准记录
(8)设计评审(Design Reviews)
在设计的各个阶段进行评审,确保设计开发符合预期目标。
示例:
设计输入评审会议记录
设计验证阶段的评审报告
(9)风险管理文件
风险评估、控制和验证的完整记录,确保产品的安全性和合规性。
示例:
风险分析报告(如FMEA、FTA、PHA等)
风险控制措施与测试记录
3.DHF文件示例
4.总结
DHF 是医疗器械设计开发过程中的核心文件,不仅是监管合规的必要要求,更是设计控制和质量保证的重要工具。它记录了设计开发过程的每一步,确保设计的透明性和可追溯性,为后续的生产和监管提供依据。
提示:
1)在实际操作中,企业通常使用项目管理软件或文档管理系统来整合DHF文件,确保文档完整性和可追溯性。
2)DHF文件需要定期维护和更新,以适应设计变更或法规变化的要求。

来源:医械研发


