您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-12-29 18:49
摘要
目的 通过考察与腮腺炎病毒原液直接接触的一次性储液袋在冻存情况下的浸出物水平,评估使用一次性储液袋冻存腮腺炎病毒原液的安全性。
方法 将使用一次性储液袋和标准肖特瓶盛装的腮腺炎病毒模拟料液放置于-60 ℃以下冰箱保存,分别于0、6、12、15个月各取出3份样品,以提取物研究中检出的丙酮、叔丁醇和异丙醇作为靶标物质进行浸出物检测及安全剂量分析。
结果 丙酮、叔丁醇和异丙醇在保存周期中均于15个月时出现检出最高峰,浸出物含量分别达到415.02、275.82和936.92 μg/L,且各检测时间节点一次性储液袋浸出物含量均低于允许日接触量或安全评估阈值。
结论 使用一次性储液袋冻存的腮腺炎病毒模拟料液的浸出物含量未超出安全范围,安全性风险小。
腮腺炎病毒属于副黏病毒科,为单股RNA病毒,不耐酸且易被脂溶剂灭活。国内传统的腮腺炎病毒疫苗原液制备工艺采用原代鸡胚细胞,经由细胞培养、病毒接种及收获病毒液合并制得。腮腺炎病毒对热敏感,极不稳定,目前国内主要采用玻璃瓶冻存腮腺炎病毒原液以解决上述问题,但玻璃瓶存在密闭性差、空间占用大、转运不便且融化过程破损严重等弊端。
一次性聚乙烯储液袋是目前生物行业广泛应用于盛装液体的容器,近几年开始被用于疫苗原液冻存,该品可以有效解决玻璃瓶使用过程中的诸多不便。作为直接接触药品的容器,一次性储液袋对药品安全性、有效性及稳定性的影响受到药品行业及药监部门的关注。
腮腺炎病毒原液需要长期低温保存于容器中,浸出物有可能随时间逐渐增加。本研究将在容器容量、表面积和储液量符合实际的前提下,通过分时检测腮腺炎病毒模拟料液的相关浸出物,评估一次性储液袋储存腮腺炎病毒原液时的浸出物含量,验证其安全性和实用性。
1、材料与方法
1.1主要试剂
199培养基购自美国Gibco公司,碳酸氢钠(分析纯级)和人血白蛋白(药品)购自国药集团化学试剂有限公司。
丙酮、叔丁醇、异丙醇标准溶液购自美国Accustandard公司,10 mg/ml水溶液。内标物:氘代乙醇-d6(CAS:1516-08-1)购自比利时Acros Organics公司。
1.2仪器与设备
25 ml肖特试剂瓶和50 ml一次性储液袋、用于保存样品的超低温冰箱(可设置至-60 ℃以下并稳定运行)均购自赛默飞世尔科技(中国)有限公司(赛默飞)。Shimadzu QP2010ultra型气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)仪由清华大学分析中心提供,配备有TR-WAXMS GC色谱柱(购自美国Thermo Scientific公司,30 m×0.25 mm×0.25 μm),进样口250 ℃,载体为高纯氦气,流量为1 ml/min,分流比为10。升温程序:35 ℃保持4 min。离子源200 ℃,接口250 ℃。
1.3样品盛装容器
1.3.1 空白组 采用25 ml肖特试剂瓶盛装。该肖特试剂瓶的耐化学性符合ISO3585和4796标准,目前尚无此类容器存在丙酮、叔丁醇和异丙醇溶出或潜在溶出物的报道。
1.3.2 试验组 采用50 ml一次性储液袋。该规格一次性储液袋与生产使用的20 L大容量储液袋所采用的材质均为聚乙烯CX5-14膜。
1.4样品准备
1.4.1 各容器比表面积对比 由表1可见,50 ml储液袋的比表面积最大,为12.82 cm2/ml,处于最具有挑战性的试验环境中,而实际生产中使用的20 L储液袋的比表面积为0.70 cm2/ml,仅为50 ml储液袋比表面积的约1/18。将50 ml储液袋作为浸出物试验的样品袋,得出的试验结论最具有代表性和权威性,对于判定实际生产的安全性更可靠。
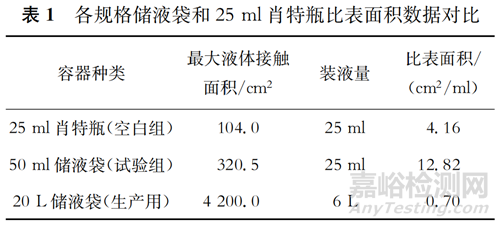
1.4.2 模拟料液配制与装载 模拟料液含注射用水、199培养基、人血白蛋白、碳酸氢钠,为腮腺炎病毒原液的最终培养液体系,与生产用原液配液比一致,除不含腮腺炎病毒外所有成分组成无任何差异;并通过加入碳酸氢钠调节pH至与实际腮腺炎病毒原液一致。空白组于25 ml肖特试剂瓶中装入25 ml模拟料液,试验组于50 ml一次性储液袋中装入25 ml模拟料液。
1.4.3 浸出物样品准备及送检 空白组和试验组均放入-60 ℃以下冰箱冻存,分别于0、6、12和15个月各取出3份送样检测。样品运输方式采用干冰运输,保证运输过程中样品无解冻。检测前将样品容器置于水浴解冻(水温30 ℃以下),待样品完全解冻后,轻柔摇晃使料液完全混匀。委托赛默飞联合北京清华大学分析中心进行丙酮、叔丁醇和异丙醇含量检测,每份样品检测1次。浸出值的计算方式为将试验组检测均值减去空白组检测均值,以去除样本中本来含有的物质的影响,如差值为负数可认为试验组对照于空白组无浸出,相对浸出数值计为0。
1.5浸出物检测及安全剂量分析
1.5.1 浸出物检测 使用GC-MS仪对送检的空白组和试验组样品中的丙酮、叔丁醇和异丙醇进行含量检测,检测中的仪器精度和准确度达到分析痕量挥发性物质的检测要求。
1.5.2 安全剂量分析 根据ICH Q3C(R8)《杂质:残留溶剂的指导原则》中常用有机溶剂分类及残留限度的要求进行残留毒性分析,评估相关浸出物的安全剂量。
2、结果
2.1浸出物试验结果
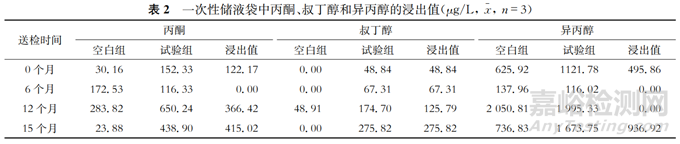
由表2可见,到部分节点后数据呈现负增长,而浸出值的负增长并不一定是一次性储液袋中浸出物含量的减少。测试样品在0—15个月的保存周期中(该测试周期已覆盖腮腺炎病毒原液12个月的保存周期),丙酮、叔丁醇和异丙醇均于15个月时出现检出最高峰,浸出物含量分别达到415.02、275.82和936.92 μg/L,可以判断在整个保存周期中丙酮、叔丁醇和异丙醇的浸出物含量呈现波动增加的趋势,虽然在中间部分检测节点出现了未增长的情况,但在保存至15个月的最终检测节点时,丙酮、叔丁醇和异丙醇的浸出值与0个月的浸出值相比均大幅增长。从整个保存周期和检测周期判断丙酮、叔丁醇和异丙醇3种物质的浸出值是有所上升的(见表2)。
2.2浸出物安全剂量分析
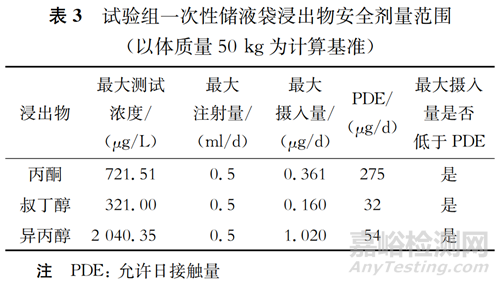
根据ICH Q3C(R8)《杂质:残留溶剂的指导原则》,丙酮和异丙醇均为3类溶剂,叔丁醇为2类溶剂。残留的3类溶剂含量依照原则需低于0.5%,0.5%的溶剂含量相当于5 000 μg/L,而该数值远远高于本试验各时间节点中检测出的3类溶剂的最大测试浓度(非均值)721.51、321.00、2 040.35 μg/L。因叔丁醇为2类溶剂,故在此基础上以更能反映药物安全性的允许日接触量(permitted daily exposure,PDE)来进行评估,并以终产品中样品的每日最大注射量为0.5 ml计算最大摄入量。
本次试验中PDE按照较严格的静脉注射药品的要求进行计算,数据来源于化学物质毒性数据库。由表3可知,试验中检出的3种浸出物成分的最大摄入量均低于相应的PDE。实际使用中,相关疫苗产品是由病毒原液经稀释配制而成,这意味着即使在更严格的情况下,各浸出物的最大摄入量都要远远低于PDE的限值。使用一次性储液袋并不会有安全性隐患。
3、讨论
一次性储液袋与药品应具有良好的相容性,本研究遵循《化学药品注射剂与塑料包装材料相容性研究技术指导原则(试行)》开展部分相容性研究,相关研究均符合国际通用标准。
检测中方法的检测灵敏度为μg/L,定量方法采用选择性离子监测方法定量,定量离子分别为丙酮(43)、叔丁醇(59)、异丙醇(45)、氘代乙醇(33),3种待测物的线性范围为质量分数(2~100)×10-8。采用内标法定量,氘代乙醇为质量分数5×10-7。另外,氘代乙醇和异丙醇的保留时间相近(在质谱图上峰重合),不过定量离子不同且非相互的特征离子,不影响定量。由于试验中使用的GC-MS仪定量限为质量分数2×10-7,为较小的数值,因此相较于数值较大的数据,本次试验中的检出数据的浮动性相对较大。数值级别较小,更加证明了浸出物含量的数量级远未达到可以造成不良影响的程度。
由于丙酮、叔丁醇和异丙醇作为提取研究中确定的研究成分,均存在吸附和蒸发作用的影响,因此检测周期中浸出物检出的数值未必一定会随着保存时间增加而增加,本次试验组的一次性储液袋为加盖密闭容器并在盖子处缠绕绝缘胶带进行密闭保护,在进行检测前不进行任何拆卸外包的动作,检测过程中也进行样品的摇匀,最大程度避免了吸附和蒸发作用对本次试验的容器影响,检测数据可信度高。
本次试验中,丙酮、叔丁醇、异丙醇3种检出成分按产品每日最大注射量0.5 ml进行计算,检测值均低于欧洲药监局推荐的1.5 μg/d的安全性阈值。同时通过USP<88>动物体内试验也确定了溶出物在大剂量注射方面的安全性。
上海生物制品研究所有限责任公司疫苗二室在进行储液袋相容性试验的同期也进行了实际储存原液及原液配制成品的相关性研究,稳定性研究显示使用一次性储液袋冻存腮腺炎病毒原液在规定的有效期内可确保符合质量标准,甚至原液保存至超效期后仍符合腮腺炎病毒原液的滴度标准,与使用原1 L玻璃瓶无明显差异,利用上述超效期原液配制的麻腮风联合减毒活疫苗成品在超保存效期的各项时间节点的检测项目均符合企业标准。即一次性储液袋对于保存腮腺炎病毒原液在安全性、有效性及稳定性方面均有很好的保障,可以替代1 L玻璃瓶作为腮腺炎病毒原液的保存容器进行最多12个月的冻存。
另外,提升单个容器的冻存装量可保证产品质量更加稳定均一,缩短制冻时间可减少病毒滴度的损耗,相较于传统1 L玻璃瓶的手工制冻方式,储液袋的机器制冻方式可减少对终产品质量产生的不利影响,这也成为一次性储液袋替代1 L玻璃瓶作为腮腺炎病毒原液保存容器的一大优势。
引用本文:陈晓望, 杨文震, 周锋, 等. 一次性储液袋冻存腮腺炎病毒原液的浸出物研究 [J]. 国际生物制品学杂志, 2024, 47(5): 281-284.

来源:国际生物制品学杂志