您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-12-30 08:31
ICH E14/S7B Q&A指导原则中提出“双阴性”的概念,即hERG阴性和体内安全药理结果阴性,以降低临床QT间期延长的风险。其中,ICH E14/S7B Q&A也强调采用清醒动物开展非啮齿类动物安全药理研究的重要性,并需要注意研究体系的可靠性和灵敏度。这也就引出了一个话题,即非啮齿类动物心血管遥测研究的最佳实践是什么?本文主要参考GSK、Pfizer、Amgen、AZ、Charles River等团队2023年发表的一篇名为《Best practice considerations for nonclinical in vivo cardiovascular telemetry studies in non-rodent species: Delivering high quality QTc data to support ICH E14/S7B Q&As》的文章。
研究前考虑
种属选择
心血管安全药理研究的种属最好与非临床毒理研究保持一致。因此,种属选择的依据也是类似的,比如与人体的生理学和药理学相关性。如果使用与毒理研究不同种属开展研究,需要说明其合理性。常用的非啮齿类动物种属主要包括犬、非人灵长类和小型猪。
研究设计
优先选择的设计是交叉设计(crossover design),即每个动物都会经历所有治疗,每种治疗方案之间设置一定的清洗期。交叉设计的初衷是因为动物个体间变异比较大,这种设计可以与自身进行对照,解决变异问题。不过,如果药物PK或PD效应维持过久,导致清洗期设置有一定挑战,比如清洗期需要2-3周,交叉设计就不太适用了,可以考虑平行设计(parallel design)。但平行设计就需要设置vehicle对照,且多组平行开展,动物用量相应增加。体内心血管安全药理还有一种称为剂量爬升的设计(ascending dose design),每个动物先接受vehicle,然后低、中、高剂量,中间设置清洗期。相较于交叉设计,剂量爬升设计虽然使用的动物数量是一样的,潜在的风险是将时间效应和可能的治疗作用两个变量混在一起。虽然也有文献回顾性分析发现,QTc间期受day-to-day的时间效应影响很小,是一个引起低变异(low variability)的变量,但通常还是首选拉丁方交叉设计。
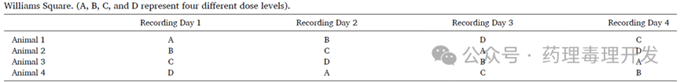
交叉设计使用最多的是Williams square。如下图所示,核心变量有3个,剂量、给药时间点和动物,即采用什么动物分别在什么时间节点以什么剂量给药。常用的设计方案是4只动物+4种给药处理(Vehilce+3剂量水平给药组)。当然,为提高统计效力及降低可能的异常动物剔除风险,也可以考虑6只或8只动物的设计。
统计模型
取决于给药前数据的使用与否或如何使用,体内心血管安全药理统计模型主要有3个,分别是“Single-delta”ANOVA、“Double-delta”ANOVA和ANCOVA,姑且称之为模型一、模型二和模型三吧。模型一和二的主要区别在因变量,前者的因变量是post-dose QTc,后者是ΔQTc(post-dose QTc-pre-dose QTc)。模型三的因变量是post-dose QTc,同时将pre-dose QTc作为协变量。从统计效力看,模型三高于模型二,故模型二不太常用。
那模型一和模型三该怎么选择呢?首先,交叉设计是与动物自身对照,基线协变量并不关键,故模型三较模型一并无太大优势。其次,模型三要求各剂量组之间基线和药后最佳拟合的斜率要一致,否则使用共同斜率会出现偏差。另外,如果出现动物缺失或某些数据缺失,模型三也会出现偏差。此外,如果清洗期设置不够充分,模型三也会出现人为误差。因此,模型一(Single-delta ANOVA)在交叉设计非啮齿类心血管安全药理试验中更被推荐。
效力分析对研究设计也有帮助,包括确定动物数量和组别数量。可以在给定样本量和预计变异度的前提下,基于研究机构内的一组研究(如15-30项)进行效力分析。通过ANOVA或ANCOVA从每项研究中估计变异性,然后合并这些变异性得出一个中位数值。使用变异性值和交叉设计统计模型,可以在固定的样本量下,假设80%的统计效力和0.05的显著性水平,推导出QTc间期(及其他心血管终点)的MDD(指在统计上可以出现显著性的给药组和对照组之间的最小差异)。
关于统计部分,原文还介绍了MDD和LSD(Least-significant difference)的区别和背景研究数据变异度的表征,篇幅所限,不作展开。
剂量选择和目标暴露量要求
非啮齿类动物体内心血管安全药理试验剂量对应的暴露量应该覆盖主要药理学活性,且如有可能,最好超过最高临床稳态Cmax。通常交叉设计选择vehicle+3剂量组,低剂量不产生作用或产生很小的作用(如NOEL剂量),中剂量可以在产生作用的阈值附近(如LOEL剂量),高剂量或者产生明显的心血管作用或者接近最大耐受剂量(maximum tolerated dose, MTD)。根据ICH E14 Q&A,非临床的最大暴露量要覆盖临床高暴露量场景,比如肾或肝损伤场景下的最大Cmax,又如可能的药物-药物相互作用影响下的暴露量增加。所以,严格讲,非临床暴露量是比临床预期有效剂量下的暴露要高的。但是,在开展非临床研究时,临床可能的最高暴露量是未知的。可以结合预期的心血管作用和动物整体耐受性选择剂量,如果高剂量接近MTD,则可能覆盖高临床暴露。
另外一个影响剂量设计的因素是不同种属之间的QTc敏感性。比如人对莫西沙星、多非利特或索他洛尔的QTc作用的敏感性是犬和猴的2-3倍。所以,动物敏感度的降低,对暴露量的要求也就更高。
阳性对照研究
这里的阳性对照并不是指每项研究均需要设置阳性对照组。阳性对照研究的目的更多是采用阳性药物验证体系的灵敏度和可靠性。阳性对照研究应采用与受试药物同样的方法,如相同的种属、硬件、软件和数据分析方法。如果实验室的硬件、动物种系等有变化,阳性对照试验需重新开展。
遥测信号质量测定
动物需要通过手术植入设备,以记录和传输信号,用于测量和分析动脉血压和心电图(ECG)。这些动物通常会在不同的研究中重复使用。所以,不同研究之间需要根据供试品的PD和PK特点,设置充足的洗脱期。新植入的动物,首次研究开始前,需要验证动物的遥测信号波形,以确认与历史背景值是否一致。非试验期间,也需要定期对动物进行信号质量的定性和定量检查。每次研究之前,需要确认ECG信号的质量,确保P-QRS-T波形正常,未出现心律失常。
研究过程中的考量
遥测ECG数据收集
影响ECG信号质量和可靠性的方面有很多。其中,植入遥测装置的手术方法是至关重要的。内置导联通常是单一Ⅱ导联,12导联ECG对于遥测系统尚不可行。多项研究已经证实,将正、负导联分别放置在横膈膜、颈静脉,可以产生相对理想的波形。在II导联上测量QT间期可以清晰地识别Q波的开始和T波的结束,并且U波不太明显,与心室复极结束相对应。
收集遥测数据的动物,应处于相对安静的环境,尽量减少房间进入次数和对动物的干扰。需详细记录环境条件和进出情况,为后续实验结果解释提供依据。每次给药时,建议从给药前至少2小时开始收集数据,直至给药后至少20小时。具体收集时间长短要结合PK和PD调整。另外,减少昼夜节律影响,建议每次给药选择同一时间。连续收集数据可以在更广泛的心率范围内完整表征QT/RR或QT/HR关系,从而增加对这些数据用于计算个体动物QT校正因子的信心。此外,收集ECG波形时,不建议滤波,采样频率至少为500Hz,可以提供大概2毫秒的分辨率。
收集血样测定药物暴露量
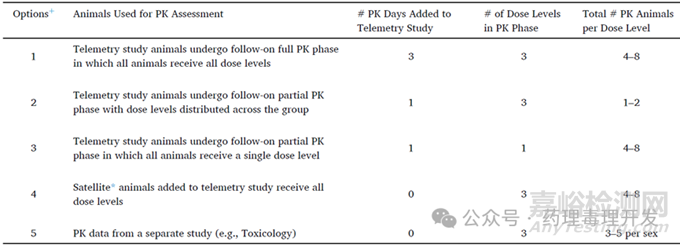
首先体内心血管安全药理伴随PK检测是非常有意义的,可以与体外hERG、临床暴露等数据进行对比和分析,还可以进行浓度-QTc相关性分析。由于动物频繁采血会影响心率,从而干扰ECG信号,故通常不要求收集完整PK曲线数据。下表给出了5种不同的PK采集方案。当然,第1种方案是全PK数据收集。第2种是选择其中1天收集,翻下前文的拉丁方交叉设计表格,任1天应该都有不同剂量的动物给药,所以每个剂量仅能收集1-2只动物PK血。第3种方案仅采集其中1个剂量的血样,优先选择能引起QTc变化的剂量。而且,也不是收集完整PK样本,比如仅收集药前血、Tmax和24h的样本。最后两种方案,一个是设立卫星组,单独用于PK样本收集,一个则是采信供试品在其它试验中获得的PK或TK数据。每种方案,各有利弊。
心率校正QT间期
通过心率(heart rate, HR)校正QT间期是必要的,因为HR降低(RR间期延长)会导致QT间期延长。反之,HR增加则会缩短QT间期。常用的校正公式是Fridericia和Bazett方法,通常用于人的QT间期校正,采用的心率是60bpm(RR 1000毫秒),是一种固定的QT/RR关系。这种方法的缺点是不能充分反映个体差异。另外,动物的静息心率通常更高,所以人体的QT校正方法并不适用。目前,食蟹猴和小型猪尚没有通用的校正方法,犬是有的,犬通常采用Van de Water方法校正。不过,遥测获得的大量数据,可以用于准确测定个体的QT/RR关系。
表征QT/RR(或QT/HR)关系的方法有线性和非线性两种。
线性校正可以采用以下公式。IACF为个体动物校正因子。
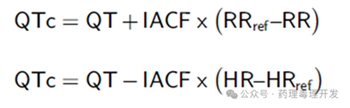
非线性校正方法由Holzgrefe开发,需要先用QT和RR的原始数值,经log对数转化后,得到β。再用β和RRref等,计算具体动物的QTc。
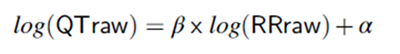
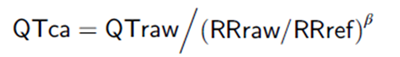
RRref有建议值,犬/小型猪为750毫秒(HR 80 bpm),猴为500毫秒(HR 120 bpm)。
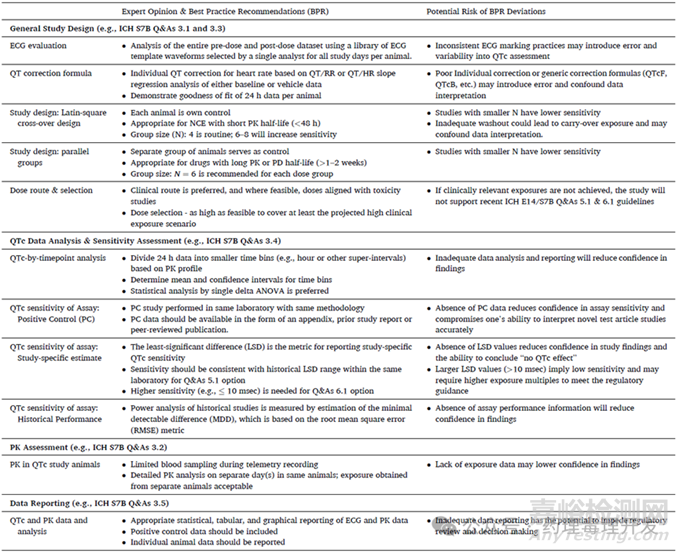
文章最后对体内QTc试验最佳实践的建议总结出一张表格,将工业界的专家建议、可能偏离最佳实践的风险进行了罗列。如下表所示,有兴趣的可以参阅原文。

来源:药理毒理开发


