您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-01-03 11:49
近日,国家药品监督管理局批准了杭州启明医疗器械股份有限公司(简称“启明医疗”)的“经导管主动脉瓣膜系统”(国械注准20243132441)的创新产品注册申请。
VenusA瓣膜系列是启明医疗的盈利支柱,贡献了超过80%的营收,产品在市场上具有领先地位,中国市场终端植入量达 2300 台,环比增长 15%,累计覆盖超全国 580 家医院。截至2024年10月底,VenusA 系列产品的累计植入量已超 20000 台,是中国 TAVR 市场植入量最多的产品。
此次获批的 VenusA-Deluxe 是 VenusA 家族的第四代产品,相比于第三代产品,VenusA-Deluxe 对输送系统进行了进一步的优化升级。第四代经导管主动脉瓣膜系统的获批,不仅丰富了启明医疗的产品线,也标志着公司在结构心TAVR领域的战略布局进一步深化。
前三代TAVR产品
第一代——VenusA-Valve
VenusA-Valve是第一代TAVR装置,用于经导管治疗严重主动脉瓣狭窄(AS),于2017年4月获得NMPA的上市许可,是首款经NMPA批准在中国商业化的TAVR产品。
VenusA-Valve的 8 年期随访结果表明,长期超声数据显示瓣膜峰值流速、瓣膜平均跨瓣压差及左心室射血分数等持续保持良好稳定状态;此外,约80%的受试者主动脉瓣无反流或仅微量反流,充分证实VenusA-Valve瓣膜的长期安全性和有效性。
第二代——VenusA-Plus
VenusA-Plus是VenusA-Valve的升级产品。VenusA-Plus于2020年11月获得NMPA的上市许可,是中国首款获批的可回收TAVR产品。该产品在保持第一代瓣膜强径向支撑力的基础上,增加了可回收、可重新定位的功能,能降低手术难度,显著缩短术者的学习周期。
VenusA-Plus 的 3 年随访结果显示无新增心源性死亡,亚组结果显示VenusA-Plus对二叶瓣和三叶瓣的患者都有良好效果,展现了VenusA-Plus良好的临床安全性、有效性和可操控性。
第三代——VenusA-Pro
VenusA-Pro 是 VenusA-Plus 的升级产品,在保证径向支撑力的同时兼具精进的过弓性能,胶囊头端超弹性材料设计,提升术中操控性;对合缘对齐轴向显影标记,充分保护冠脉。
VenusA-Pro于2022年5月获得NMPA的上市许可,启明医疗也成为国内首家拥有三款TAVR产品的公司,丰富的产品管线为医生和患者提供更优的治疗选择,并有助于稳固市场领先地位。
VenusA-Deluxe瓣膜系统(第四代)
VenusA-Deluxe经导管主动脉瓣膜系统该产品由主动脉瓣膜和输送系统组成,输送系统包括输送导管系统(DCS)和压缩装载系统(CLS)。
主动脉瓣膜由镍钛合金支架和猪心包瓣叶组成。
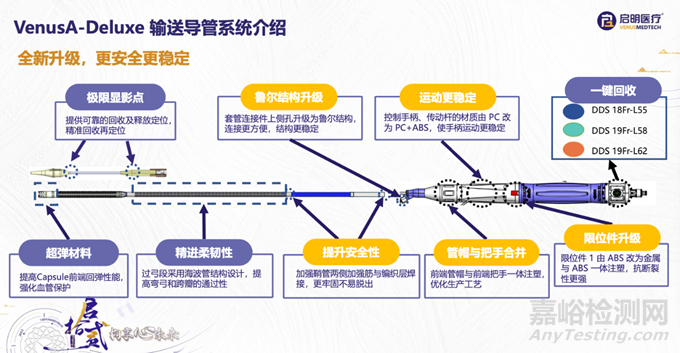
输送导管系统由Tip头、中管组件、胶囊腔、输送鞘管、前把手组件、控制手柄组件和后把手组件组成。
压缩装载系统由装载器、装载管、装载保护管、压缩成型棒和压握器组成。

VenusA-Deluxe对输送系统进行了进一步的优化升级,包括:
优异的有效瓣口面积,提供优异的血流动力学表现;
影像下可视化实时跟踪输送系统张力调整;
Commissural Alignment轴向显影标记,给予冠脉充分保护;
逐级压缩瓣膜,降低瓣膜折叠的发生率;
加强内部焊接结构,释放回收更稳定。
该产品适用于经心脏团队结合评分系统评估后认为患有有症状的、钙化的、重度主动脉瓣狭窄,不适合接受常规外科手术置换瓣膜的患者。适用于满足以下全部条件的患者:
① 年龄应不低于70岁;
② 退行性自体主动脉瓣狭窄病变;
③ 具有主动脉瓣膜狭窄症状,NYHA功能II级或II级以上,主动脉瓣口面积<0.8cm2,平均跨主动脉瓣压差≥40mmHg或主动脉峰值流速≥4.0m/s;
④ 不适合外科手术治疗(预估外科手术导致的30天死亡风险或严重、不可逆转的并发症超过50%);
⑤ 手术入路血管无严重扭曲,输送鞘管能通过;⑥ 主动脉瓣环直径范围在17-29mm,冠状动脉开口下缘距离瓣环大于10mm。
核心产品进展
启明医疗此前已商业化 3 款TAVR产品:VenusA-Valve(2017年4月获批上市)、VenusA-Plus(2020年11月获批上市)和 VenusA-Pro(2022年5月获批上市),1款TPVR产品 VenusP-Valve(2022年4月获批CE、2022年7月获批CFDA);2款手术配件:G Sheath可扩张导管鞘和TAV0球囊扩张导管。

当前,启明医疗最主要的产品为经导管人工肺动脉瓣膜置换系统(TPVR)VenusP-Valve和主动脉瓣膜置换系统(TAVR)VenusA系列。截至2024年上半年,TPVR产品VenusP-Valve已进入英国、意大利、西班牙、丹麦、希腊、法国、德国、波兰、瑞士、加拿大、澳大利亚、印度、俄罗斯、新加坡等59个国家和地区,并在德国、法国等国家进入医保,覆盖135多个海外中心;TAVR产品VenusA系列海外销售已拓展至亚太、拉美等10个国家和地区。
VenusP-Valve在美国获批在即
VenusP-Valve于2023年7月获美国FDA批准IDE申请,可开展关键性临床研究,成为首个在美国获批临床研究的中国产人工心脏瓣膜产品,11月获得美国首家中心伦理批件,12月临床试验获美国联邦医疗保险和联邦医疗补助服务中心( CMS)批准纳入医保,符合CMS医疗保险计划的患者的临床治疗费用可通过医保报销,临床进展不断推进,关键性临床即将启动。预计可于2026年在美国及日本同步获批上市。
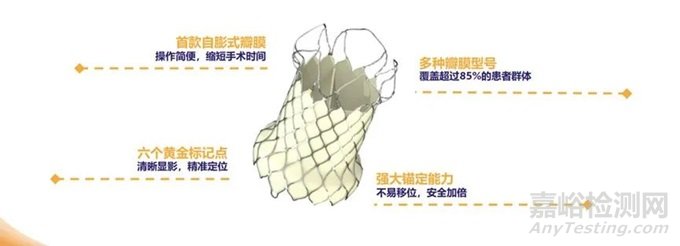
VenusP-Valve经导管主动脉瓣膜
全球首款自膨干瓣Venus-PowerX
Venus-PowerX 已完成早期可行性研究患者入组,所有患者在随访中,即将进入PREVAILS全球关键性临床试验阶段。2023年5月,Venus-PowerX于阿根廷获批上市,10月于智利获批上市。
Venus-PowerX是新一代预装干瓣产品,具有全球首创的自适应主动防瓣周漏Seadapt裙边;运用Venus-Endura膜片,膜片采用先进的抗钙化处理工艺以提高瓣膜耐久性;使用三维力控技术干化瓣膜,无需使用戊二醛保存,在提升安全性的同时,便于临床使用和瓣膜储藏运输;预装载干瓣技术,大幅减少手术准备时间;采用线控技术,在瓣膜100%完全释放后,仍可进行回收。

Venus-PowerX干瓣产品
全球首款球扩干瓣Venus-Vitae
Venus-Vitae已进入SMART-ALIGN全球关键性临床试验阶段,首两例患者在香港成功植入。2022年12月,Venus-Vitae于阿根廷获批上市。2023年10月,Venus-Vitae于智利获批上市。
Venus-Vitae的瓣膜材料与Venus-PowerX相同;输送系统采用独有的线锁专利技术,使得体外装载后的瓣膜在球囊上不移位。线锁技术、调弯功能、球囊同轴旋转功能和轴向微调功能,最大化地赋予术者精准的掌控体验,填补了市场上同类产品无主动式对合缘对齐输送系统的空缺。

Venus-Vitae干瓣产品
二&三尖瓣置换产品Cardiovalve
Cardiovalve针对二尖瓣反流适应症处于早期可行性研究阶段,针对三尖瓣反流适应症处于关键性临床试验TARGETCE阶段,患者入组顺利,目前已在英国、德国、意大利及加拿大等国的20余家医疗中心开展,截止2023年12月底已完成70余例患者入组,进展迅速,有望成为国内首批上市的经股入路三尖瓣置换产品。
Cardiovalve系统是一款可用于治疗二尖瓣反流和三尖瓣反流的经导管介入瓣膜置换系统,其经股静脉的入路方式显著提升了治疗安全性,55mm的大瓣环设计适用约95%的患者群体,独特的短瓣架设计可有效降低左室流出道梗阻风险。

二&三尖瓣置换产品Cardiovalve
公司介绍
启明医疗成立于2009年,致力于结构性心脏病经导管治疗产品的研发和产业化,覆盖主动脉瓣、肺动脉瓣、二尖瓣、三尖瓣等心脏瓣膜疾病,高血压肾动脉去交感神经消融术以及手术配套产品等完整管线。
公司已于2019年12月10日在香港联交所主板上市,股票代码为02500。由于未经授权交易资金,启明医疗自2023年11月起,已停牌超过一年。
2024年上半年,启明医疗实现销售收入2.31亿元人民币,公司通过持续生产成本优化保持毛利率相对稳定为78.8%。报告期内,公司更加注重单台手术的商业化盈利水平,实现商业化利润约3413万元人民币,同比增长85%,商业化利润率由去年同期7%增至15%,商业化盈利能力初步显现。
公司海外销售收入实现3010万元人民币,同比增长34%,海外收入占比进一步上升至13%,为未来更多产品出海打下良好基础。
报告期内,公司通过实施多种举措进一步提高商业化效率,销售费用由去年同期1.58亿元人民币下降至1.31亿元人民币,同比下降17%;研发费用由去年同期2.95亿元人民币下降至1.81亿元人民币,同比下降38.6%。

来源:心未来


