您当前的位置:检测资讯 > 实验管理
嘉峪检测网 2025-01-10 08:21
双荧光素酶基因报告系统(Dual Luciferase Reporter Assay System)是一种常用于评估基因调控元件(如启动子、增强子或microRNA靶点)活性的实验方法。该系统通常涉及两个质粒的共转染,其目的是为了提供更准确和可靠的实验数据。这两个质粒及其作用如下:
1. 报告质粒(Reporter Vector):
这个质粒包含了待研究的调控序列上游的萤火虫荧光素酶(Firefly luciferase, Fluc)基因。这个调控序列可以是启动子、增强子或其他顺式作用元件。
当细胞被转染后,如果调控序列活跃,则会驱动萤火虫荧光素酶基因的表达。通过测量萤火虫荧光素酶的活性,我们可以间接了解目标调控序列的功能或活性水平。
2. 内参质粒(Control Vector):
内参质粒通常携带海肾荧光素酶(Renilla luciferase, Rluc)基因,作为内部对照使用。它不受实验处理的影响,并且在实验设计中保持恒定表达。
海肾荧光素酶的作用是标准化实验结果,以校正由于细胞数量差异、转染效率变化或其它实验条件波动带来的影响。通过比较两种荧光素酶的相对活性,可以获得更加可靠的数据。
通过同时转染这两个质粒并检测两种不同类型的荧光素酶活性,研究人员可以得到关于特定调控序列功能的信息,同时确保实验结果的稳定性和可重复性。这种方法广泛应用于生物学研究中,尤其是在探索基因表达调控机制时。
一、基本实验流程图
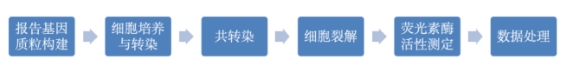
二、实验步骤
1、报告基因质粒构建:将目的片段插入到荧光素酶表达的报告基因载体上,如pGL3-basic、Psicheck-2等常见载体。通常是把目的基因结合区域或者基因转录的调控元件克隆在萤火虫荧光素酶基因的上游,构建成荧光素酶报告质粒。
2、细胞培养与转染:选择合适的细胞系,如常用的工具细胞HEK293T等,用含10%胎牛血清的DMEM培养基,在37°C、5%CO₂的培养箱中培养,待细胞密度达到70%~80%时进行转染。
3、共转染:将构建好的报告基因质粒和带有海肾荧光素酶基因的内参质粒,按照一定比例使用脂质体转染法等方法共同转染入细胞。
以miRNA靶基因验证为例 :

4、细胞裂解:转染后48h左右,去除培养基,用PBS清洗细胞1~2次,加入细胞裂解液,室温裂解细胞15~30min左右,以保证细胞充分裂解。
5、荧光素酶活性测定:初次使用时,需配制Firefly Luciferase(萤火虫荧光素酶)的底物,将其溶解在LARII buffer(Buffer 1)中,并分装-80℃避光保存;同时现用现配Stop & Glo(Buffer 2),即Renilla Luciferase(海参荧光素酶)的底物,用于终止LARII buffer(Buffer 1)的反应。
6、检测读数:向一定量(如40μl)的LARII中加入适量(如10μl)细胞裂解液,吹打混匀后,立即用酶标仪检测读数,即为Firefly luciferase的值;接着加入等量的Stop & Glo,再次读数,即为Renilla Luciferase的值。
7、数据处理与分析:计算每管的Firefly Luciferase/Renilla Luciferase的比值,再以control组的比值为单位,得到不同处理组的相对luciferase活性,以此来反映该处理组基因转录的调控活性。通常采用t检验或方差分析等统计方法进行数据分析,比较各样品间相对荧光值的差异,判断目的基因对荧光素酶活性的影响是否显著。
8、结果分析和解读:
(1)相对荧光素酶活性(Relative Luciferase Activity,RLA)的计算方法,即RLA=萤火虫荧光素酶活性值(Fluc值)/海肾荧光素酶活性值(Rluc值)。以miRNA靶基因验证为例 :计算步骤步骤如下:
1.先计算出每孔的Firefly Luciferase/ Renilla Luciferase的比值(F/R);
2.求出miRNA-Ctrl三个重复孔的平均值(average1)
3.再以miRNA-Ctrl组的average1为标准1进行标准化,即用miRNA mimic组的F/R三个重复值分别除以相对应组别average1得到三个比值
4.3.中求出的比值的平均值作为average2,并分别用average1和average2的值作柱状图
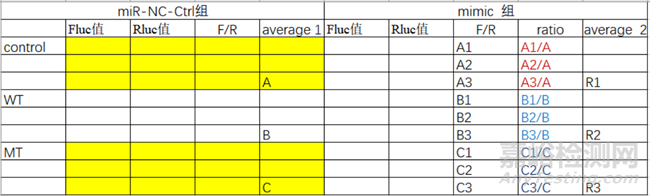
表1 归一化数据处理
(2)以对照组为参照分析相对活性变化
1)双荧光素酶活性升高:若实验组的RLA值显著高于对照组,例如对照组RLA为1,实验组RLA为3,通常提示所研究的调控元件对报告基因(萤火虫荧光素酶)的转录具有激活作用,即可能促进了目标基因的表达启动或增强了表达水平。
2)双荧光素酶活性降低:当实验组的RLA值明显低于对照组时,比如对照组RLA为1,实验组RLA为0.5,则表明该调控元件可能抑制了报告基因的转录,使目标基因表达量相对减少。
3)无显著差异:若实验组与对照组的RLA值相近,且经统计学分析不存在显著差异,说明在所设定的实验条件下,该调控元件对目标基因转录可能没有明显的调控作用。
三、经验总结
1、试剂准备与保存:萤火虫荧光素酶底物LARII需按需分装,-80℃避光保存,避免反复冻融;海肾荧光素酶底物Stop&Glo需现配现用。配好的LARII在-20℃可稳定一个月,在-70℃可稳定一年。
2、细胞转染:注意转染试剂的质量和使用说明,不同细胞系对转染试剂的敏感性可能不同,可进行预实验优化转染条件,如转染试剂的用量、细胞密度、转染时间等。
3、设立阳性和阴性对照,以确保转染的成功和实验结果的可靠性。例如,可设置转染空载体的阴性对照和已知有相互作用的阳性对照组合。
4、实验操作过程:整个实验过程要注意避光,尤其是在试剂配制、细胞裂解后以及荧光检测过程中,防止荧光素酶底物见光分解影响检测结果。
5、实验操作尽量在短时间内完成,一般建议在30min内,以减少细胞裂解产物等在室温下放置时间过长可能导致的活性变化。
6、样品和测定试剂混合后到测定前的时间应尽量控制在相同时间内,通常1~2s,以保证检测结果的准确性和可比性。
7、结果分析与问题排查:如果测量的荧光值较低,首先排除转染效率问题,可通过在12孔板多铺一孔细胞转染荧光质粒,观察转染的荧光效率;若排除转染问题后荧光读值仍然较低,可以尝试增加转染质粒量。
8、若测量的荧光值过高,则可减少转染质粒量,或者适当稀释细胞裂解离心后的上清液。
9、若背景过高可能影响结果的准确性,需检查试剂是否被污染、细胞是否有自发荧光等问题,并采取相应的解决措施。

来源:实验老司机


