您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-01-13 08:43
溶出曲线即在药物溶出实验中,药物溶出量与时间的关系曲线。溶出曲线的检测是模拟药品在人体胃肠道环境中的溶解吸收而设计,以此来替代繁琐、难以随时开展且价格昂贵的人体生物利用度或等效性实验。有区分力的溶出曲线如同显微镜,能反映出宏观相似的两种制剂间的微观不同,是制剂内在品质呈现于外在的一种映射和载体,为制剂处方筛选、预测BE等效、药品一致性评价等提供了一种简单易行、成本低廉且具有一定可靠性的途径。因此,在大多数口服固体制剂产品的开发过程中,若能寻找出有区分力的溶出曲线将使研究事半功倍。
1.漏槽条件
漏槽条件是指在37℃条件下,药物所处释放介质的浓度远小于其饱和浓度,一般释放介质的体积须为药物饱和溶液所需介质体积的3~5倍。该条件的设定,亦是为了模拟药物在人体的吸收分布:药物在人体吸收后会迅速分布到体液,血液中的药物浓度相较于吸收部位浓度要低得多,因此血液相对于胃肠道就会形成漏槽效应。如图1所示,药物溶解后在杯内逐步扩散,若外围浓度迅速达到饱和势必会影响药物的进一步释放,也就无法模拟药物在体内的吸收过程,此时漏槽条件就起到了体外溶出对体内吸收的修正作用。那么有区分力的溶出曲线是否都需要满足漏槽条件呢?首先,漏槽条件指的是API溶解特性方面的参数,属于方法学的范畴,而区分力则是指溶出方法的参数,是为处方工艺开发而建立的溶出曲线的一个特征。从制剂角度来看,溶出度和溶出本质上并没有直接的线性关系。在用于质控的溶出实验中,一般期望制剂中90%以上的药物能够被释放出来,因此,溶出度检测通常都会满足漏槽条件,而溶出曲线的设置主要用于对比制剂之间的接近或偏离程度,和漏槽并没有必然的联系。

图1
2.公开的溶出方法
诚如谢沐风老师所言,药品行业是高科技、高利润、高附加值的产业,原研厂家出于自身利益考虑,将最具区分力的内控方法秘而不宣、把较为宽松的质量标准公之于众的做法是无可非议的,若是把这些标准奉为圭臬,不免会在仿制药开发和品质评价中误入歧途。那么是否USP/FDA所推荐的方法一定不能采用呢?也不尽然。对于某些品种,其公布的相关方法是极具区分力的,且亦有相关资料指出,USP/FDA推荐的溶出方法是经过临床模拟和生物等效性建立了相关性的。因此作为仿制药产品开发者,应客观看待公开的溶出方法,并开展相关实验验证其对处方工艺筛选是否起到正向作用,而非一味的遵循或摈弃。更重要的是应从原研制剂入手来深度剖析解读,获取参比制剂的关键特性,再以此展开后续研究。
3.溶出方法的建立
3.1药品的相关性质
在开发溶出方法之前,研究者须对药品化合物的相关性质进行一定的了解。如其BCS分类、药代动力学特性、API的Pka值、lgP值、API在不同pH条件下的溶出度差异及稳定性、API是否存在多晶型及不同晶型间的溶出度差异、溶出介质的离子强度对API溶解度是否有影响等等,这些信息对后续溶出介质的筛选具有指导性意义。
3.2溶出介质的选择
如图2所示,药物在人体内的“旅行”会先后通过胃、十二指肠、空肠、回肠、结肠等器官,并在小肠(包括十二指肠、空肠、回肠)中停留时间最长。另外,小肠的比表面积最大、小肠膜也比胃中的膜更具渗透性,因此绝大多数药品的吸收都在小肠,而非胃中。由于胃肠道环境过于复杂,常规的溶出试验条件无需与胃肠环境完全一致,但溶出介质的选择应考虑药物的理化性质,并结合胃肠道环境的pH以及口服给药后可能的暴露条件,如此才能最大程度上从药品体内行为角度出发,更好地理解体外溶出数据。综上,溶出介质一般采用pH值1.2~6.8(37±0.5℃)的水性介质,特殊情况下可采用更高pH介质,但一般不应超过8.0,且避免添加有机溶剂。对于硬胶囊、软胶囊和明胶包衣片剂,可在溶出介质中加入一定量的酶,来抵消明胶交联作用对药物溶出的影响。对于不溶于水或难溶于水的药物,可考虑在溶出介质中加入适当的表面活性剂,但需充分论证加入的必要性和加入量(推荐浓度0.01%-1.0%)的合理性。

图2
3.3装置与试验条件
固体制剂常用的溶出装置为篮法、桨法、往复桶法、流池法。其中篮法和桨法是普通制剂常用的试验方法,其操作简单,设备成本相对较低,耐用并能实现标准化,适用于口服药物和外用药物等领域,缺点是不能很好地模拟人体体内环境、精度较低。通常只有篮桨法的试验结果不尽人意时才会考虑后两种。往复桶法和流池法能更好地模拟人体体内环境,数据准确性更高、适用于更多类型的剂型,但设备成本相对较高。我们应当知晓,每种设备都有其自身局限性,不存在某种仪器设备能解决所有问题,需对不同情况进行合理选择。
例如桨篮法,为了使溶出方法具有更高的区分力,应尽量保持温和的搅拌条件。对于口服普通固体制剂来说,篮法和桨法设置的转速范围分别为50~100rpm和50~75rpm。BE试验原则上选取的一般都是健康成年志愿者,因此设置更高或者更低的转速均无法模拟药物在成年人胃肠道中的状态(主要用于老年人群的药物除外)。同时,若转速太慢会产生堆积现象造成虚假溶出,转速太快又将不能区分制剂间的差异。常用转速有50、75、或100rpm,但并非仅有这几个数值可供选择,研究者可根据具体品种及不同方法来设置范围内的其他转速。
4.过度区分
顾名思义,过度区分即溶出方法过于苛刻、区分力过高,将某些微小误差、人为因素等极度放大,使数据所呈现出的变异性过高。其中一个比较典型的现象是,不同批次间的参比制剂在该检测方法下亦显示出不相似的结果(在固定处方工艺及相同设备下所生产出的参比制剂,其批次间的内在质量差距一般不会相差太大)。因此溶出方法的开发需要有一个度,既不能过度区分又不能无区分力。
5.示例
经查,某药品相关信息如表1所示:
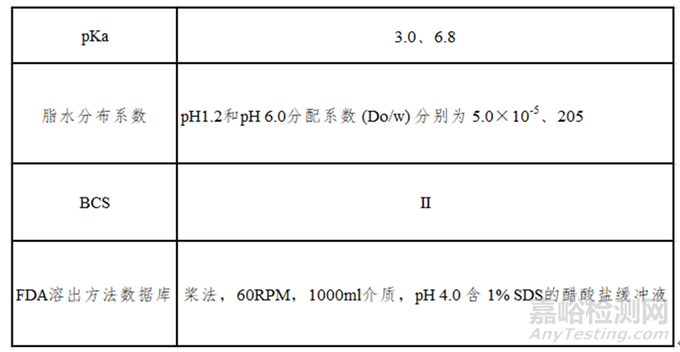
表1
经检测,该API的溶解度随着pH升高不断增大(如图2所示),为pH依赖性药物。其在偏酸性介质中几乎不溶解,当pH值大于5.0后,溶解度显著增大。分别使用不同粒径API及不同工艺参数所制样品按照FDA溶出方法进行检测,结果均显示为快速溶出,因此该方法无法很好地指导后续处方工艺的筛选,需开发新的溶出方法。
该药品属BCSⅡ类,具有低溶高渗的性质,构建体内外相关性的可能性较高。考虑到药物在pKa附近介质中溶解度差异较大,微小的pH改变就有可能加大溶出度的测定误差,故需规避pKa点处的介质。结合其pH溶解度曲线数据,初步选择pH6.0磷酸盐介质开展研究并加以验证。由图3可知在桨法50及75rpm时,虽有一定的区分力,但90min溶出度均小于85%,故尝试另外添加表面活性剂(如图4所示),根据实验数据最终选择桨法50rpm,900ml,pH6.0磷酸盐缓冲液+0.1%SDS的溶出方法来指导处方工艺的筛选。最终批样品与参比制剂溶出数据对比如图5所示。

图2

图3
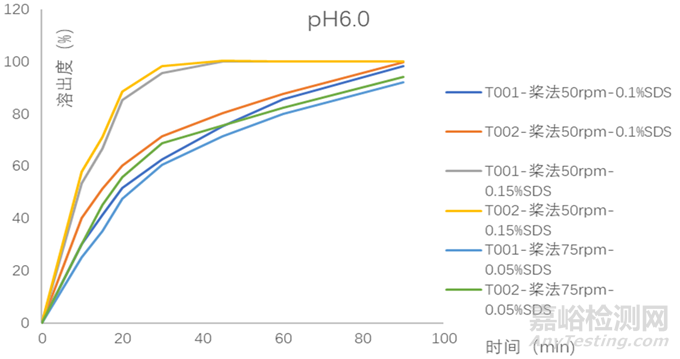
图4
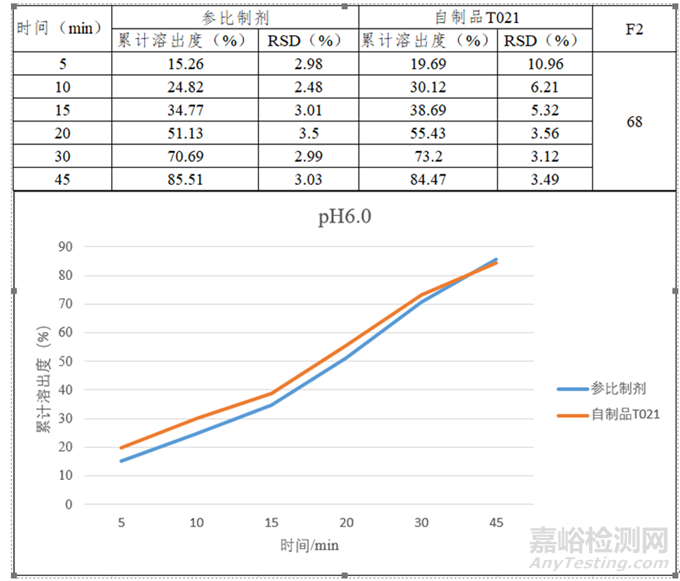
图5
查询参比制剂相关资料得知,其为低变异短半衰期产品。故预BE试验采用两制剂、单次给药、两序列、两周期、餐后8例的设计方案。如图6、图7所示:

图6
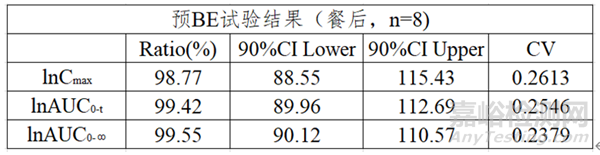
图7
根据预BE结果推测自制品有较大概率能通过正式BE,进而设计正式BE方案为两制剂、单次给药、两序列、两周期、空腹及餐后各20例。数据结果(图8)显示自制品与参比制剂具有生物等效性。

图8
6.总结
有人认为“有区分力的溶出曲线”本身就是个伪命题:首先,无论体外溶出数据做的多么完美, BE亦有不通过的可能,更有些品种即使体外溶出实验相似因子小于50也能顺利通过BE;再者,“区分力”到底区分的是什么?在人体实验数据出来之前,那些被区分的特性参数是否真的有意义呢……不可否认,药物的口服吸收是个复杂的过程,很难仅凭体外的一条或几条曲线就能模拟出来,我们只有通过相关手段方法使仿制药和原研药做到最大程度的相似,才能更大概率地通过BE,而有区分力的溶出曲线正是一个可及性较高且相对有效的工具,能在一定程度上指导仿制药的质量指标无限趋近于原研。它代表的不仅仅只是一条曲线,其背后包含更多的是研发者对品种各方面性质及信息的了解和全面考虑。或许目前没有哪种方法能彻底终结“溶出”与“BE”之间的反复拉扯,但至少我们前进在正确的方向上。
参考文献:
1. 普通口服固体制剂溶出度试验技术指导原则
2. 普通口服固体制剂溶出曲线测定与比较指导原则
3.具有区分力的溶出曲线
4. 怎么提高BE通过率

来源:药事纵横


