您当前的位置:检测资讯 > 监管召回
嘉峪检测网 2025-01-17 08:12
本文从两个维度对FDA 483缺陷项进行统计梳理。一是2013-2024财年FDA 483各类别缺陷项出现频次和比例;二是对FDA在2024财年(2023年10月1日至2024年9月30日)发布的483中所涉及的所有缺陷项按照类别和出现频次进行了排序,从而帮助业界更清楚地了解FDA检查的最新关注点和GMP检查中最常出现的缺陷项,进而有针对性地进行自检和迎检工作,提高合规水平。
表1从药品、生物制品、医疗器械三个维度,对比了2023财年和2024财年有483缺陷的检查次数,可以看到,相比于2023财年,2024财年药品和生物制品的483缺陷增多了,而医疗器械的483缺陷减少了。
表1. 2023和2024财年有483缺陷的检查次数对比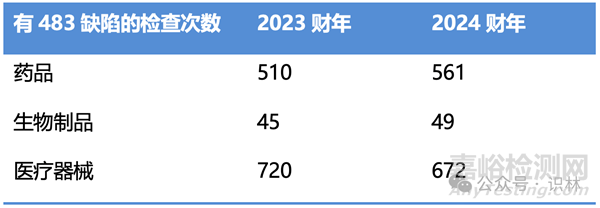
各类别缺陷项历年出现频次和比例统计
汇总了2013-2024财年FDA 483 年度审计缺陷列表(见表2)。
表2. 各类别缺陷项在历年483中出现频次统计表
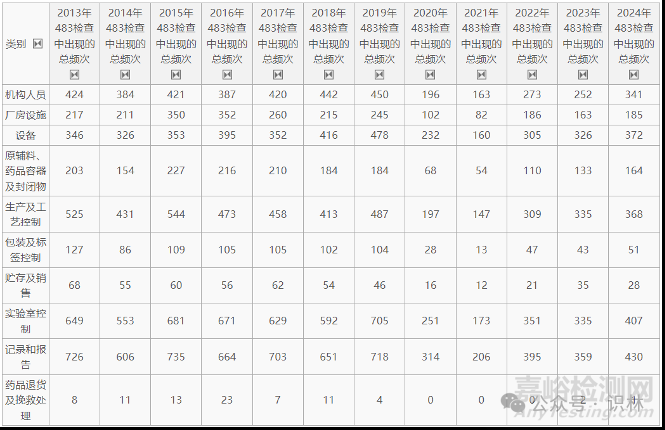
由于新冠疫情导致FDA近几年来检查数量明显减少,因此下表统计了各类别缺陷项在所有缺陷项中所占的比例,这样可以剔除掉检查数量的影响,客观反应各类别缺陷项在历年中的比例变化,即FDA近年来检查关注点的变化(见表3)。
表3. 各类别缺陷项在历年483中所占比例统计表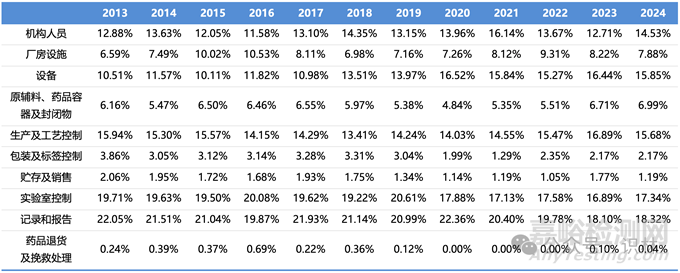
从表3中的统计结果来看,机构人员(质量部门职责)、实验室控制、记录和报告(数据可靠性)这几类缺陷项频率呈现上升势头,也是我国药企近年来检查缺陷的重要来源。
2024财年各类别高频缺陷项
表4. 2024财年出现频率最高的10类483缺陷项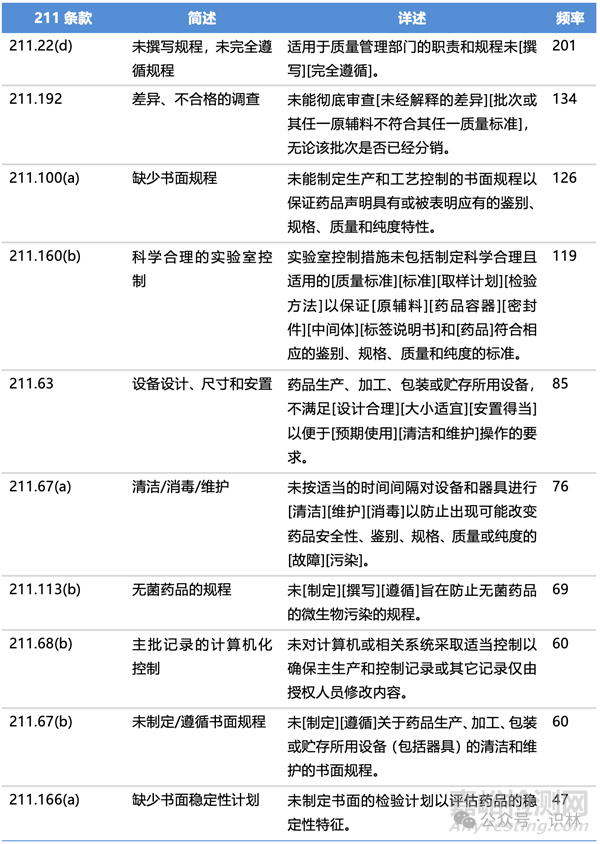
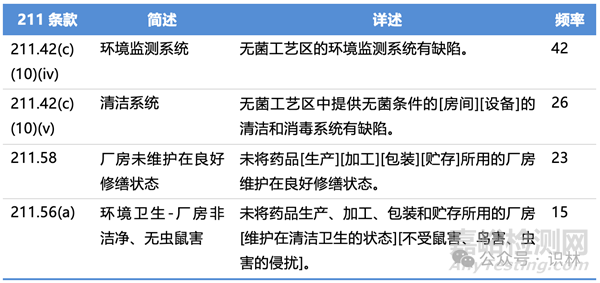
2024财年与211有关的缺陷项分类、简述、详述、频率以及具体条款,见下列各表。(注:下列各表中仅列举各类别中出现频率较高的缺陷项类别,并非所有483缺陷项)
机构人员

厂房与设施
设备

原辅料、药品容器及封闭物的控制

生产及工艺控制

包装及标签控制

贮存及销售

实验室控制

记录和报告


来源:识林


