您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-02-18 20:29
摘 要: 建立了快速溶剂萃取-气相色谱质谱联用法测定土壤中6种菊酯类农药和八氯二丙醚的方法。以正己烷和丙酮(体积比为1∶1)混合溶剂作为萃取溶剂,在80 ℃,100 MPa下循环萃取2次,萃取液经AN60C045型石墨化炭黑固相萃取小柱净化。采用气相色谱质谱联用法检测,载气为高纯氦气,进样口温度为240 ℃,柱流量为1.0 mL/min,进样体积为1.0 μL,离子源温度为230 ℃,以内标法定量。6种菊酯类和八氯二丙醚的质量浓度均在200~8 000 μg/L范围内与其色谱峰面积线性关系良好,相关系数均大于0.995,检出限为0.02~0.11 mg/kg。样品平均回收率为78.08%~128.08%,测定结果的相对标准偏差为1.37%~9.08%(n=6)。该方法简单快捷、检出限低、准确度高,可用于土壤中菊酯类农药测定,为土壤管控提供参考。
关键词: 快速溶剂萃取; 气相色谱质谱联用法; 土壤; 菊酯类农药; 八氯二丙醚
拟除虫菊酯类农药(菊酯类农药)是一类人工合成的仿生杀虫剂,广泛应用于农作物灭虫、家庭卫生和园艺花卉。在这类农药具有杀虫广泛,效果显著、低残留及无蓄积等优点[1]。然而,随着其广泛和长期使用[2],部分农药通过废水、废气、废渣等途径排放到环境中,部分则流入土壤和沉积物中[3-4],造成了严重的环境污染。针对这一污染问题,现有治理措施尚未跟上需求,致使生存环境中存在着大量危害人类健康的致病因素。此外,菊酯类农药对神经系统也具有毒害作用[5],干扰内分泌激素合成、释放及与受体的结合,影响内分泌系统的正常功能,可能导致生殖功能障碍以及致畸、致癌等风险[6],严重危害人类生产生活,因此测定土壤和沉积物中菊酯类农药的含量迫在眉睫。菊酯类农药在环境介质中的存在直接影响农产品的品质,目前我国已制定了针对食品和农产品中菊酯类残留的全面标准,但是对土壤中菊酯类限值的规定较少。目前液相色谱法灵敏度高,但存在检出限较高、定性能力较差的问题,气相色谱法准确高效,但存在稳定性差、灵敏度低的缺点,由于土壤的基质比较复杂,前处理技术并不能完全除去杂质,而通过气相色谱的保留时间进行定性常受到干扰,造成假阳性现象。气相色谱-质谱法利用其质谱特有的定性能力,可以很好的避免样品检测的假阳性,提高检测的准确度,因此利用气相色谱串联质谱法测定土壤中菊酯类和八氯二丙醚增强了结果的准确性。而八氯二丙醚作为拟除虫菊酯类农药的优良增效剂,在农药中被广泛使用,八氯二丙醚在环境中滞留时间长,属于类持久性有机污染物,可能具有致畸、致癌、致突变作用[7],因此将八氯二丙醚作为目标化合物进行检测分析。
由于菊酯类农药痕量存在且有些基体较复杂,传统的前处理方法如索氏萃取[8]法、超声波提取法[9]存在试剂消耗大、处理过程复杂、耗时长且对实验人员健康有害等缺点。快速溶剂萃取法[10-11]是一种在提高温度和压力的条件下用有机溶剂萃取的自动化方法,它大大减少了溶剂的用量,萃取速度快且回收率高。目前用于测定菊酯类农药的分析方法主要包括气相色谱(GC)法[12-16],高效液相色谱(HPLC)法[17-18],高效液相色谱-串联质谱法[19-21],气相色谱质谱联用(GC-MS)法[22-25]等。目前,国内外针对八氯二丙醚的研究主要采用气相色谱法。然而,该方法只能通过保留时间进行定性分析,且结果易受样品基质干扰,可能产生假阳性结果。相比之下,气相色谱-质谱联用法通过质谱的选择离子监测进行定性分析,显著提高了分析结果的准确性。
笔者建立了气相色谱串联质谱法检测土壤中菊酯类和八氯二丙醚,该方法简单高效、灵敏度高、专属性强,可用于土壤中菊酯类和八氯二丙醚的测定,为我国环境相关管理部门提供有力的技术支撑。
1. 实验部分
1.1 仪器与试剂
气相色谱-质谱联用仪:Agilent 8890/5977B型,美国安捷伦科技有限公司。
分析天平:HZT-A300型,感量为0.1 mg,福州华志科学仪器有限公司。
快速溶剂萃取仪:E-916型,瑞士步琦有限公司。
平行浓缩仪:Syncore型,瑞士步琦有限公司。
全自动氮吹浓缩仪:XT-NS1型,上海新拓分析仪器科技有限公司。
正己烷、丙酮、甲苯、乙腈:均为色谱纯,赛默飞世尔科技(中国)有限公司。
无水硫酸钠:分析纯,国药集团化学试剂有限公司。
石墨化炭黑固相萃取柱:AN60C045型,500 mg(6 mL),北京纳鸥科技有限公司。
氨丙基键合固相萃取柱:54059-U型,500 mg(6 mL),日照科谱诺新材料有限公司。
高纯氦气:纯度(体积分数)不小于99.999 %,霸州市安兴气体有限公司。
溴氰菊酯:质量浓度为100 mg/L,批号为21805147-01,美国Accu Standard公司。
反式烯丙菊酯、胺菊酯、联苯菊酯、氯氰菊酯、氰戊菊酯、溴氰菊酯混合标准溶液:各组分质量浓度均为100 mg/L,批号为2021-001,中国计量科学院。
八氯二丙醚标准溶液:质量浓度为100 mg/L,批号为SB05-051-2008,坛默质检标准物质中心。
菲-d10、䓛-d12、芘-d12混合内标溶液:质量浓度为2.0 mg/mL,批号为219011087,美国Accu Standard公司。
四氯间二甲苯标准溶液:质量浓度为1 000 mg/L,批号为218071086,美国Accu Standard公司。
土壤样品为农用地土壤。
硅藻土:SBEQ-CA3904-1 kg,上海安谱实验科技股份有限公司。
实验用水为去离子水。
1.2 仪器工作条件
1.2.1 加速溶剂萃取仪
快速溶剂萃取仪压力:10 MPa;萃取温度:80 ℃;加热时间:5 min;静态萃取时间:5 min,循环萃取次数:2 次。
1.2.2 气相色谱仪
色谱柱:DB-5ms Ultra Inert型柱[30 m×0.25 mm,0.25 μm,安捷伦科技(中国)有限公司];进样口温度:240 ℃;进样方式:不分流进样;载气:高纯氦气,体积分数不小于99.999 %;柱流量:1.0 mL/min;进样体积:1.0 μL;程序升温:80 ℃保持1 min,以30 ℃/min升温至200 ℃,再以10 ℃/min升温至280 ℃,保持8 min。
1.2.3 质谱仪
离子源:电子轰击离子源;离子源温度:230 ℃;接口温度:270 ℃;离子化能量:70 eV;扫描方式:选择离子扫描方式(SIM);溶剂延迟时间:6 min;6种菊酯类农药和八氯二丙醚质谱参数见表1。
表1 6种菊酯类农药和八氯二丙醚质谱参数
Tab. 1 Mass spectrum parameters of 6 pyrethroids and octachlorodipropyl ether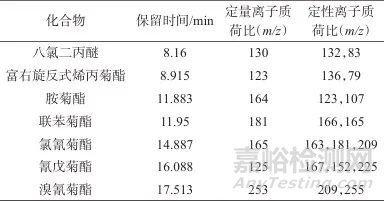
1.3 溶液配制
内标溶液:量取各组分质量浓度均为2 mg/mL菲-d10、䓛-d12、芘-d12混合内标溶液50 µL于100 mL容量瓶中,用正己烷稀释,摇匀,配制质量浓度为1 µg/mL作为内标溶液。
系列混合标准工作溶液:精密量取混合标准溶液储备液,用正己烷逐级稀释,加入内标溶液,将其稀释成质量浓度分别为100、200、500、1 000、2 000、5 000、8 000 µg/L,含菲-d10、䓛-d12、芘-d12质量浓度均分别为1 000 µg/L的系列混合标准工作溶液。
1.4 实验步骤
称取土壤样品10.0 g (精确至0.01 g),将样品加入适量的硅藻土并装入40 mL的萃取池中,采用正己烷:丙酮(体积比为1∶1)溶剂进行快速溶剂萃取。将萃取液用无水硫酸钠干燥40 min后,将提取液用平行浓缩仪浓缩约至1.0 mL,利用固相萃取小柱对样品净化,在石墨化炭黑固相萃取柱中加入0.5 g无水碳酸钠,串接氨丙基键合固相萃取柱。使用前用4 mL甲苯-乙腈(体积比为3∶1)缓和溶剂预淋洗串联柱,然后将待净化样品转移到净化柱内,用25 mL乙腈-甲苯混合液淋洗,收集液用氮吹浓缩至1 mL一下,用正己烷定容至1.0 mL,加入内标待测。
2. 结果与讨论
2.1 色谱柱优化
考察不同型号的色谱柱[DB-1型色谱柱(30 m×0.25 mm,0.25 μm)、DB-5型色谱柱(30 m×0.25 mm,0.25 μm)对目标化合物的分离效果,按1.2 色谱条件设置仪器参数,待仪器稳定后进样分析,结果表明,DB-5型色谱柱的色谱峰对称性更好,响应面积大,6 种菊酯类和八氯二丙醚分离度良好,因此选择DB-5 毛细管色谱柱。
2.2 质谱条件优化
菊酯类化合物和八氯二丙醚各组分的沸点差异较大,在进行质谱分析时,进样口温度会影响峰面积,如果温度过低,目标物不易被汽化。考察了进样口温度分别为240、250、270 ℃时色谱的分离效果,结果表明,3种进样口温度的色谱峰分离效果均良好,为了避免温度过高化合物在汽化过程中发生分解,因为选择进样口温度为240 ℃。
2.3 萃取试剂优化
对样品的萃取试剂进行了优化,分别选择正己烷-丙酮(体积比为1∶1)、二氯甲烷-丙酮以及正己烷-二氯甲烷混合试剂作为萃取剂对6种菊酯类化合物和八氯二丙醚进行萃取试剂的考察,结果表明,三种混合试剂的回收率分别为95.8%~118.5%、88.2%~125.3%、88.6%~120.1%。因为拟除虫菊酯类农药易溶于极性较大的丙酮,而正己烷毒性较低,低极性和高极性的溶剂以适当的比例混合往往比单一溶剂的萃取效率高,因此选择正己烷-丙酮(体积比为1∶1)混合试剂作为快速溶剂萃取试剂。
2.4 温度优化
平行称取5份10 g空白土壤样品,加入菊酯类和八氯二丙醚混合标准溶液和四氯间二甲苯替代物后,考察快速溶剂萃取温度分别为80和100 ℃时的萃取效率,两种萃取温度下6种菊酯类化合物和八氯二丙醚的回收率如图1所示,从图1中可以看出,当温度为80 ℃时,各个目标回收率均高于100 ℃时的回收率,为了节省能源,同时为避免温度过高导致化合物分解,快速溶剂萃取温度选定为80 ℃。
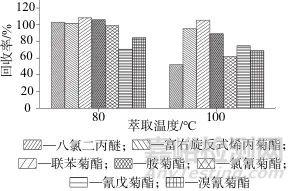
图1 两种萃取温度下6种菊酯类化合物和八氯二丙醚的回收率
Fig. 1 Recovery rates of 6 pyrethroids and octachlorodipropyl ether at two extraction temperatures
2.5 快速溶剂萃取循环次数选择
利用快速溶剂萃取对6种菊酯类化合物和八氯二丙醚进行循环提取,考察快速溶剂萃取循环次数对土壤样品中菊酯类和八氯二丙醚的影响。分别考察了循环1次、2次和3次的提取效率,结果表明循环2次和3次的提取效率结果相差不大,因此考虑到节省时间、试剂等资源,选择快速溶剂萃取的循环次数为2次。
2.6 专属性试验
在1.2仪器工作条件下,对6种菊酯类化合物和八氯二丙醚的标准样品进行分析测定,色谱图如图2所示。从图2中可以看出,6种菊酯类化合物和八氯二丙醚均无干扰,色谱峰分离度良好,表明该方法专属性良好。
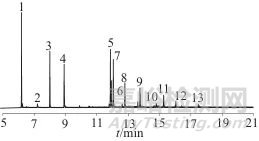
图2 6种菊酯类和八氯二丙醚色谱图
Fig. 2 Chromatogram of 6 pyrethroids and octachlorodipropyl ether
1—四氯间二甲苯;2—菲-d10;3—八氯二丙醚;4—富右旋反式烯丙菊酯;5—胺菊酯;6—联苯菊酯;7—䓛-d12;8—顺式氯氟氰菊酯;9—反氯菊酯;10—氯氰菊酯;11—芘-d12;12—氰戊菊酯;13—溴氰菊酯
2.7 线性方程和检出限
取系列混合标准工作溶液分别进样,记录色谱图。以目标物质量浓度(x)为横坐标,以色谱峰面积(y)为纵坐标,进行线性回归,绘制标准曲线。6种菊酯类化合物和八氯二丙醚的的线性范围、线性方程、相关系数、检出限及定量限见表2。由表2可知,6种菊酯类化合物和八氯二丙醚的质量浓度在200~8 000 mg/kg范围内与色谱峰面积线性关系良好,相关系数均大于0.995。采用最低质量浓度标准工作溶液连续进样测定7次,计算标准偏差,分别以3倍标准偏差对应的质量浓度作为检出限,10倍标准偏差对应的质量浓度作为作为定量限,得方法检出限为0.02~0.11 mg/kg,定量限为0.06~0.33 mg/kg。
表2 6种菊酯类化合物和八氯二丙醚的线性范围、线性方程、相关系数、检出限及定量限
Tab. 2 Linear range,linear equation,correlation coefficient and detection limits of pyrethroid pesticides and octachlorodipropyl ether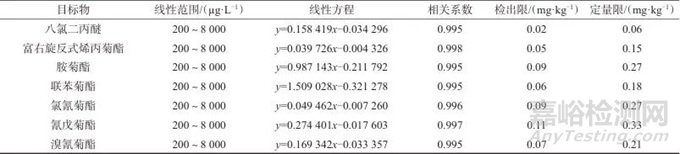
2.8 加标回收与精密度试验
考察了空白土壤样品中20、200、500 μg/kg三个水平加标浓度下6种菊酯类和八氯二丙醚化合物的回收率,平行测定6次,加标回收与精密度试验结果见表3。由表3可知,6种菊酯类化合物和八氯二丙醚在3个加标水平下的平均回收率为78.08%~128.08%,测定结果的相对标准偏差(RSD)为1.37%~9.08%(n=6)。表明该方法具有良好的准确度和精密度,可准确测定土壤中6种菊酯类化合物和八氯二丙醚。
表3 加标回收与精密度试验结果
Tab. 3 Results of tests for Precision and standard addition ( % )

注:低、中、高三个水平加标浓度分别为20、200、500μg/kg。
3. 结语
建立了气相色谱质谱联用法测定土壤中6种菊酯类化合物和八氯二丙醚残留量。通过对萃取溶剂种类、萃取温度以及萃取循环次数等条件进行优化,确定最优的前处理条件,并采用气相色谱串联质谱法测定。该方法灵敏度高、专属性良好,可以满足土壤中菊酯类农药和八氯二丙醚残留的检测要求。
参考文献:
1 华纯.拟除虫菊酯类农药的进展和剂型[J].世界农药,2009,31(5):39.
HUA Chun. Progress and formulation of pyrethroid pesticides[J]. World Pesticides,2009,31(5):39.
2 许晓国.气相色谱(ECD)法同时测定蔬菜和水果中8 种菊酯类农药残留[J].中国卫生检验,2008,18(1):62.
XU Xiaoguo. Determination of pyrethroid pesticides residual in vegetable and fruits by gas chromatography with ECD[J]. Chinese Journal of Health Laboratory Technology,2008,18(1):62.
3 OINHEIRO A D S,ROCHA G O D,ANDRADE J B D. A sdme/GC-MS methodology for determination of organophosphate and pyrethroid pesticides in water[J]. Microchemical Journal,2011,99(2):303.
4 WANG Hui,YAN Hongyuan,QIAO Jindong. Miniaturized matrix solid phase dispersion combined with ultrasound assisted dispersive liquid-liquid micro-extraction for the determination of three pyrethroids in soil[J]. Journal of Separayion Science,2021,35(2):292.
5 ELSER B A,HING B,STEVENS H E. A narrative review of converging evidence addressing developmental toxicity of pyrethroid insecticides[J]. Critical Reviews in Toxicology,2022,52(5):371.
6 袁红霞,秦粉菊.环境激素拟除虫菊酯类农药的内分泌干扰效应[J].安徽农业科学,2007,35(33):10 714.
YUAN Hongxia,QIN Fenju. Endocrine disrupting Effects of pyrethroid Pesticides[J]. Anhui Agricultural Sciences,2007,35(33):10 714.
7 吕辉雄,黄慧娟,蔡全英,等.八氯二丙醚的研究现状与展望[J].生态环境学报,2011,20(2):379.
LYU Huixiong,HUANG Huijuan,CAI Quanying,et al. Current situation and prospect of octachlorodipropyl ether[J]. Ecology and Environmental Sciences,2011,20(2):379.
8 崔连喜,王艳丽.加速溶剂萃取-五氟苄基衍生化-气相色谱/质谱法测定土壤中酚类化合物[J].中国测试,2020,46(11):59.
CUI Lianxi,WANG Yanli. GC/MS determination of phenols in soil after extraction with ASE and derivatization with pentafluorobenzyl bromide[J]. China Measurement and Testing Technology,2020,46(11):59.
9 黄旭,张兵,邓泽元.超声波提取-气相色谱法同时检测白菜中拟除虫菊酯残留[J].中国食品学报,2018,18(2):6.
HUANG Xu,ZHANG Bing,DENG Zeyuan. Determination of pyrethroid residue in cabbage using ultrasonic extraction GC-ECD simultaneous[J]. Journal of Chinese Institute of Food Science and Technology,2018,18(2):238.
10 侯博,范艳,韩永辉,等.酸碱净化-改进的衍生化气相色谱/质谱法测定土壤中11种酚类化合物[J].化学试剂,2022,44(1):110.
HOU Bo,FAN Yan,HAN Yonghui,et al. Determination of 11 phenolic compounds in soil by acid base purification-modified derivatization gas chromatography/mass spectrometry[J]. Chemical Reagents,2022,44(1):110.
11 王威,窦文渊,郭杰煌,等.加速溶剂萃取-气相色谱-质谱法同时测定污泥中37种有机磷类及10种拟除虫菊酯类农药[J].理化检验(化学分册),2021,57(7):591.
WANG Wei,DOU Wenyuan,GUO Jiehuang,et al. Simultaneous Determination of 37 organophosphorus and 10 pyrethroid Pesticides in Sludge by GC-MS after Extraction with ASE[J]. Physical Testing and Chemical Analysis (Part B:Chemical Analysis),2021,57(7):591.
12 姬晓灵,屈爱桃,汪岭,等.黑木耳中7种拟除虫菊酯类农药残留的气相色谱检测方法[J].现代预防医学,2010,37(7):1 346.
JI Xiaoling,QU Aitao,WANG Ling,et al. an Analytical method for the multi-residue determination of 7 pyrethroids pesticides in auricularia aurlcula by gas chromatography[J]. Modern Preventive Medicine,2010,37(7):1 346.
13 符靖雯,林玉婵,黄梅花,等. QuEChERS萃取结合GC-ECD测定甜玉米中多种有机氯及拟除虫菊酯类农药残留[J].理化检验(化学分册),2017,53(9):1 036.
FU Jingwen,LIN Yuchan,HUANG Meihua,et al. Determination of organochlorine and pyrethroid pesticide residues in sweet corn by GC-ECD with QuEChERS extraction method[J]. Physical Testing and Chemical Analysis (Part B:Chemical Analysis),2017,53(9):1 036.
14 时磊,孙艳艳,沈小明,等.全二维气相色谱-电子捕获检测器测定复杂基质土壤中24种有机氯和拟除虫菊酯类农药[J].岩矿测试,2020,39(6):856.
SHI Lei,SUN Yanyan,SHEN Xiaoming,et al. Determination of 24 organochlorine pesticides and pyrethroids in complex matrix soils by comprehensive two dimensional gas chromatography with micro electron capture detector[J]. Rock and Mineral Analysis,2020,39(6):856.
15 郭晓辰,饶竹,高冉.气相色谱法测定地下水中拟除虫菊酯有机氯百菌清等24种农药残留[J].岩矿测试,2014,33(3):406.
GUO Xiaochen,RAO Zhu,GAO Ran. Determination of 24 pesticides including pyrethroids organochlorines and chloro-thalonil in underground water by gas chromatography[J]. Rock and Mineral Analysis,2014,33(3):406.
16 黄旭,张兵,邓泽元.超声波提取-气相色谱法同时检测白菜中拟除虫菊酯残留[J].中国食品学报,2018,18(2):238.
HUANG Xu,ZHANG Bing,DENG Zeyuan. Determination of pyrethroid residue in cabbage using ultrasonic extraction GC-ECD Simultaneous[J]. Journal of Chinese Institute of Food Science and Technology,2018,18(2):238.
17 林子俺,龚巧燕,谢增鸿.高效液相色谱测定蔬菜中拟除虫菊酯类农药残留[J].福州大学学报:自然科学版,2008,36(1):122.
LIN Zian,GONG Qiaoyan,XIE Zenghong. Determination of pyrethroid multi residuce in vegetables by high performance liquid chromatography[J]. Journal of Fuzhou University (Natural Science),2008,36(1):122.
18 赵文霏,井冲冲,荆旭,等.离子液体分散液液微萃取-水相固化-高效液相色谱法测定食用菌中3种拟除虫菊酯类农药的残留量[J].理化检验(化学分册),2020,56(5):87.
ZHAO Wenfei,JING Chongchong,JING Xu,et al. HPLC Determination of residual amounts of 3 pyrethroids in edible fungi with ionic liquid dispersive liquid liquid micro-extraction based on solidification of aqueous phas[J]. Physical Testing and Chemical Analysis (Part B:Chemical Analysis),2020,56(5):87.
19 杨敏娜,秦兴秀,王来梁.超高效液相色谱-串联质谱法测定水中拟除虫菊酯类和有机磷农药残留[J].环境监控与预警,2021,13(2):24.
YANG Minna,QIN Xingxiu,WANG Lailiang. Determination of pyrethriod pesticide and organic phosphorus pesticide residues in water by ultra performance liquid chromatography-tandem mass spectrometry[J]. Environmental Monitoring and Forewarning,2021,13(2):24.
20 张聪,周常义,江锋,等.超高效液相色谱-串联质谱法测定动物性食品中10种拟除虫菊酯类农药残留[J].分析测试学报,2018,37(8):887.
ZHANG Cong,ZHOU Changyi,JIANG Feng. et al. Determination of 10 pyrethroid pesticide residues in animal foods by ultra performance liquid chromatography-tandem mass spectrometry[J]. Journal of Instrumental Analysis,2018,37(8):887.
21 焦慧泽,陆世清,侯迪,等.加速溶剂萃取-超高速液相色谱-串联质谱法测定茶叶中拟除虫菊酯类农药残留[J].色谱,2019,37(6):605.
JIAO Huize,LU Shiqing,HOU Di,et al. Determination of Pyrethroid pesticides in tea by accelerated solvent extraction and ultra performance liquid chromatography tandem mass spectrometetry[J]. Chinese Journal of Chromatography,2019,37(6):605.
22 张晓赟,张丽君,张占恩.分散液液微萃取-气质联用法测定水样中的菊酯类农药[J].苏州科技学院学报(工程技术版),2011,24(4):4.
ZHANG Xiaoyun,ZHANG Lijun,ZHANG Zhanen. et al. Determination of pyrethroid pesticides in water samples by dispersive liquid-liquid micro extraction coupled with GC-MS[J]. Journal of Suzhou University of Science and Technology(Engineering and Technology),2011,24(4):4.
23 黄薇,李娜,徐瑞晗,等.加速溶剂萃取-固相萃取净化-气相色谱-串联质谱法检测茶叶中9种拟除虫菊酯类农药残留[J].色谱,2018,36(12):1 303.
HUANG Wei,Li Na,XU Ruihan,et al. Determination of nine pyrethroed pesticide residues in tea by gas chromatography tandem mass spectrometry combined with accelerated solvent extraction and solid phase extraction[J]. Chinese Journal of Chromatography,2018,36(12):1 303.
24 李俊,肖雅雯,王震,等.加速溶剂萃取-气相色谱/质谱法同时测定土壤中拟除虫菊酯类等18种农药残留[J].岩矿测试,2011,30(5):590.
LI Jun,XIAO Yawen,WANG Zhen.et al. Simultaneous determination of 18 pesticide residues including pyrethroids in soils by gas chromatography-mass spectrometry with accelerated solvent extraction[J]. Rock and Mineral Analysis,2011,30(5):590.
25 李佳,张占恩,张磊.分散固相萃取-气相色谱-质谱法测定地表水中的3种拟除虫菊酯含量[J].理化检验(化学分册),2015,51(12):1 717.
LI Jia,ZHANG Zhanen,ZHANG Lei. SPE-GC-MS determination of 3 pyrethroids in surface water[J]. Physical Testing and Chemical Analysis (Part B:Chemical Analysis),2015,51(12):1 717.
引用本文: 乔淞汾,杨利娟,冉卓,等 . 快速溶剂萃取-气相色谱-质谱联用法测定土壤中菊酯类和八氯二丙醚[J]. 化学分析计量,2024,33(11):91. (QIAO Songfen, YANG Lijuan, RAN Zhuo, et al. Determination of pyrethroids and octachlorodipropyl ether in soil by gas chromatography-mass spectrometry with rapid solvent extraction[J]. Chemical Analysis and Meterage, 2024, 33(11): 91.)

来源:化学分析计量


