您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-03-27 18:13
在医疗器械的研发与生产过程中,灭菌是确保产品安全性的核心环节。湿热灭菌凭借其高效、安全可靠的特点,成为医疗器械行业中应用较为广泛的灭菌方式之一。但在医疗器械行业,湿热灭菌相对于环氧乙烷灭菌和辐照灭菌又是一个比较小众的灭菌方式,因此很多人对此并不太熟悉。本文结合法规标准与个人的灭菌实践,系统解析湿热灭菌的知识要点和常见的问题,期望能够给从业者带来一些启示。
1.湿热灭菌法规
湿热灭菌需要参考的核心标准以及指南主要包括:
GB18278.1/2(ISO17665-1/2) 医疗器械产品灭菌 湿热 第一部分 医疗器械灭菌过程的开发、确认和常规控制要求以及指南
药品GMP&WHO GMP
ISO11138-1 医疗器械灭菌 生物指示剂一般要求
EN 285:欧洲大型灭菌设备(如预真空灭菌柜)的性能与测试标准,涵盖蒸汽质量检测要求。
PDA技术报告:PDA TR1(湿热灭菌验证)和TR48(湿热灭菌工艺监控)提供行业实践指南。
2.湿热灭菌工艺类别
根据灭菌原理与适用场景,主要灭菌工艺包括:
1. 饱和蒸汽重力置换工艺
重力置换程序是基于灭菌器腔体内空气比蒸汽更冷更重而将下沉腔体底部的原理。主要用于物体表面灭菌。由于蒸汽进入腔体,空气被排挤底部排水沟并且连同冷凝水一起从排水阀和或疏水阀排出腔体外,疏水阀是被设计为有效地允许大量空气通过的通道。
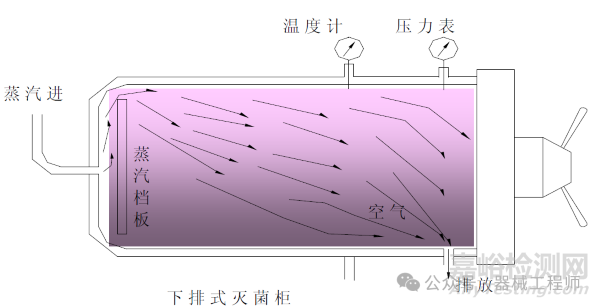
灭菌过程由3个阶段组成,第1段为加热过程,使灭菌柜达到相应的灭菌温度和饱和蒸汽压力。第2段是灭菌暴露过程,维持饱和蒸汽灭菌温度和时间。第3段是冷却阶段,冷却阶段避免快速减压,需通入空气。
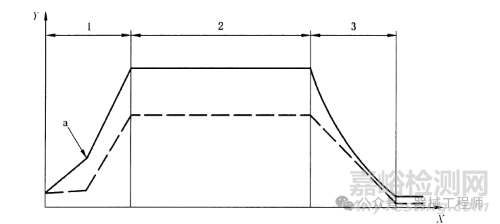
2. 饱和蒸汽-预真空和脉动真空工艺
该灭菌主要用于难以排出空气的产品,比如多孔材料、管路或者包装等。真空的目的就是有效排除空气,消除冷点,让饱和蒸汽与灭菌产品充分接触。目前普遍采用的技术是脉动真空。
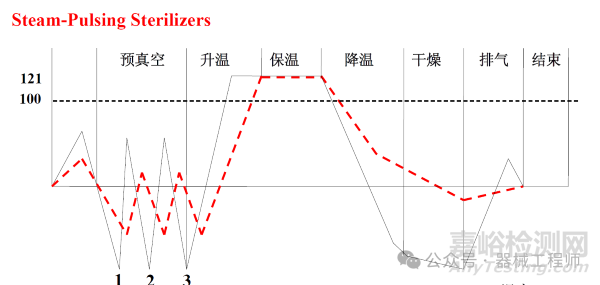
3. 空气蒸汽混合灭菌工艺
尽管空气通常被认为会降低纯蒸汽的灭菌穿透效率,但是有时候需要空气和蒸汽混合灭菌的方式。例如一个装有注射液的无菌玻璃瓶需要进行湿热灭菌,瓶内有一定的空气存在,当温度升高后,瓶内压力升高。当排气过程中压力差变得非常大的情况下,玻瓶瓶可能会破裂。因此通过诸如压缩空气维持压力并快速冷却产品是有必要的。目前比较流行的医美产品所使用的预灌封注射器在灭菌过程也存在类似问题,通过空气加压避免胶塞活动。
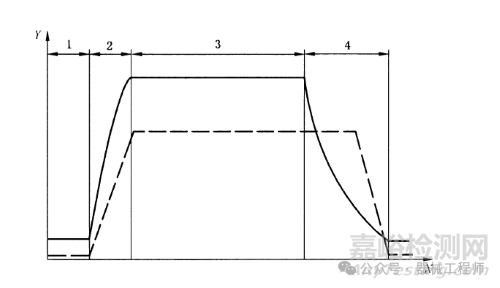
4. 过热水喷淋等灭菌工艺
药品制剂类可能会用到此灭菌工艺,比如乳剂、氨基酸等。灭菌过程主要包括4个阶段,注水阶段、加热阶段(蒸汽加热循环水,水喷淋产品)、灭菌阶段(保温)和冷却阶段。医疗器械很少有这种灭菌方式。
3.湿热灭菌工艺要点
1. 灭菌关键参数定义:
D值:在特定温度下杀灭90%微生物所需时间(单位:分钟),用于评估生物指示剂抗性。
Z值:使某种微生物D值降低一个对数级所需的温度变化(单位:℃),灭菌温度升高的度数,反映微生物对温度的敏感性,如下图湿Z值为10℃。
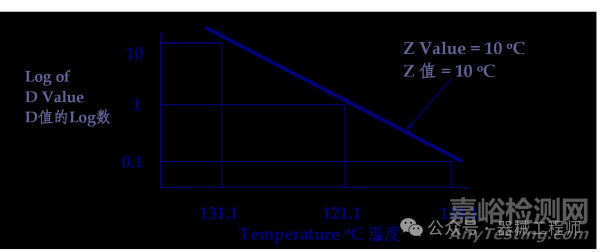
F0值(标准灭菌时间):是指参照高温度121.1℃,Z取10℃时计算的等效灭菌时间。例如当生物指示剂Z取10℃,F(T=121.1℃,Z=10℃)赋予产品8分钟的程序,F0=8, 与一个116℃灭菌25.9分钟灭菌等效,F0均为8分钟。
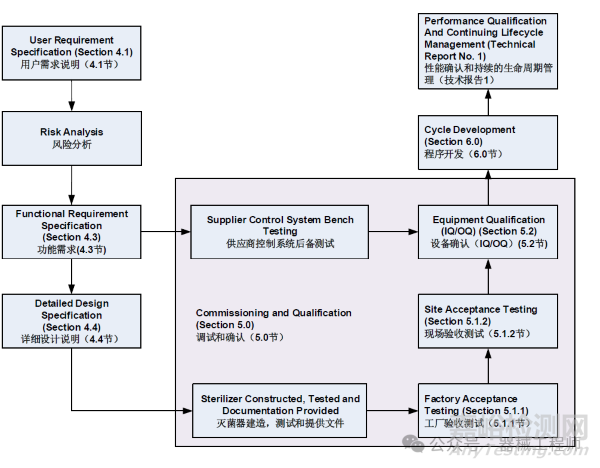
2. 灭菌柜设备以及软件验证
湿热灭菌柜是一个比较复杂的设备,通常来说应当具有完整的设备验证文件以及软件验证文件,包括URS/DQ/FAT/SAT/IQ/OQ/PQ。URS由设备需求方输出,需求方结合产品的特点,给出灭菌柜的关键需求,例如尺寸需求、选择的灭菌工艺等。设备制造方根据用户需求设计设备,同时提供全套的灭菌验证服务,包括DQ/FAT/SAT等验证服务。
3. 灭菌工艺开发
不同产品的灭菌工艺需要进行针对性的开发和研究,例如无菌服、西林瓶产品、预灌封产品的额灭菌工艺是不同的,选择合适的灭菌工艺至关重要。当确定灭菌工艺后,要针对灭菌不同阶段的工艺参数进行调整和摸索,包括加热阶段(heating)、暴露阶段(exposure)、冷却阶段(cooling)。
4. 灭菌工艺验证(OQ)
灭菌工艺部分的验证包括OQ以及PQ部分。OQ部分包括的内容主要有:
纯蒸汽质量检测(不冷凝气体、过热值、干燥值,一般委托第三方测试);
温度分布测试(小装载热分布、满载热分布3次);
BD测试验证纯蒸汽换头情况(化学指示剂);
空气泄露率测试
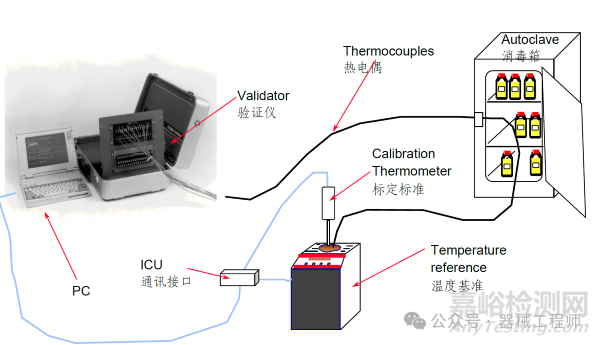
需要注意的是在做温度均匀分布测试时,需要合理的布置探头数量,并且完成测试后应当对每个阶段数据进行分析,尤其是保温阶段温度分析,确定温度波动范围以及冷点位置。温度探头位置以图示形式进行展示。
5. 灭菌工艺验证(PQ)
湿热灭菌PQ验证的思路基本同环氧乙烷,核心要点如下:
过程挑战装置(PCD)应当是产品族中最难灭菌的规格,BI应当在最难灭菌位置。
过程挑战装置(PCD)均匀分布在灭菌器内,且考虑最难灭菌位置放置过程挑战装置(PCD)。
过度灭杀法包括运行一次短周期、3次半周期以验证无菌保障水平是否能达到10-6,同时进行两次全周期以确认产品性能不受灭菌影响(包括包装完整性)。短周期考虑产品和PCD强度对比,确认PCD强度高于产品。当产品不耐高温灭菌时,考虑部分阴性法(和EO类似,这个验证较为复杂)。
半周期和全周期可同步进行热穿透试验(3次),确认产品内部温度穿透情况(例如探头插入玻璃瓶)。探头位置要明确表示。
F0值以最冷点达到121℃后开始计算。
4.湿热灭菌常见问题
1. 灭菌温度为何选择121℃而非120℃?
121℃(250℉)是早期研究确定的饱和蒸汽灭菌基准温度,其对应的压力(约2 bar)可实现高效微生物杀灭。
根据Z值=10℃的模型,121℃下的灭菌效率比120℃高约1.26倍(Fo值计算更易达标)。
2. 常见的问题
BI培养天数
很多嗜热芽孢杆菌BI说明书规定的天数为3,但是ISO11138-1建议参考的湿热灭菌BI培养的天数是7天,并且明确如果培养天数少于建议的天数,应当进行验证。 FDA在“FDA guildline to validation of BI incubation time”指南中给出了缩短BI培养时间的指南。
没有对验证的数据进行充分的分析
ISO17665标准明确需要对灭菌验证过程的数据进行分析,包括温度、压力、F0值等。
没有定期进行纯蒸汽质量检测
标准要求至少每年需要进行纯蒸汽质量检测,因此每年应当进行该测试。很多企业忽视这一点。
PCD选择不合适
PCD选择应当涵盖产品族最难灭菌产品,因此企业要在灭菌验证方案中要充分论证PCD选择的合理性。
灭菌柜验证不充分,包括软件验证
完整的验证包括URS/DQ/FAT/SAT/IQ/OQ, FDA对于灭菌柜验证文件审核较为严格。另外应当重视软件验证的数据完整性问题,技术备份电子温度数据以及纸质记录。

来源:器械工程师


