您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-10-22 09:05
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
科兴中维新冠灭活疫苗Ⅲ期临床结果积极。科兴中维新冠灭活疫苗克尔来福(CoronaVac)在巴西开展的Ⅲ期临床获积极中期安全性数据。已有9000名18-59岁志愿者接受两剂克尔来福的疫苗接种。只有35%的志愿者在接种疫苗后出现轻度不良反应。第一剂疫苗后常见的不良反应为注射部位的疼痛(19%)和头疼(15%)。第二剂疫苗后常见的不良反应为注射部位的疼痛(19%),头疼(10%)和疲惫(4%)。只有0.1%的志愿者出现低烧,目前没有严重不良反应报告。这一试验预计将注册13000名志愿者。
国内药讯
1.国药集团苯甲酸阿格列汀片获批上市。国药集团国瑞药业4类仿制药苯甲酸阿格列汀片获国家药监局批准上市。原研阿格列汀(Alogliptin)是武田制药研发的一种二肽基肽酶 4(DPP-4)抑制剂(商品名:尼欣那),2010年4月在日本获批用于治疗2型糖尿病。尼欣那已于2013年获批进口中国。该品种获批的国内厂家已有亚宝药业、华世通生物、德源药业和诺泰生物四家。
2.正大天晴卡培他滨片通过一致性评价。正大天晴卡培他滨片获国家药监局批准通过一致性评价。卡培他滨是一种5-氟尿嘧啶的前体药物,能够在体内通过肿瘤组织中高浓度的胸苷磷酸化酶(TP)转化为5-氟尿嘧啶,抑制DNA和RNA的合成,发挥抗肿瘤作用。2019年中国公立医疗机构终端卡培他滨片销售额接近35亿元,原研厂家罗氏占据73.5%的市场份额。该品种国内仅有齐鲁制药、恒瑞医药和正大天晴3家药企的仿制药获批。
3.信立泰盐酸达泊西汀片即将获批。信立泰4类仿制药盐酸达泊西汀片上市申请进入“在审批”阶段,有望近期获批。盐酸达泊西汀是一种短效选择性5-羟色胺再摄取抑制剂,由强生原研,主要适用于治疗18-64岁男性早泄患者。盐酸达泊西汀是目前唯一获批用于治疗早泄的化学药物。华铂凯盛生物和科伦药业的达泊西汀已先后在中国获批,并视同通过一致性评价。
4.杨森CD38单抗两项上市申请拟纳入优先审评。杨森达雷妥尤单抗注射液的两项上市申请获CDE纳入拟优先审评公示名单。达雷妥尤单抗是全球首个获批上市的CD38靶向单抗,早前该药已在中国获批单药治疗多发性骨髓瘤成年患者。本次提交的两项新适应症上市申请为,与来那度胺和地塞米松联合用药或与硼替佐米和地塞米松联合用药,治疗既往至少接受过一线治疗的多发性骨髓瘤成人患者。
5.加科思药业SHP2抑制剂获FDA孤儿药资格。FDA授予加科思药业原创新药JAB-3312治疗食管癌的孤儿药资格,可用于支持该药在食管癌适应症上的全球开发。这是一款变构蛋白酪氨酸磷酸酶(SHP2)抑制剂,为加科思药业第二个自主设计开发、具有全球知识产权的小分子口服抗肿瘤药。此前,加科思药业已与艾伯维达成全球战略合作,后者将获得加科思药业SHP2项目的独家许可权。
国际药讯
1.默沙东15价肺炎链球菌疫苗两项Ⅲ期结果积极。默沙东在研15价肺炎链球菌疫苗V114,在两项Ⅲ期临床【PNEU-PATH(V114-016)和PNEU-DAY(V114-017)】中均达到主要免疫原性目标,激发对疫苗中包含的15个血清型的强力免疫反应。其中在PNEU-DAY试验中,因为基础疾病而导致肺炎球菌疾病风险增加的成人(18-49岁)接受V114或PCV13的疫苗接种。在接种30天后,在两种疫苗共享的13种血清型中,V114激发的免疫应答与PCV13基本相当,V114组对血清型22F和33F的免疫应答更高。该公司计划年底向FDA递交监管申请。
2.Blueprint公司RET抑制剂治疗NSCLC临床新数据。Blueprint公司RET抑制剂pralsetinib在NACLC2020年会上公布了多项临床数据(包括一项Ⅲ期临床,以及一项Ⅰ/Ⅱ期ARROW试验的注册临床数据)。ARROW结果显示,pralsetinib对晚期RET融合非小细胞肺癌(NSCLC)患者具有快速、有效和持久的临床活性,而且不论RET融合基因型或以前的治疗方法如何。其中,116例受试者的ORR达到65%,DCR达到93%。今年9月,Gavreto(pralsetinib)已获FDA加速批准用于治疗RET融合阳性NSCLC患者。
3.默克TGF-β/PD-L1免疫疗法治疗NSCLC临床新进展。默克在NACLC2020年会上公布其TGF-β/PD-L1双功能免疫疗法bintrafusp alfa二线治疗晚期非小细胞肺癌(NSCLC)的3年随访数据。数据显示,中位DOR为18个月,21.2% (n=2)的患者有持续≥24个月的反应。12个月、24个月和36个月的OS比率分别为66.2%、39.7%和23.2%。在PD-L1表达的亚组中,PD-L1阳性(≥1%)患者中位OS为21.7个月,高PD-L1表达(≥80%)患者中位OS未达到。PD-L1阳性患者36个月OS率为33.6%,高PD-L1表达患者这一数值为66.7%。
4.Agios撤回白血病药物Tibsovo在欧盟的上市申请。Agios公司宣布已撤回急性白血病药物Tibsovo(ivosidenib)在欧洲市场的一项销售许可申请,该申请主要针对IDH1(异柠檬酸脱氢酶-1)突变的复发或难治性急性髓性白血病(R/R AML)。欧洲医药管理局人用医药产品委员会(CHMP)认为,Agios公司提供的I期临床数据不足以证明该药物的临床获益与风险相平衡。而FDA恰恰是基于这项I期临床数据,于2018 年7月批准了该药在美国上市的申请。
5.Vifor Pharma与Cara扩大肾脏疾病药物研发合作。Vifor Pharma与Cara Therapeutics就Cara旗下“first-in-class”Kappa阿片受体(KOR)激动剂Korsuva(difelikefalin)签署了一份新的商业许可协议。Korsuva是一款治疗慢性肾病相关性瘙痒症(CKD-aP)的注射液药物。根据协议,Vifor将获得Korsuva在美国的商业化权利;Cara将获得1亿美元预付款和5000万美元的股权投资,以及总额可能高达2.9亿美元的里程碑付款;Cara将获得该产品在美国透析市场上(非费森尤斯医疗保健诊所覆盖)60%的利润分成,Vifor占据40%。
6.IN8bio公司在美国递交IPO申请。新一代T细胞疗法公司IN8bio(Incysus Therapeutics)宣布已向美国证券交易委员会递交IPO申请,拟募资8600万美元并登陆纳斯达克。本次融资用于推进其在研γ-δT细胞疗法INB-200和INB-100的Ⅰ期临床,并启动后续的Ⅱ期临床。INB-200拟开发用于新诊断胶质母细胞瘤患者的治疗,INB-100拟用于接受造血干细胞移植的白血病患者。此外,部分资金还将用来完成其他候选药物的临床申请。
医药热点
1.新冠病毒能在皮肤上存活9小时。日本科学家发表于《临床传染病》半月刊上的一项最新研究结果表明,新冠病毒可在人体皮肤上保持活性长达9小时。日本研究团队从死亡大约一天的遗体解剖样本中选取皮肤做测试,发现引发流感的病原体可在皮肤上保持活性大约1.8小时,而引发新冠的病毒株存活时间长达9小时。该研究还显示,使用含酒精的手部消毒剂可在15秒内使新冠病毒和流感病毒失去活性。
2.新冠疫苗Ⅲ期临床已接种约6万人。10月20日,国务院应对新冠肺炎疫情联防联控工作机制召开新闻发布会,围绕新冠疫苗的相关问题回应社会关切。据介绍,由中国研发的、进入Ⅲ期临床阶段的4款新冠疫苗总体进展顺利,截至目前共接种约6万名受试者,未收到严重不良反应报告,初步显示了良好的安全性。中国生物、科兴中维两家灭活疫苗研发企业均已完成生物安全生产工厂的建设,两家企业灭活疫苗的年产能总计可达13亿剂以上。
3.王辰当选美国国家医学科学院外籍院士。美国国家医学科学院(NAM)10月19日宣布,90名本国学者和10名外籍学者分别新当选美国国家医学科学院院士和外籍院士。我国呼吸与危重症医学专家,中国工程院院士、中国工程院副院长,中国医学科学院北京协和医学院院校长王辰当选美国医学科学院外籍院士。NAM是美国在医学领域最高水平的学术机构,目前拥有逾2200名院士及175名外籍院士。
4.复旦大学附属儿科医院启东分院揭牌。10月18日,江苏省启东市妇幼保健院挂牌复旦大学附属儿科医院启东分院,成为复旦儿科“一体两翼多中心”发展蓝图中的重要组成部分,这也是复旦儿科医院服务国家战略、推动长三角医疗卫生健康事业一体化融合发展的又一个里程碑。启东分院开设消化、呼吸、内分泌、新生儿科、NICU、PICU等儿科亚专科,逐步建设儿外科,积极建设新生儿危急重症救治中心、新生儿疾病筛查管理中心、0-3岁儿童早期发展省级示范基地。
股市资讯
【京新药业】公司收到国家药品监督管理局核准签发的化学药品“盐酸普拉克索片”的《药品补充申请批准通知书》,该药品通过仿制药一致性评价。盐酸普拉克索片是德国勃林格殷格翰药业有限公司开发研制的用于治疗特发性帕金森病的体征和症状的药物。
【海王生物】公司全资子公司深圳海王医药科技研究院有限公司收到国家药品监督管理局核准签发的《药物临床试验批准通知书》,批准HW130注射液进行临床试验。HW130注射液是海王医药研究院自主研发、具有自主知识产权的新型肿瘤血管阻断剂。
【力生制药】公司收到国家药品监督管理局颁发的关于异烟肼片0.1g规格的《药品补充申请批准通知书》,该药品通过仿制药质量和疗效一致性评价。本品与其他抗结核药物联合,适用于对异烟肼敏感的各型结核病治疗。
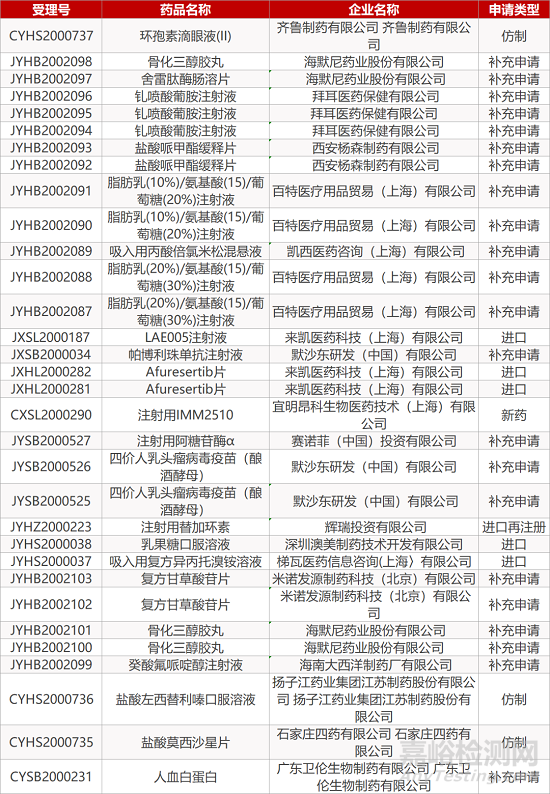
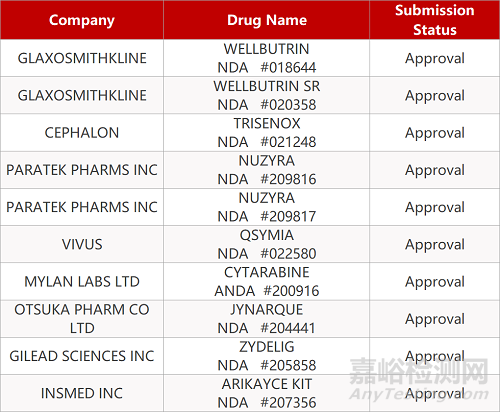
审评动向
- The End -

来源:药研发


