您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-02-18 11:33
摘要:共晶为单一相结晶性化合物,由两种或多种分子以一定化学计量比通过非共价键结合而成。与原料药相比,共晶在溶解度、溶出速率、生物利用度以及稳定性等方面存在优势,从而引起广泛关注。然而共晶开发过程中面临制备方法与筛选方法的匮乏以及批生产风险性高等问题。因此本文就药物共晶制备技术与筛选方法进行较为全面的论述。结合QbD理念,强调PAT技术对于过程控制的重要性。提倡结合PAT技术的连续结晶工艺在药物共晶结晶领域的开发与应用。
1、引言
新药项目早期研发阶段需要对化合物分子进行筛选,并应对其物理性质、生物性质、生产可行性等进行全面评估。化合物性质认知的缺失将给后期研发带来巨大挑战,甚至存在变更候选化合物的风险。API不同的固态形式(Solidform),如晶型、无定形、溶剂化物、盐型与共晶,在理化性质、机械性能、化学稳定性、生物利用度与工艺可行性等方面存在差异。因此API固态形式的筛选与临床用药化合物分子的锁定是新药研发的重要一环。
API可形成两类固态形式,即结晶态与无定形。结晶态包括多晶型、溶剂化物、盐型与共晶。其中多晶型晶胞中仅包含API分子。溶剂化物、盐型与共晶晶胞中除API分子外均引入外来分子。API固态形式分类如图1所示。无定形比结晶态具有更高的自由能与更强的分子活性,因此具有较好的溶解性。但较高的自由能使无定形稳定性差,高温或长时间保存有转变为结晶态的趋势。因此API分子常选择结晶态进行开发。
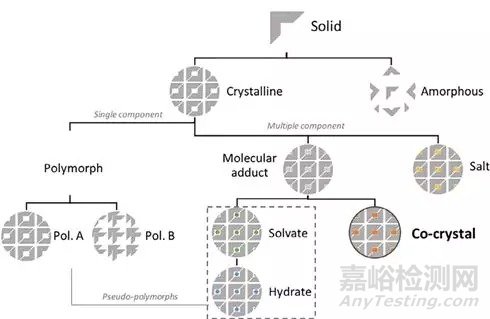
图1 API固态形式分类[1]
化合物内部分子或原子在晶格空间的排列方式和填充形式的不同形成多晶型。有机物普遍存在多晶型现象。多晶型在熔点、密度、晶体形貌(晶习或晶癖)、吸湿性、稳定性、溶解性、溶出度等方面存在差异,进而体现不同的生物利用度。因此高效的筛选化合物的潜在晶型对临床供药分子的选择具有战略性意义。
若结晶过程中溶剂分子进入晶胞与化合物分子键合,则形成溶剂化物。晶胞中存在的溶剂分子影响分子间作用力,从而改变溶剂化物的理化性质。溶剂化物稳定性较差,在干燥或储存过程中易失去溶剂分子转变为无定形或其他晶型,从而理化性质发生变化。
可电离的API分子(阳离子与阴离子)与反离子通过离子键结合形成药物盐型。盐型是API改性的常用手段,据统计约50%药物的申报晶型均是盐型。然而不可电离的化合物分子无法成盐,需与配体分子形成共晶。EMA对共晶的定义为两种或多种组分在晶胞中以一定的化学计量比通过非离子键结合而成的均相晶体。API与配体可为酸、碱或中性化合物。对于离子化合物,API与配体以非离子键结合则可形成共晶。FDA运用API与配体的解离常数的差值ΔpKa对盐型与共晶进行区分。即当ΔpKa<1时,形成共晶。若ΔpKa>2.7至3,形成盐型的可能性更高。可采用单晶衍射、拉曼光谱与核磁共振等有效的检测方法对盐型与共晶进行区分。需指出盐型与共晶同样存在多晶型与溶剂化物现象。但相比于API分子本身更为少见。一般共晶的溶解性高于API多晶型而具有较好的溶出与生物利用度。因此共晶是提高BSC Ⅱ类与Ⅳ类化合物溶解性的有效方法。下面从共晶制备技术、共晶筛选方法以及共晶生产工艺三个方面进行详细介绍。
2、共晶制备技术
共晶制备方法直接影响成品含量、晶型、粒度分布与晶体形貌等理化性质。应充分了解API、配体与共晶的溶解性与热稳定性,综合考虑制备方法的能耗、单位产量、工艺放大可行性与调控性等,选择最优方法进行开发。按照方法中是否有溶剂参与,将共晶制备技术分为溶剂依赖型与无溶剂型。溶剂依赖型为传统共晶制备方法,广泛应于共晶筛选与不同规模的批生产。无溶剂共晶制备技术秉承绿色化工的原则,制备过程中不需要溶剂的参与,减小溶剂化物生成的可能性。下面对共晶制备技术进行逐一介绍。
2.1 溶剂依赖型共晶制备技术
2.1.1 蒸发结晶
该方法是将API与配体按照一定比例溶解于溶剂中。减压升温蒸发溶剂使共晶析出。蒸发结晶简单高效,是共晶筛选的常用方法。投料配比与结晶温度影响析出组分。因此需要构建API-配体-溶剂三元体系相图,在共晶结晶区等温蒸发获得共晶。若在API或配体结晶区蒸发,存在析出单组分的风险。此外,蒸发结晶可能获得共晶的溶剂化物。
2.1.2 冷却结晶
冷却结晶通过降低温度,使溶液获得过饱和度,从而析出共晶。因此冷却结晶同样需要三元体系相图作为指导。选择的系统点在高温时处于不饱和区,在此温度下按照系统点各组分配比加料,等温平衡搅拌,API与配体可完全溶解。随后冷却,在低温三元相图中系统点位于共晶结晶区,在此温度下等温搅拌即可获得共晶。
2.1.3溶析结晶
通过添加反溶剂(不良溶剂)降低溶质在溶液中的溶解度,使溶液过饱和度增加推动晶体成核,该方法为溶析结晶。对于溶析结晶,溶剂与反溶剂的选择至关重要。两者应互溶,并且共晶在混合溶剂中应具有较小的溶解性。因此需优化溶剂与反溶剂的比例,在没有溶剂化物生成的前提下保证收率。当共晶在混合溶剂中的溶解度显著低于纯溶剂时,可优先考虑溶析结晶。溶析结晶可在环境温度下进行,与蒸发结晶和冷却结晶相比能耗降低。
2.1.4平衡搅拌转晶
在一定温度下,将API、配体与共晶加入溶液中等温搅拌。若在该温度条件下共晶为稳定的平衡固相,则在打浆过程中API与配体不断溶解,使溶液过饱和度增加,析出共晶。即共晶的成核与生长消耗溶液过饱和度,与此同时API与配体溶解补偿溶液过饱和度。最终平衡固相只有共晶。打浆法操作简单,产品为纯共晶,有效避免API或配体的析出。通常打浆法需要较长的平衡搅拌时间,存在获得溶剂化物的风险。常运用打浆法进行共晶筛选。
2.1.5超声辅助
超声可降低成核诱导期,缩短介稳区,使溶液在低过饱和度自发成核。因此常将超声作为辅助手段运用于溶液结晶过程中,促进晶体成核。超声溶液结晶法可用于获得特定配比的共晶,也可应用于共晶筛选。
2.1.6超临界流体技术[2]
超临界流体技术是在超临界状态下,降低压力产生过饱和度,使固体从超临界溶液中结晶。超临界流体兼有液体与气体的性质,扩散系数大、黏度小、渗透性好、可更快地完成传质,达到平衡,促进高效分离。被用作超临界流体的物质有很多,CO2临界温度接近室温,临界压力易于实现,无色、无毒、无味、不易燃、化学惰性、价格便宜,易制成高纯度气体,在实验用有较多应用。目前已提出多种超临界技术,其中超临界快速膨胀(RESS)与反溶剂结晶(SAS)过程的研究较为深入,并在药物制备中拥有广泛的应用前景。
RESS法利用溶质的溶解度随超临界流体密度变化的特点,从超临界流体状态迅速膨胀到低温低压的气体状态,溶质溶解度急剧下降。即将API与配体溶解于超临界流体,并通过特制喷嘴快速膨胀,由于极短的时间内溶液过饱和度突然升高,使溶质大量成核。成品理化性质可由温度、压力、喷嘴口径、流体喷出速度等调节。目前RESS法以实验室规模的研究为主,主要集中于试验条件的摸索,对于机理性研究还不够完善,工业应用十分欠缺,过程放大设备还不成熟。
SAS法可以解决药物在超临界流体溶解性差的问题。并且该方法可连续生产,提高单位时间产率。其过程原理为:有些化合物可溶于有机溶剂,但不溶于超临界流体。高压下CO2等气体在大多数有机溶剂中溶解度高,当含药溶液和超临界流体同时喷入沉淀器时,两液体相互混合后溶剂体积迅速膨胀,溶液达到高过饱和状态,析出药物晶核。该方法的不足之处在于两溶液在极短的时间内很难达到均匀混合,溶液中局部过饱和度不一致使产品粒度不均一,并且容易造成团聚。SAS过程的文献报道仍以实验室与中试规模为主。由于固体物料的收集难以实现连续化,因此只出现过少量半连续生产的报道。
RESS与SAS过程在共晶制备中的应用举例如下。Padrela等[3]运用RESS法与SAS法制备吲哚美辛-糖精共晶。RESS法:在高压密闭容器中将API与配体溶解于超临界CO2中。将含药溶液由喷嘴减压喷出,超临界流体快速膨胀获得成品。SAS法将超临界CO2与含药溶液同时喷入沉淀室,溶液混合后快速膨胀获得晶体颗粒。试验结果表明RESS法未能获得共晶,SAS法成功制备吲哚美辛-糖精共晶。
2.1.7 喷雾干燥
喷雾干燥是将含药溶液由喷嘴快速喷出,形成的雾滴经过高温干燥气流被快速蒸干得到固体粉末。对于冷却结晶法难以制备共晶的物系,可考虑采用喷雾干燥技术。与超临界流体技术相比,喷雾干燥成本低,在实验室规模至生产规模均有应用。实验人员可用小试设备摸索参数,再评估放大可行性,降低生产风险。一般喷雾干燥溶媒为水溶液,若运用有机溶剂需做防爆处理,增加设备造价。此外喷雾干燥不适用于热敏性物系。
2.1.8 冷冻干燥
冷冻干燥是将一定浓度的含药溶液快速冷冻后减压,溶剂升华,析出共晶。由于溶剂升华过程产生极高的过饱和度,往往获得药物共晶的无定形。无定形通过保存或加热可重结晶为结晶态。冻干法工艺稳定性好,易于放大,收率高。但不适用于溶解性较差的物系。
2.1.9蒸气扩散
蒸气扩散通常用于单晶培养,也是一种较为罕见的共晶制备技术。一般药物在水中溶解度差,高湿条件下,水蒸气扩散进入药物溶液,使溶解度降低,产生过饱和度析出晶体。蒸气扩散的特点为溶液表面局部过饱和度缓慢升高,促进稳定晶型成核。该方法的关键在于良性溶剂与不良溶剂蒸气的选择,二者应可混溶,共晶在混合溶剂中溶解度应明显低于良性溶剂。制备不良溶剂蒸气能耗高、收率低,几乎无法应用于工业生产,适用于实验室规模共晶筛选。
2.1.10 高压均质
高压均质常被应用于食品工程,在制药领域是一项较为新颖的技术方法。过程包括机械能的注入与混悬液中颗粒的粉碎两个步骤。机械能可加速API与配体的相互作用生成共晶。在高压釜中将混悬液在一定温度下搅拌后由高压泵喷至均质机。减压与高速流动使混悬液颗粒充分混合形成共晶。为防止溶剂化物生成,可运用液态CO2作为混悬溶剂。液态CO2无毒、不易燃以及价格适中的特点使其作为绿色溶剂在减压过程中与成品颗粒分离。高压均质将共晶制备与粒度调控合二为一,无需对产品再次粉碎,减少能耗,提高收率。
2.2无溶剂型共晶制备技术
2.2.1 研磨
2.2.1.1干法研磨
研磨产生的机械能增强API与配体分子之间的相互作用形成共晶。研磨方式分为人工研磨与机械研磨。人工研磨重现性差,常用于实验室共晶制备。球磨机为机械研磨常用设备,在筒体内加入不锈钢、碳化钨或氧化锆小球使物料均匀混合,并增加机械能的输入,促进共晶的形成。目前研磨法制备共晶的机理尚不明确,但大体可分为三种:分子扩散、形成共融体与无定型重结晶。三种机理均存在各自的介稳态,分别为气态(分子扩散)、液态(共融体)与固态(无定型重结晶)。(1)分子扩散机理:当API或配体存在较高蒸气压时,反应物通过分子扩散的方式形成共晶,有时甚至不需要研磨。该过程类似于空气环境中亚稳晶型向稳定晶型转变机制。(2)共融体机理:研磨使两组分表面形成低熔点共融体,并进一步扩散形成液态介稳共融体。随后共融体重结晶形成共晶。(3)无定型重结晶:大多数药物分子间作用力强。在玻璃态转变温度以下研磨可获得无定型。室温放置或加热条件下无定型重结晶为结晶态化合物。
2.2.1.2湿法研磨
湿法研磨是在干法研磨的基础上加入少量的溶剂,诱导共晶成核。溶剂的加入增加体系的构象自由度与分子碰撞,从而更易成核。除此之外,湿法研磨在收率、结晶度以及共晶晶型可控性等方面存在优势。对于溶解性差的API,湿法研磨尤为适用。可可碱-丙二酸即为一典型案例。可可碱溶解性差,并易于析出单一组分,因此较难运用溶液结晶的方式制备共晶。然而将化学计量比的组分进行湿法研磨可获得可可碱-丙二酸共晶。湿法研磨运用少量溶剂,与溶液结晶法相比更为环保,并成本适中。但即使运用少量溶剂,也可能生成溶剂化物。
2.2.1.3添加聚合物研磨
研磨过程中添加固态或液态聚合物,可诱导共晶结晶。该方法与湿法研磨相比可避免溶剂化物的形成,并且聚合物可作为表面活性剂增加药物的溶出速率与生物利用度。选择的聚合物应与共晶具有生物相容性,否则需对混合物进行提纯。试验过程中应考察聚合物的添加量。若过多的添加聚合物,易造成结块、混合不均,并减少化合物之间的相互作用,导致API与配体的不完全键合。
2.2.2热熔挤出技术
热熔挤出是将API与配体加入挤出设备,在挤出机的机械作用与机筒外热量的作用下,使两物料熔融,随后对熔融态进行混合与分散,再由螺杆将物料挤出,经过冷却后形成共晶。热熔挤出设备如图2所示。
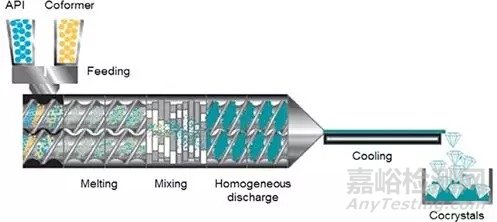
图2.热熔挤出设备制备共晶示意图[4]
挤出设备分为单螺旋与双螺旋两种。双螺旋挤出系统混合效果优于单螺旋系统,因此更适合共晶制备。Moradiya等[4]在135oC运用热熔挤出技术制备卡巴西平与肉桂酸共晶。单螺旋系统可提供足够的扭矩制备共晶,但由于搅拌不充分,成品结晶度较低。而双螺旋设备可成功制备共晶。应指出挤出温度影响共融体粘度与流动性。低温使共融体粘度降低,导致混合效果差,影响共晶结晶度。当选用高温混合时需适当控制温度以防止化合物降解。挤出温度对成品的影响如图3所示。
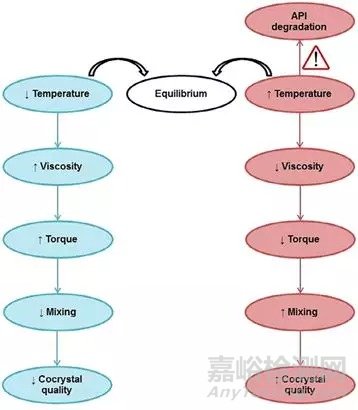
图3.热熔挤出过程温度影响的共晶质量以及选择最优挤压温度的重要性[4]
2.2.3 添加基质共结晶
基于热熔挤出法,在喂料前加入固态基质进行混合。在挤出过程中只有基质转变为液态,减少物料之间的剪切力,达到充分混合与粉碎的效果。在热能与机械能的作用下形成共晶与基质的混合物。基质可在一定程度上改善共晶的溶出速率、流动性与压实特性。
2.2.4 熔融结晶
熔融结晶不需要加入溶剂,将API与配体加热至熔融,随后缓慢冷却至室温获得共晶。该方法不会获得单一组分与溶剂化物。但熔融结晶过程缺少剪切力,混合效果不佳。通常需要对成品进行研磨,加强混合效果。研磨过程也可能出现无定形。
2.2.5 熔融喷雾
熔融喷雾技术是喷雾干燥与热熔挤出的结合。试验过程中将API与配体加热至熔融,喷雾获得小雾滴。雾滴经冷却气流降温形成共晶颗粒而得到分离。该方法无需溶剂,节约成本并避免溶剂化物的生成。与其他无溶剂共晶制备方法相比,熔融喷雾法可直接获得目标粒度分布与晶体形貌的成品,节省试验步骤,提高收率。该方法不适用于高温易降解物系。
2.2.6 微波诱导的结晶技术
微波诱导与旋转分子偶极矩增强分子活性与激发能。微波诱导的共晶结晶技术原理如图4所示。微波辐射诱导的介电能使API与配体分子达到饱和状态,在API与配体饱和区交界面处为共晶结晶区。介电能依赖于物料的介电性质,即将微波能转变为热能的能力。
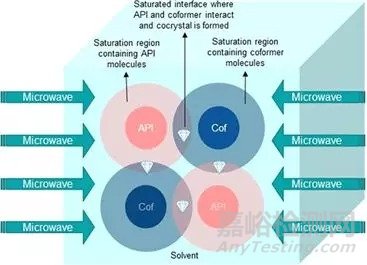
图4. 微波诱导的共晶饱和区示意图[5]
3、共晶筛选
共晶筛选应对配体种类、API与配体的配比以及结晶溶剂三个方面进行选择。筛选方法应简单高效。通常共晶筛选阶段只需获得少量成品,足够检测量即可。常用方法为平衡搅拌转晶、热方法以及研磨法。
平衡搅拌转晶是共晶筛选常用方法。该方法将过量物料加入溶液形成混悬液,打浆过程不稳定相溶解,提供过饱和度使稳定相成核与生长。可在搅拌过程中加入超声,促进亚稳相溶解与稳定相成核。平衡搅拌转晶法可通过改变配体种类与结晶溶剂,对API共晶进行广泛筛选。
热方法是一种高通量的共晶筛选方法,具有高效与物料消耗量少的特点。差式量热扫描法(DSC)为典型的热力学筛选方法。将少量API与配体混合后加入坩埚,升温至共融点,DSC曲线表现为出现吸热峰。继续加热出现放热峰,表明共晶重结晶,即完成共晶制备。若升温过程中出现单一组分的熔融峰与降解峰,不出现共融体吸热峰,意味选用的物料无法形成共晶。
研磨法操作简单,结晶效率高,为共晶筛选的普遍方法。可采用干法与湿法两种方式,通过改变配体与配比对药物共晶进行广泛筛选。
4、共晶生产工艺
放大生产常用的共晶制备方法有溶液结晶、喷雾干燥与热熔挤出。生产设备的类型与规模影响小试工艺的放大可行性。因此需根据小试数据对放大试验进行指导,对成品进行质量控制。在ICH质量体系框图中明确理想质量控制状态的实现,必须从质量源于设计(QbD)、质量风险管理以及药物质量体系三方面入手,即Q8、Q9与Q10的结合。其中Q8明确指出质量不是通过检验注入产品中,而是通过设计赋予。QbD理念贯穿于药品整个生命周期,对药品的研发、生产、工程、质量管理、上市、退市等进行系统与规范化的管理。实施QbD可分为产品理解、过程理解与过程控制三个步骤。FDA与EMA认为过程分析技术(PAT)可提高生产过程和药品的理解,提高对于药品生产过程的控制,在设计阶段就考虑产品质量的问题。[6]PAT技术是通过运用一系列工具结合生产中的周期性检测、关键质量参数的控制、原材料与中间体的质量控制以及生产过程确保最终产品达到标准的方式。即可认为PAT是完成QbD的工具。
目前在国际上使用的PAT技术包括过程分析仪器、过程控制工具、信息改善系统、知识管理系统等。可运用于检测结晶过程的PAT技术有傅立叶红外光谱(FTIR)、拉曼光谱、聚焦光束反射测量仪(FBRM)、粒子图像测量仪(PVM)等。以上PAT技术适用于溶液结晶过程,使用时将设备探头插入液面以下实现过程参数(如溶液浓度、晶型、晶体形貌、颗粒数与粒度分布)的在线监测,增强对共晶结晶过程的认识与理解,有利于过程参数的优化与工艺的放大。此外,PAT技术可替代共晶体系三元相图,为结晶工艺的开发节省时间与能耗。
药物共晶生产通过间歇、半连续以及连续结晶等手段实现。通常间歇结晶不同批次产品间在有关物质、溶剂残留、晶型、结晶度、粒度分布、晶体形貌等存在差异,从而影响后续制剂工艺。连续结晶与间歇结晶相比在产量、能耗、放大可行性、产品质量均一性等方面存在优势。Moradiya等[7]运用连续热熔挤压技术制备共晶,运用PAT技术监测过程,实现质量控制。工艺流程如图5所示。该套连续工艺生产能力为3000胶囊/小时。温度曲线、喂料速率与螺杆转速是影响共晶成品的主要参数。目前药物生产车间还是以间歇生产为主。连续生产在药物结晶尤其是在共晶领域的应用还较为少见。需继续寻求间歇生产向连续生产的转变。
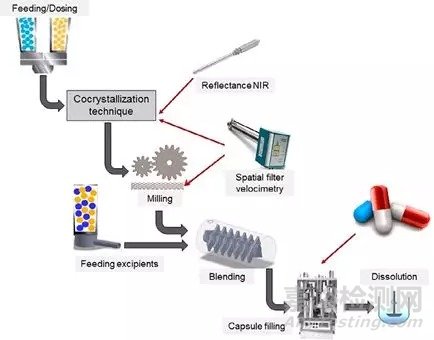
图5 PAT技术监测的连续共晶生产工艺[7]
5、结语
共晶使API分子在溶解度、溶出速率与生物利用度等性质得到改进而引起广泛关注。一般共晶存在较少的多晶型与溶剂化物,从而易于放大生产,并在运输与保存过程中保持较好的稳定性。目前对共晶的研究大多集中在两方面:共晶筛选与生产工艺开发。此外计算机分子模拟技术也可用于共晶筛选,并减少实验过程带来的损耗,节约成本。但出于结晶过程的复杂性,分子模拟不可能将结晶过程所有的参数考虑在内,因此具有一定的局限性。
本文介绍了多种共晶制备方法,每一种方法都存在其优缺点。需根据物系特性对制备方法进行选择。溶液结晶工艺简单,常被应用于共晶制备。但API、配体与共晶在溶剂中的溶解性与溶剂毒性约束该方法的使用。蒸发结晶适用于组分在溶剂中的溶解性无显著差别的物系。常用该方法进行共晶筛选。冷却结晶与溶析结晶适用于共晶的批生产。若物系的溶解度较低,可考虑打浆法与反应结晶法。冻干与喷雾干燥可运用于实验室与生产规模,直接制备共晶,不出现单一组分。非溶剂依赖型共晶制备方法,可有效避免溶剂化物的生成。研磨为常用方法,当加入少量溶剂作为传质溶媒时可加速共晶生成。热熔挤出可作为连续生产方法使用,但不适用于热敏性物料。
QbD强调药品生产过程的控制,在设计阶段确保产品质量。PAT技术是实现QbD的工具。提倡在药物共晶生产过程使用PAT技术在线监测物料性质与状态,合理并有效调控过程参数制备标准产品。
参考文献:
[1] R. Marisa et al., InternationalJournal of Pharmaceutics. 547, (2018), 404–420.
[2] 胡婷婷,纳微结构抗哮喘药物颗粒的可控制备及其干粉吸入剂研究. 北京化工大学, 博士研究生学位论文.
[3] Padrela, L., Rodrigues, M.A., Velaga, S.R., Matos, H.A.,de Azevedo, E.G., 2009.
Formation of indomethacin-saccharin cocrystals using supercritical fluidtechnology.
Eur. J. Pharm. Sci. 38, 9–17.
[4] Moradiya, H.G., Islam, M.T., Scoutaris, N., Halsey, S.A.,Chowdhry, B.Z., Douroumis, D., 2016. Continuous Manufacturing of high qualitypharmaceutical cocrystals in- tegrated with process analytical tools forin-line process control. Cryst. Growth Des. 16, 3425–3434.
[5] Pagire, S., Korde, S., Ambardekar, R., Deshmukh, S., Dash,R.C., Dhumal, R., Paradkar, A., 2013. Microwave assisted synthesis ofcaffeine/maleic acid co-crystals: the role of the dielectric andphysicochemical properties of the solvent. Crystengcomm 15, 3705–3710.
[6] FDA, Guidance for industry:PAT-A framework for innovative pharmaceutical development, manufacturing, andquality assurance, Rockville, September, 2004.
[7] Moradiya, H.G., Islam, M.T., Scoutaris, N., Halsey, S.A.,Chowdhry, B.Z., Douroumis, D., 2016. Continuous Manufacturing of high qualitypharmaceutical cocrystals in- tegrated with process analytical tools forin-line process control. Cryst. Growth Des. 16, 3425–3434.

来源:药渡


