您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-07-13 21:28
自乳化给药系统(SEDDS)是由药物、油相、表面活性剂、助表面活性剂形成的均一透明的液体或固体给药系统。利用自乳化给药系统,可以改善亲脂性药物的水溶性,从而提高药物的吸收和生物利用度。
自乳化给药系统相比于传统的乳液有一定的优势,该体系在胃肠道中可以迅速的乳化,生成粒径在100nm左右或小于100nm的细小乳滴。
口服给药后,当药物通过胃肠道时,自乳化给药系统可保持难溶性药物溶解在细小的油滴中。
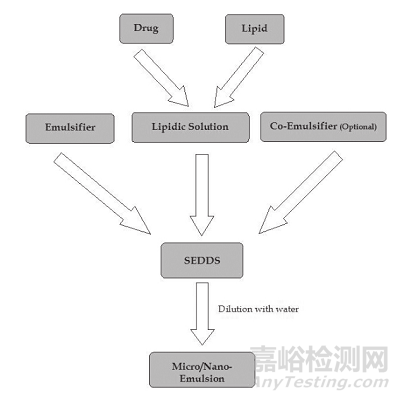
自乳化给药系统可通过促进药物在胃肠道中的溶解、增加药物通过肠道淋巴系统的转运以及绕过P-gp外流,从而增加药物在胃肠道中的吸收。

图1 SEDDS制备及转化为微/纳米乳流程
根据油脂、水溶性/水不溶性表面活性剂、亲水性助溶剂的相对比例,SEDDS可分为I、II、IIIA、IIIB和IV类,每类具体特征如下表所示。
|
成分 |
I |
II |
IIIA |
IIIB |
IV |
|
油脂 |
100% |
40%~80% |
40%~80% |
<20% |
/ |
|
水不溶性表面活性剂 |
/ |
20%~60% |
/ |
/ |
0%~20% |
|
水溶性表面活性剂 |
/ |
/ |
20%~40% |
20%~50% |
30%~80% |
|
亲水性助溶剂 |
/ |
/ |
0%~40% |
20%~50% |
0%~50% |
|
体系粒径大小(nm) |
较大 |
100~250 |
100~250 |
0~50 |
/ |
|
水分散性 |
重要性有限 |
溶剂容量不受影响 |
溶剂容量受到一定影响 |
相变显著,溶剂容量损失 |
/ |
|
优点 |
与胶囊相容性良好 |
分散时不损失溶剂容量 |
体系几乎透明,药物吸收不会经过消化 |
体系几乎透明,药物吸收不会经过消化 |
对多种药物都有很好的溶媒能力 |
|
缺点 |
除非药物亲脂性强,否则溶解能力很差 |
混浊水包油分散体 |
分散时可能损失溶剂容量;不易消化 |
分散时可能损失溶剂容量 |
分散时溶剂容量损失;可能无法消化 |
表1 SEDDS分类
辅料的选择
由于自乳化取决于油相与表面活性剂的性质,如表面活性剂的浓度、油相与表面活性剂的使用比例、自乳化反应温度,一般只有特定的药物-辅料组合才可以形成高效的自乳化给药系统。
因此,需要对处方前的溶解度和相图进行研究,以获得最佳配方。
另外辅料的一些性质,如刺激性、毒性、混溶性、化学稳定性、成本等都会对影响我们对辅料的选择。
(1)亲脂性成分
饱和度不同的长链和中链脂肪酸都可用于自乳化给药系统,根据它们在食品中的使用情况,可以认为口服给药是安全的。然而,它们只有溶解少量药物的能力,难以获得有效的自乳化体系,这限制了这些油的应用。
相反,改性或水解植物油表现出更高的药物溶解性,并可以通过与非离子表面活性剂结合形成良好的乳化体系。
脂质可以影响药物的一些性质,从而改善药物在肠液中的溶解度,保护药物免受酶降解,并形成脂蛋白,促进高亲脂性药物的淋巴转运。
脂链长度可能会影响难溶性药物的沉淀,例如分别使用长链脂肪酸(蓖麻油,油酸聚乙二醇甘油酯)与中链脂肪酸(月桂醇,Capryol 90)。
考察消炎痛的沉淀情况,含长链脂肪酸的自乳化给药系统在稀释后仍能维持药物的过饱和水平,而中链脂肪酸的自乳化给药系统稀释后产生沉淀。
(2)表面活性剂
如果想开发出性质稳定的自乳化给药系统,我们必须从多方面进行考虑,如HLB值、体内安全性以及表面活性剂所占的比例等。
表面活性剂本质上是两亲性的,可以溶解大量的疏水性药物,并且能够降低油水之间的表面张力,所以在自乳化给药系统中加入合适的表面活性剂是必要的。
通常表面活性剂的用量范围为30%~50%(w/w),此时可以形成稳定的自微乳。那么有人可能会问,如果在这个范围不能形成自微乳,那么可不可以提高表面活性剂的用量呢?
其实小编是不建议提高用量的,因为增加表面活性剂的用量可能会导致药品对胃肠道的刺激性。
与传统的人工合成表面活性剂相比,目前天然表面活性剂在安全性方面更受大家的青睐。
对于自乳化给药系统,高HLB值的非离子表面活性剂表现出更优良的性质,因为与离子表面活性剂相比,非离子表面活性剂的毒性相对更低。
选择表面活性剂时我们应该关注它的HLB值以及安全性。为了提高自乳化能力,我们一般选用高HLB值的表面活性剂,因为其具有高亲水性,可以快速的形成O/W液滴。
下面为一些常用的高HLB值的表面活性剂及其HLB值。
|
化学名 |
商品名 |
HLB值 |
|
聚氧乙烯月桂醚 |
Brij-30 |
9.7 |
|
辛酸癸酸聚乙二醇甘油酯 |
Labrasol |
14 |
|
聚氧乙烯失水山梨醇单油酸酯 |
Tween-80 |
15 |
|
聚氧乙烯蓖麻油 |
Cremophor-EL |
12~14 |
|
聚氧乙烯氢化蓖麻油 |
Cremophor RH40 |
13 |
表2 常用表面活性剂及其HLB值
(3)亲水性成分
即共溶剂,也叫助溶剂,包括亲水性表面活性剂与助表面活性剂,难溶性药物与加入的第三种物质在溶剂中形成可溶性分子间的络合物、缔合物或复盐等,以增加药物在溶剂中的溶解度,这“第三种物质”称为助溶剂。
助溶剂可溶于水,多为低分子化合物。亲水性成分的加入是自乳化给药系统溶解大量原料的必要条件。
助溶剂的介电常数与其相应的增溶性能之间可能存在一定的关系。
例如,油酸聚乙二醇甘油酯、单亚油酸甘油酯等非质子型助溶剂介电常数在2.9~3.7之间,表现出了较低的增溶能力,而丙二醇、二乙二醇单乙基醚、四甘醇、辛酸癸酸聚乙二醇甘油酯等质子型溶剂介电常数在8.1~32.0之间,其表现出相对较高的增溶性能。
制备技术
液体自乳化给药系统通常以液体的形式装入硬胶囊或者软胶囊中,因为自乳化给药系统中一些辅料并不是固体的,而是液体的。
由于固体口服制剂是我们首选的给药方式,随着技术的进步,自乳化给药系统也不在局限于硬胶囊或者软胶囊,而是具有了固体口服的给药方式,即固体自乳化给药系统(S-SEDDS)。
固体自乳化给药系统是一种具有自乳化特性的固体制剂,其重点是将液体或者半固体制剂转化为固体制剂,如粉末、颗粒或微球,然后将其装入胶囊、包装袋或者直接压片。
目前固化技术包括载体吸附、喷雾干燥、冷冻干燥、熔融造粒、热熔挤出等。
固体自乳化给药系统
尽管液体自乳化给药体系可以提高疏水性药物的口服吸收效果,但是仍有许多因素限制了其在商业化中的使用,如制剂的稳定性、药物在体内结晶和沉淀、低载药量、体内外相关性差以及制造价格昂贵,都限制了自乳化给药体系的商业化应用。
将液体制剂改良为固体制剂可以克服这些缺点,这就涉及到了使用固化的方法将自乳化给药系统转化为固体自乳化给药系统。
固体自乳化给药系统具有以下几点优势:
(1)延长胃滞留时间
通过固化自乳化给药系统,可以延长胃排空时间,从而增加药物在胃内的滞留时间,这样一来就延长了药物在胃内的溶解时间,有利于药物吸收。
(2)改善肠道溶解性
通过固化自乳化给药系统,可以改善药物的肠道溶解性。可通过稳定过饱和药物,不让其沉淀,以及调节可消化脂质的脂解,来改善药物的肠溶性。脂解产物的沉淀抑制作用和增溶效果改善了药物分子在肠道中的溶解性。
(3)改善药物渗透性
自乳化给药系统可以使用固态肠道渗透促进剂进行固化,如壳聚糖以及粘附性聚合物,从而促进药物对肠道上皮细胞的渗透性。
固体-自乳化给药系统的开发设计
(1)固化方法
不同的固化方法会使自乳化给药系统产生不同的理化性质,所以选择合适的固化方法是非常重要的。
液体-自乳化给药系统的固化方法主要取决于前体自乳化给药系统的形式。
固化主要有以下两种方法,即液体-自乳化给药系统辅料的固化,以及体外稳定体内自发乳化的分散自乳化给药系统。
液体-自乳化给药系统辅料的固化目的,就是制备固体-自乳化给药制剂,该制剂保留了包封脂质的自乳化特性。最常用的技术就是将其吸附在多孔的载体上,并使用聚合物固体载体进行熔融造粒。
预分散乳剂为口服递送SEDDS提供了一种替代方式。分散的SEDDS以固体载体通过喷雾干燥或冷冻干燥进行固化,产生具有复杂内部纳米结构的颗粒,与SEDDS相比,这种颗粒制剂更容易服用。
颗粒通过快速再乳化、快速消化、控制释放以及与特定的固体载体相互作用,药物的溶解及吸收得到改善。相比于冷冻干燥,喷雾干燥固化SEDDS产生的颗粒粒径更均匀性、颗粒流动性更好。
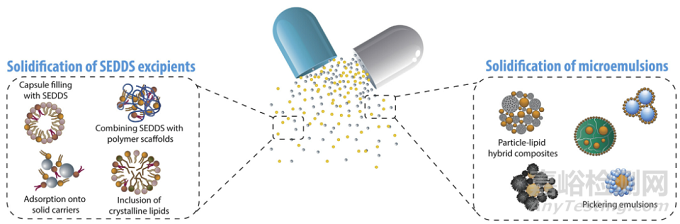
图2 固化的两种方法
(2)固化辅料
固化辅料对SEDDS的理化性质及药代动力学有着重要的影响,因此,选择合适的固化辅料尤为重要。
脂质-固体载体间的相互作用对脂质消化的影响:脂质水解是体内的一个基本反应过程,由于脂质的水解,可能会影响药物在胃肠道中的溶解度,从而产生沉淀。
通过添加吸附剂或者多孔载体,如交联多孔二氧化硅、镁铝硅酸盐、微孔硅酸钙等,可将液体SEDDS预浓缩物转移到固体上。
例如,含有低分子量肝素的SEDDS用微孔硅酸钙固化。
SEDDS制剂的表征
(1)相溶解度研究
对于相溶解度的研究,我们通常改变油相与表面活性剂/助表面活性剂混合物的比例,通常由1:9至9:1(w/w),在搅拌下向混合物中滴加水,直到形成清澈透明的微乳液。
(2)伪三元相图研究
我们通常使用水滴定法绘制油、表面活性剂/助表面活性剂和水的伪三元相图。在确定相图中的微乳液区域之后,我们可以选择相图上的组成比进行微乳的处方制备。
(3)分散性测试
应使用药典溶出的方法来测评SEDDS自乳化效率。通常在37±0.5℃下,将1ml制剂加入到500ml水中,50rpm转速浆法搅拌,从而评估制剂的体外性能。
(4)粒径以及电位
通常采用光散射技术来测量颗粒的粒径、Zeta电位和分子量。
(5)热力学稳定性研究
样品在4℃和45℃之间进行多次循环,通常是六次循环。然后将制剂以3500rpm/min离心30分钟。
随后是冻融循环,通常三次,温度在-21℃和25℃之间。所有处方在每个温度下保持时间不得不少于48小时,稳定性良好的样品继续进行后续的稀释试验。
(6)稀释试验
用各种溶解介质稀释稀SEDDS样品,放置12小时后不应产生相分离或药物沉淀现象。
总结
自乳化给药系统是一种有效增加药物溶解和吸收的技术,但同时也存在一些技术壁垒。
脂质能够溶解疏水性药物,不同的脂质也具有不同的增溶效果。一般情况下,中链脂肪酸比长链脂肪酸具有更好的增溶能力。
一些药物虽然是疏水性的,但是同时也不一定是亲脂性的,这类药物(熔点高,大于250℃,logP约为2)一般不适合自乳化给药系统。
一些自乳化给药系统,当用水稀释或者分散于胃肠道中时,会产生药物的沉淀,药物从自乳化给药体系中沉淀是由于药物的浓度超过了其平衡溶解的能力。
因此,了解影响载药量的原因、保持系统可经受水稀释的能力、将稀释系统中药物沉淀的风险降至最低,对于设计出让药物稳定输送的体系是至关重要的。
所以我们在设计处方时,要平衡药物增溶与稀释时产生药物沉淀的风险。应避免体系过于亲水,如果体系过于亲水,体系在体内分散过程中就会失去大量的溶剂。另一方面,我们应该尽量提高体系对药物的增溶能力,将制剂的增溶能力提高到远超过所需的药物浓度,有助于避免体内药物沉淀。

来源:铭研医药


