您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-09-12 09:53
摘 要 Abstract
《已上市化学药品药学变更研究技术指导原则(试行)》发布实施后,如何对已上市化学药品的药学变更进行分类和研究,成为行业内普遍关注的问题。变更制剂处方中的辅料是该指导原则中一个重要的章节,本文从变更辅料的种类、用量、技术等级、供应商、质量标准等5 个方面对如何进行变更分类进行归纳总结,对各项变更分类的研究工作进行了列表对比,说明了需要重点关注的事项,并结合审评工作实际补充了指导原则中未明确的部分内容。以帮助相关单位更好地理解指导原则,更科学地进行变更研究,也为监管机构提供参考,从而推动行业的发展。
After the publication and implementation of Technical Guideline for Making Post Approval Changes to Chemical Drug Products (Trial Implementation), how to classify and study post approval changes to chemicals becomes a common concern in the pharmaceutical industry, and changes to excipients in drug product formulation is an important chapter in this guideline. This paper summarizes how to classify changes to excipient type, excipient amount, item code or grade, supplier,and quality standard from a total of five aspects, compares tabularly the research work of each change classification, explains the matters needing attention, and supplements some contents not specified in the guideline in combination with the actual review work, which helps the relative parties better understand the guiding principles and conduct change research more scientifically, provides references for regulatory agencies, and then promotes the development of the industry.
关键词 Key words
已上市化学药品;药学变更;制剂处方中的辅料
chemicals marketed; pharmaceutical changes; excipients in drug production formulation
《已上市化学药品药学变更研究技术指导原则(试行)》[1] 为《药品注册管理办法》[2] 和《药品管理法》[3] 的配套文件,变更制剂处方中的辅料是《已上市化学药品药学变更研究技术指导原则(试行)》的一个重要的章节,内容复杂且与药品的安全、有效、质量可控性紧密相关。本文结合指导原则起草的思路,从变更辅料的种类、用量、技术等级、供应商、质量标准等5 个方面对如何进行变更分类进行归纳总结,对各项变更分类的研究工作进行了列表对比,说明了需要重点关注的事项,并结合审评工作实际补充了指导原则中未明确的部分内容。
1、变更分类的界定
1.1 变更辅料的种类
一般来说,变更辅料的种类属于重大变更,着色剂和矫味剂除外。改变着色剂、矫味剂的种类属于中等变更,减少着色剂、矫味剂的种类属于微小变更。
1.2 变更辅料的用量
本文对普通口服固体制剂、缓控释及肠溶制剂、非无菌半固体制剂三种剂型的辅料用量变更进行了分类。本指导原则未列举剂型的辅料用量变更(着色剂和矫味剂除外)均属于重大变更。
在进行变更分类时,为防止误差传递,处方中各辅料用量的变化应以原批准的处方(如关键临床试验批、BE 批)作为比较目标,而不是以微小变更或中等变更后的处方作为比较目标。
1.2.1 变更普通口服固体制剂的辅料用量
普通口服固体制剂辅料用量的变更分类,详见表1。
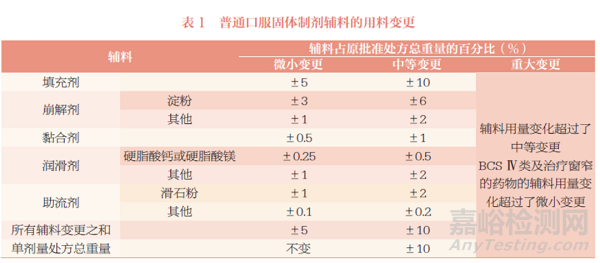
建议关注以下几点内容:①辅料用量的变化是以辅料占原批准处方总重量的百分比计算。②单剂量处方总重量指片芯总重量或胶囊内容物总重量,不计算薄膜包衣剂。③如同一种辅料在同一制剂中有两种不同的用途,如淀粉糊既为黏合剂又为崩解剂,应按照最严格的黏合剂进行分类,如微小变更范围为±0.5%,而不是±3%。④一般来说微小变更的单剂量处方总重量不变,如一种辅料增加2.5%,另一种辅料则需要减少2.5%,中等变更的单剂量处方总重量变化不超过10%。⑤ BCSⅣ类及治疗窗窄的药物的辅料用量变化超过微小变更,即为重大变更。
在实际工作中,还遇到了一些《已上市化学药品药学变更研究技术指导原则(试行)》中未明确的问题,建议相关单位可参考以下内容进行研究:①对于双层片的辅料变更以及采用内加和外加两种方式投料的辅料的变更,建议辅料的变化分别单独计算,例如,崩解剂交联羧甲基纤维素钠内加用量减少1.5%,外加用量增加1.5%,总的用量相当于变更3%,属于重大变更。②对于可能影响体内吸收的辅料如甘露醇、山梨醇及表面活性剂[ 如聚山梨酯-80(吐温80)、十二烷基硫酸钠] 等[4],建议每种辅料用量的变化不超过原批准处方中该辅料用量的5%、变更总和不超过5%,属于微小变更;每种辅料用量的变化不超过原批准处方中该辅料用量的10%、变更总和不超过10%,属于中等变更;此外,还需关注与其他辅料用量变化计算方式的不同。
1.2.2 变更缓控释及肠溶制剂的辅料用量
口服缓控释及肠溶制剂辅料用量的变更分类,详见表2。
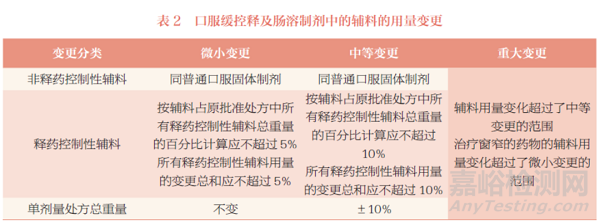
建议关注以下几点内容:①释药控制性辅料与非释药控制性辅料用量变化的计算方式不同,释药控制性辅料以辅料占原批准处方中所有释药控制性辅料总重量的百分比计算,非释药控制性辅料以辅料占原批准处方总重量的百分比计算。②一般来说微小变更的单剂量处方总重量不变,中等变更的单剂量处方总重量变化不超过10%。③治疗窗窄的药物的辅料用量变化超过了微小变更,即属于重大变更。
在实际工作中,还遇到了一些《已上市化学药品药学变更研究技术指导原则(试行)》中未明确的问题,建议参考如下内容进行研究:①以辅料占原批准处方总重量的百分比计算,所有辅料变化之和不超过5% 属于微小变更;所有辅料的变化之和不超过10% 属于中等变更。②肠溶制剂耐酸层辅料用量的变更,建议考虑其相对比表面积的比例[5]。
1.2.3 变更非无菌半固体制剂的辅料用量
非无菌半固体制剂辅料用量的变更分类,详见表3。
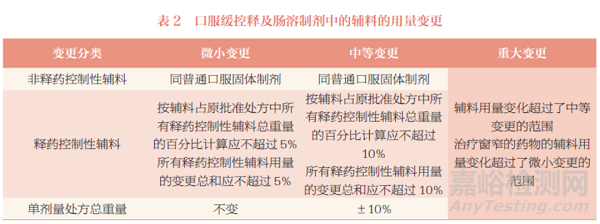
建议关注以下几点内容:①关注与其他剂型计算方式的不同,非无菌半固体制剂辅料用量变化以辅料占该辅料原批准用量的百分比计算。②防腐剂的变化单独计算,不计入变更量总和。
1.3 变更辅料的技术等级
辅料的技术等级主要与辅料的质量标准、杂质谱及在制剂中的用途等有关。如,用微晶纤维素PH200 替代微晶纤维素PH101,两者的粒度不同,可能会对制剂的质量或者生产过程产生一定的影响,属于变更技术等级。但是,用聚乙烯吡咯烷酮(PVP)K30 代替PVPK90,用聚乙二醇(PEG)400 代替PEG4000,辅料发生了实质性的变化,则属于辅料种类的变更。
变更辅料的技术等级一般来说属于中等变更,如为变更非无菌半固体制剂除基质以外的辅料的技术等级,则属于微小变更。《已上市化学药品药学变更研究技术指导原则(试行)》未列举剂型的技术等级的变更可结合剂型特点进行风险评估并参考执行。
1.4 变更辅料的供应商
变更辅料的供应商一般来说属于微小变更,前提是辅料技术等级不变,辅料的质量不降低。但是,变更非无菌半固体制剂单一化学实体(纯度≥ 95%)除外的基质供应商,则属于中等变更。变更纳入登记管理的辅料,如变更后的辅料尚未登记或登记状态为Ⅰ,按照重大变更管理。
1.5 变更辅料的质量标准
提高辅料的质量标准(如收紧质控限度)或者因《中国药典》版本或国家标准的更新或增补而变更标准,属于微小变更。其他变更情形(如删除不必要的检测项目)属于中等变更,前提是质量控制水平不降低。
2 研究验证工作
变更制剂处方中的辅料,需要进行的研究验证工作,详见表4。
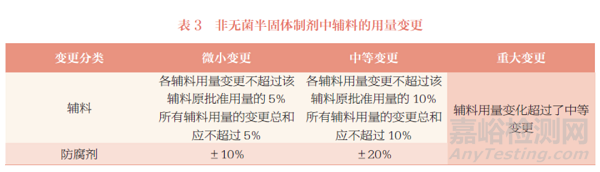
建议关注以下几点内容:①变更抑菌剂的种类、用量、技术等级,需进行抑菌效率试验,一般不需要进行生物等效性研究。②微小变更和中等变更变更前后样品的质量不一致,如在多种介质中变更前后样品的溶出曲线不相似,应按照重大变更申报补充申请。③部分变更可能需要增加稳定性研究批次和考察时间,如某些不稳定的药物。部分变更在充分评估的基础上,可能不需要针对变更进行稳定性研究,如变更某些辅料的质量标准。④提供稳定性研究资料的同时,应承诺按照稳定性研究方案考察长期稳定性并在年报中进行报告。⑤如果变更前的药品是按照质量和疗效与参比制剂一致的技术要求批准上市的,可以考虑与变更前药品进行药学对比研究。如变更前的药品不是按照质量和疗效与参比制剂一致的技术要求批准上市的,需结合变更前样品的质量状况等,综合考虑是否与参比制剂进行药学对比研究。⑥生物等效性研究通常建议选择与参比制剂进行对比研究,参比制剂应符合国家药品监督管理局的相关要求。⑦《已上市化学药品药学变更研究技术指导原则(试行)》中未列举剂型的处方中辅料变更的研究工作,可结合剂型特点并参考进行。
3 结 语
本文结合《已上市化学药品药学变更研究技术指导原则(试行)》从另外一个维度,通过变更分类的界定、研究验证工作两个方面对制剂处方中的辅料变更进行了解读,同时详细说明了需要重点关注的事项,以帮助相关单位更好地理解指导原则的内容。另外,本文对《已上市化学药品药学变更研究技术指导原则(试行)》未明确列出的部分内容进行了补充说明,如可能影响体内吸收的辅料的用量变更如何分类、双层片及内外加辅料的用量变更如何分类、对缓控释制剂及肠溶制剂的辅料变化总和如何管理、肠溶制剂耐酸层辅料用量的变更建议考虑其相对比表面积的比例等。希望本文能为相关单位进行变更研究及监管机构进行监管提供参考和借鉴。

来源:中国食品药品监管杂志


