您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2023-01-09 11:41
一次性使用腹部穿刺器(以下简称穿刺器)用在腹腔镜手术时穿刺人体腹壁组织,为操作手术器械提供通道。可重复使用的腹腔穿刺器、胸腔穿刺器等,也可参考本文适用部分内容。
依据《医疗器械分类目录》穿刺器管理类别为二类医疗器械,分类编码02-12-01。
一、穿刺器的工作原理及结构
常见的穿刺器有2种设计方式,一种是依靠穿刺套管的密封件和机械阀,维持气腹,其结构如下图1所示;一种是与专用的气腹系统配合使用,通过穿刺器内的微小压力喷嘴的再循环,以产生通常与患者的腹内压力相当的空气密封压力屏障保持稳定的气腹(如图2所示)。
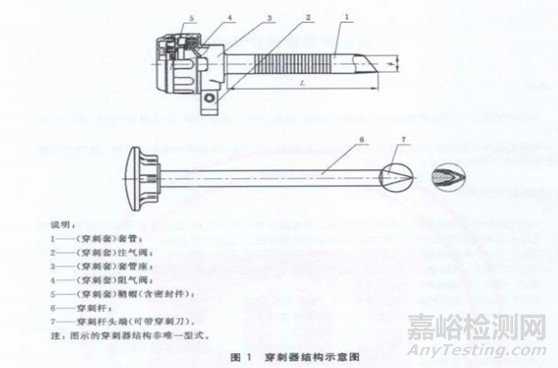
图1 穿刺器结构示意图

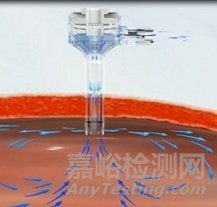
图2 非机械阀设计维持气腹的穿刺器
二、穿刺器性能研究实验要求
应当开展产品性能研究以及产品技术要求的研究,包括有效性、安全性指标的确定、明确所采用的标准或方法、采用的原因及理论基础等。
1、物理性能研究
表面粗糙度、硬度、耐腐蚀性:不锈钢材料制成的穿刺杆及穿刺杆头端带切割皮肤穿刺刀等情况适用。
灵活性,应对穿刺器部分组件的灵活性进行验证,如穿刺器的注气阀的开闭应灵活,确保在临床使用过程中气体通道的畅通性;可拆卸式的鞘帽应保证临床使用时装卸方便;穿刺杆的头端带穿刺刀的,穿刺刀既应有助于医者操作的便利性,又应保证正确使用情况下的安全性,可灵活回缩。
连接牢固性,各组合部件之间应具有一定的连接牢固度,确保穿刺器在使用过程中的稳定性,各连接件不应脱开、分离等。
阻气性能和密封性能:穿刺器应有良好的阻气性和密封性,确保产品在临床使用中可维持稳定的气腹。
配合性能,穿刺套与穿刺杆配合应良好,确保在正常使用过程中,可顺利刺穿组织,并保证气道的畅通性。
注气阀接口(若有),应确保其可通过管路与气腹机配合使用时可维持稳定的气体通道。
穿刺和插拔性能,穿刺器应具有一定大小的穿刺力,保证其可顺利刺穿腹壁组织;应对穿刺器的穿刺杆和标准大/小杆插入/拔出穿刺套管时所需的最大力进行研究,插拔力的大小决定了一定程度上产品的适用性。
透明尖端(若有)与内窥镜的配合性能,当内窥镜随穿刺杆进入腹腔进行探查时,穿刺杆的透明尖端不应影响内窥镜功能的发挥。
固定装置(若有)应确保在使用过程中,穿刺套管固定在皮肤切口处不发生移位、脱落等。
安全保护罩(穿刺杆头端带切割皮肤的穿刺刀,适用)应确保在工作状态下,穿刺刀尖端露出;在非工作状态时,其可挡住穿刺刀尖端的部分,避免对组织的意外刺伤。
若含特殊设计结构,应进行相应性能的研究。如穿刺器套管座含吸收液体的组件、采用空气密封压力屏障设计而非机械阀和密封圈阻气维持产品气密性的穿刺器。
2、化学性能研究
应对与患者接触部分聚合物材料的化学性能进行研究,如浸提液的浊度及色泽、还原物质、重金属含量、酸碱度、蒸发残渣、环氧乙烷残留量(如适用)。
对有涂层或吸收液体的组件进行与材料安全性相关的化学性能研究。
3、生物相容性评价研究
按GB/T 16886系列标准的规定要求进行评价,本产品为外部接入器械,与人体接触部位为组织,接触时间为不大于24h的短期接触,应评价的项目包括:细胞毒性、致敏反应、皮内反应。
4、灭菌工艺研究
4.1应明确灭菌工艺(方法和参数)及其选择依据,并附产品灭菌方法适宜性的实验报告,对灭菌方法可以使产品达到的无菌保证水平(SAL)进行灭菌确认,产品的无菌保证水平(SAL)应不低于1×10-6。
4.2残留毒性:若灭菌使用的方法容易出现残留,如环氧乙烷灭菌,应当明确残留物信息及采取的处理方法,并开展研究。
4.3若产品为辐照灭菌,应参照GB18280《医疗保健产品灭菌辐射》系列标准,开展灭菌研究,至少包括:灭菌剂量确认、辐照场剂量分布、包装与灭菌方法适宜性。
5、产品货架有效期和包装研究
5.1货架有效期
可参照《无源植入性医疗器械货架有效期注册申报资料指导原则》,按照产品实际情况执行。医疗器械货架有效期包括产品有效期和包装有效期,货架有效期的验证试验类型通常可分为加速稳定性试验和实时稳定性试验两类。
加速稳定性试验的具体要求可参考YY/T 0681系列标准或ASTM F1980。在进行加速稳定性试验研究时应注意:产品选择的环境条件的老化机制应与宣称的运输储存条件下真实发生的产品老化的机制相匹配。对于在加速稳定性试验研究中可能导致产品变性而不适于选择加速老化试验方法的,应以实时稳定性试验进行测定和验证。实时稳定性试验中,注册申请人应根据产品的实际生产、运输和储存情况确定适当的温度、湿度、光照等条件,在设定的时间间隔内对产品进行检测。
5.2包装及包装完整性:在有效期内以及运输储存条件下,保持包装完整性。应开展产品有效期内的包装验证和运输验证。产品包装验证可依据有关国内、国际标准进行(如GB/T 19633系列标准、ISO 11607系列标准、ASTMD-4169等)。
6、其他研究
穿刺器已列入《国家药监局关于发布免于进行临床评价医疗器械目录的通告》(以下简称《目录》,2021年第71号)中的免于进行临床评价医疗器械目录。对于符合《目录》中分类编码为02-12-01的腹腔镜穿刺器,开发人需将产品相关信息与《目录》所述内容进行对比,与已获准境内注册的《目录》中医疗器械进行对比。
三、穿刺器主要风险
已识别的风险应至少包括但不局限于以下方面:
1、原材料的生物学和化学危害
材料或材料来源变化
原材料纯度和可沥滤物
原材料的生物相容性
2、生产加工过程可能产生的危害
添加剂、助剂、辅剂的残留
生产环境洁净度
内毒素
3、产品使用风险因素:
气腹丧失
组织损伤
出血
切口疝
穿刺点感染
残留气体
穿刺器滑脱
4、灭菌过程可能产生的危害:
灭菌方式对产品不适宜,灭菌不完全等。
5、不正确使用产生的危害:
未按照说明书中操作方法操作,使用过程中损伤组织等;重复使用造成患者感染。
6、产品包装可能产生的危害:
包装破损、标识不清等。

来源:嘉峪检测网


