今日头条
济民可信BIC肾科创新药获批临床。济民可信旗下子公司上海济煜开发的创新化药JMKX003142片获FDA临床许可,拟开展多囊性肾病适应症的临床试验。临床前研究显示JMKX003142可剂量依赖性方式抑制LLC-PK1细胞的增殖,并抑制人源ADPKD肾囊泡细胞的体积变大,避免其他药物因Hook效应(高浓度反而促增殖)导致的副作用,具有全球同类最佳(BIC)潜力。
国内药讯
1.甲旁减激素替代疗法Ⅲ期临床积极。维昇药业从Ascendis公司引进的每日一次的长效甲状旁腺激素前药帕罗培特立帕肽在治疗甲状旁腺功能减退症的中国Ⅲ期临床(PaTHway China)完成双盲治疗期,即将进行主要终点分析。主要疗效终点为评估接受帕罗培特立帕肽治疗的甲旁减患者在停用常规钙和活性维生素D治疗时血清钙在正常范围(8.3-10.6mg/dL)的有效性。该药物已获FDA授予优先审评资格,预计4月30日完成审查。
2.广生堂新冠口服药最新研究数据积极。广生堂宣布3CL蛋白酶抑制剂新冠口服药GST-HG171(泰阿特韦)联合利托那韦(合称“泰中定”)在治疗新冠患者的临床试验(IIT)中完成全部受试者入组和临床观察。结果显示,泰中定治疗组中位转阴时间为8.4天,Paxlovid对照组中位转阴时间为9.5天,安慰剂组中位转阴时间为10.3天;临床中未发生严重不良事件、未发生导致停药的不良事件。
3.礼来Aβ单抗拟纳入突破性疗法。礼来Aβ单抗Donanemab注射液获CDE拟纳入突破性治疗药物,用于治疗早期症状性阿尔茨海默病,包括阿尔茨海默病所致的轻度认知障碍以及轻度阿尔茨海默病。donanemab在III期试验中达到所有主要终点和次要终点,与Aduhelm相比,donanemab在6个月时达到大脑淀粉样斑块清除的患者比例更高(37.9%vs1.6%),该组患者脑部淀粉样蛋白水平较基线降低了65.2%。
4.英矽智能IPF新药早期临床积极。英矽智能基于端到端人工智能平台发现的、潜在“First-in-class”特发性肺纤维化(IPF)候选药物INS018_055在新西兰I期临床中获积极数据。INS018_055在健康受试者中表现出良好的PK特征;研究期间并未产生死亡或严重不良事件(SAE)报告。所有治疗相关不良反应(AE)均为轻度。预计在2023年初启动针对IPF患者的Ⅱa期研究。
5.百吉自体T细胞疗法报新IND。百吉生物1类生物制品“BRG01注射液”的新适应症临床试验申请获CDE受理。BRG01是一款通过基因修饰技术将靶向EB病毒(EBV)抗原的受体表达于T细胞表面而制备成的自体T细胞免疫治疗产品。此前,已获得国家药监局临床默示许可,用于治疗经标准治疗后失败,且无有效治疗手段的末线复发/转移性EBV阳性鼻咽癌。
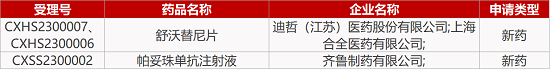
6.齐鲁「帕妥珠单抗」生物类似药报产。齐鲁制药帕妥珠单抗注射液的上市申请获受理,用于治疗HER2阳性乳腺癌。这是一款靶向表皮生长因子受体2(HER2)的重组化人源单抗,为国内首个申报上市的帕妥珠单抗生物类似药。该药物的原研药物为罗氏的帕捷特(Perjeta),已于2018年12月获批进口中国市场,联合曲妥珠单抗和化疗辅助治疗HER2阳性早期乳腺癌患者。
国际药讯
1.卫材Aβ抗体报sBLA。卫材与渤健合作开发的Aβ抗体Leqembi(lecanemab)已向FDA提交补充生物制剂上市申请(sBLA),寻求将加速批准转变为完全批准。Leqembi已在上周获得FDA加速批准上市,用于治疗阿尔茨海默病。在一项Ⅲ期临床中,与安慰剂组相比,Leqembi治疗组患者第18个月时评估患者认知和日常功能的综合评分CDR-SB的增加速度降低27%,淀粉样蛋白沉积水平降低约70%。
2.血友病基因疗法长期疗效积极。BioMarin公司开发的血友病A基因疗法Roctavian(valoctocogene roxaparvovec)Ⅲ期临床最新数据积极。valrox旨在通过单次输注表达凝血因子VIII的转基因,恢复VIII的产生,解决患者需要长期注射预防性凝血因子的需求。数据显示,与基线值相比,在治疗的第三年后,患者的平均年出血事件率减少了80%,而凝血因子VIII的使用减少了94%,而且有92%的患者还不需要预防性治疗。
3.诺和诺德双机制减肥药启动III期研究。诺和诺德由长效胰淀素类似物cagrilintide和GLP-1受体激动剂司美格鲁肽组成的复方制剂CagriSema注射液,在Clinicaltrials.gov网站上注册启动一项4000人规模的III期REDEFINE 3研究(NCT05669755),拟评估与司美格鲁肽(2.4mg)和安慰剂对比,每周1次、皮下注射的CagriSema(2.4mg)用于肥胖合并心血管疾病患者的心血管安全性。主要终点为CagriSema相较于安慰剂的首次发生主要不良心血管事件方面的时间。
4.DNA疫苗联合K药宫颈癌II期临床积极。Genexine公司DNA疫苗GX-188E联合PD-1帕博利珠单抗治疗人乳头瘤病毒(HPV)16阳性和/或HPV18阳性复发或转移性晚期宫颈癌患者的II期临床结果积极。结果显示,联合治疗的客观缓解率(ORR)为35.0%,疾病控制率(DCR)为57.0%。总生存期(OS)为16.7个月。帕博利珠单抗此前已获FDA批准,用于二线治疗PD-L1表达的宫颈癌患者。
5.痛风口服创新药启动Ⅱb期临床。珊顿医药(Shanton Pharma)拟降低尿酸盐的口服疗法SAP-001启动治疗难治性/痛风石性痛风患者的Ⅱb期临床(RID GOUT)。该项试验将进一步证实先前Ⅱa期研究中在高尿酸血症痛风患者中观察到的SAP-001的有效性和安全性。基于药物的临床数据,SAP-001有望成为(慢性)难治性/痛风石性痛风患者的潜在“best-in-class”疗法。
6.BioNTech与英国政府达成临床开发协议。BioNTech宣布已与英国政府签署一份协议,旨在到2030年底治疗多达10,000名癌症患者(包括临床试验和授权治疗),以加速mRNA免疫疗法的临床开发。根据协议,英国将分享其临床试验网络和“基因组学和健康数据资产”。BioNTech将在今年下半年招募第1例癌症患者。除了mRNA免疫疗法外,该交易还侧重于传染病疫苗和扩大BioNTech在英国的规模。
医药热点
1.河南省新冠感染率近9成。1月9日,河南省政府新闻办召开河南省统筹做好新冠病毒感染疫情防控工作新闻发布会。河南省卫健委主任阚全程介绍,从社区监测数据看,截至2023年1月6日,全省新冠病毒感染率为89.0%,其中城市89.1%、农村88.9%,现阶段流行毒株仍以奥密克戎BA.5.2变异株为主。从发热门诊数据看,河南省于2022年12月19日就诊人数达到高峰,之后呈现持续下降趋势。综合研判认为,河南省已顺利度过疫情高峰,实现平稳有序转段。
2.第十版新冠感染诊疗方案发布。1月6日,国家卫健委、国家中医药管理局联合发布《新型冠状病毒感染诊疗方案(试行第十版)》。新版诊疗方案重点修订内容主要包括:不再判定疑似病例,增加新冠病毒抗原检测阳性作为诊断标准,进一步优化临床分型,不再要求病例集中隔离收治,进一步完善治疗方法,调整出院标准,调整医疗机构内感染预防与控制等。
3.新冠患者住院费用全额保障。国家医保局、财政部、国家卫健委、国家疾控局联合印发《关于实施“乙类乙管”后优化新型冠状病毒感染患者治疗费用医疗保障相关政策的通知》。《通知》明确,对住院的新冠患者延续“乙类甲管”时的政策,全额保障新冠患者的住院费用。新冠患者在所有收治医疗机构发生的,符合卫生健康部门制定的新型冠状病毒感染诊疗方案的住院医疗费用,由基本医保、大病保险、医疗救助等按规定支付后,个人负担部分由财政给予补助。
评审动态
1. CDE新药受理情况(01月10日)
2. FDA新药获批情况(北美01月09日)