Surmodics宣布FDA批准其载药球囊---SurVeil上市,SurVeil可以用于治疗股动脉和腘动脉的新发或再狭窄病变。使用动脉血管直径为 4 -7 mm。
FDA之所以批准SurVeil上市,基于SurVeil与行业标杆美敦力的IN.PACT Admiral的头对头临床研究结果(SurVeil DCB TRANSCEND )强力支持。
SurVeil DCB TRANSCEND 研究结果
24 个月的临床试验结果证明了SurVeil安全性和有效性结果的持久耐用性。SurVeil 在显著降低的药物剂量下仍然不劣于美敦力的IN.PACT Admiral。
24个月时:接受 SurVeil治疗的受试者中有 81.8% 达到了次要安全终点,即在指数手术后30天内没有与器械和手术相关的死亡以及没有主要目标肢体截肢(脚踝以上)和临床驱动目标的综合血管再血管化 (CD-TVR) 对比 83.2% 的接受 IN.PACT Admiral治疗的受试者。
在该试验的两组中,不到15%的患者需要重复血运重建手术。IN.PACT Admiral组中的一名患者需要进行大腿截肢术。
SurVeil受试者的初级通畅率为 70.8%,而 IN.PACT Admiral 为 70.4%。
PI评价
“我很高兴Surveil将可用于治疗美国的患者,Surveil是根据TRANSCEND试验的结果确定的下一代DCB,这是与市场领先的DCB进行的唯一的头对头关键研究。Surveil 在治疗后两年以大幅降低的药物剂量成功证明了非劣效性安全性和有效性。”
---- Kenneth Rosenfield TRANSCEND临床试验的联合首席研究员
随着SurVeil上市,美国患者享受到下一代载药球囊救治,而且Surmodics也能够缓解资金压力。早前雅培获得SurVeil全球独家商业化权利,一旦SurVeil在美国上市,雅培需要支付约2700万美元里程碑奖金。3个月之前,由于FDA认定SurVeil注册资料不完善需要修改相关资料(这是FDA第二次不准许SurVeil注册,坊间传闻雅培都可以放弃SurVeil),同时有行业大环境比较差和自己两款核心产品SurVeil和Pounce商业化差,导致资金缺口越来越大,不得已裁员13%。
没想到FDA收到Surmodics整改资料后如此之快批准(比Surmodics预期快了半年),让年初裁员变得有点仓促。
SurVeil
SurVeil是一款低载药剂量的载药球囊,其负载药物和IN.PACT Admiral药物一样都是紫杉醇,区别在于两者载药量不同。IN.PACT Admiral DCB 的紫杉醇载药量(3.5 µg/mm²)比 SurVeil高 75%,后者的载药量为 2.0 µg/mm²。 SurVeil的设计旨在提供更均匀的药物分布、更高的药物转移效率以及更少的下游颗粒和下游栓塞。
SurVeil之所以在低载药量情况下实现与IN.PACT Admiral相同临床效果,主要是因为SurVeil采用了Surmodics专有的Bravo载药涂层技术。
Bravo是采用SynBiosys和urethan多嵌段共聚,并添加了丙交酯/乙醇酯/己内酯聚乙二醇等化合物。
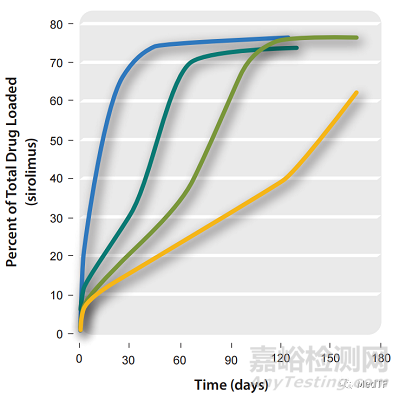
Bravo可以根据涂层中的聚合物比例实现药物释放速率,既可以突释也可以缓释。药物释放时间从几周到几个月,可以根据需要调节。
Bravo涂层在血液中主要通过水解方式降解,降解产物无毒副产物。可以通过正常的生理过程被代谢或排泄出体外。
Surmodics
Surmodics是用于体外诊断免疫测定测试和微阵列的血管内医疗器械和化学成分的表面改性技术的领先供应商。 Surmodics正在追求高度差异化的医疗设备开发和商业化,这些设备旨在满足未满足的临床需求并根据最苛刻的要求进行设计。Surmodics使命仍然是改善疾病的检测和治疗。