人工智能 (AI) 和机器学习 (ML) 在医疗保健领域的兴起重塑了该行业。
人工智能和机器学习带来了新的监管挑战。与传统医疗设备不同,这些技术能够随着时间的推移而发展和学习。
这意味着他们在现实世界中的表现可能与上市前测试期间的表现不同。虽然这可能意味着改善患者的预后,但它也可能带来需要管理的新风险。对于不断变化的算法来说,这不是一件容易的事。
超500项内容获批
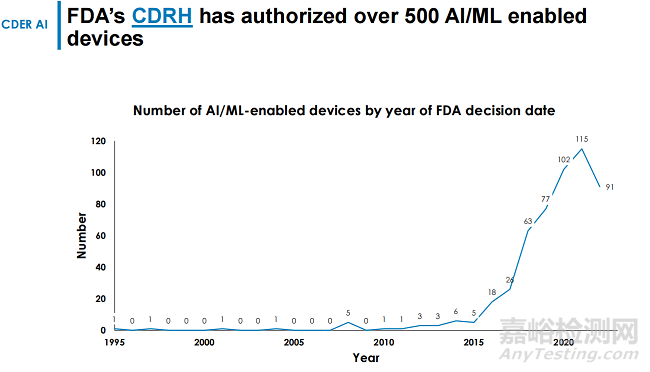
迄今为止,FDA已经批准了超过500项含有AI元素的器械和诊断产品,审批在2021年达到了顶峰,获批产品达到了115款。
从1995年开始,FDA一直在批准基于AI的设备,但最初并没有将它们区分为一个独特的类别。随着AI技术的逐渐成熟,FDA开始对基于AI的设备的定义分类和监管。
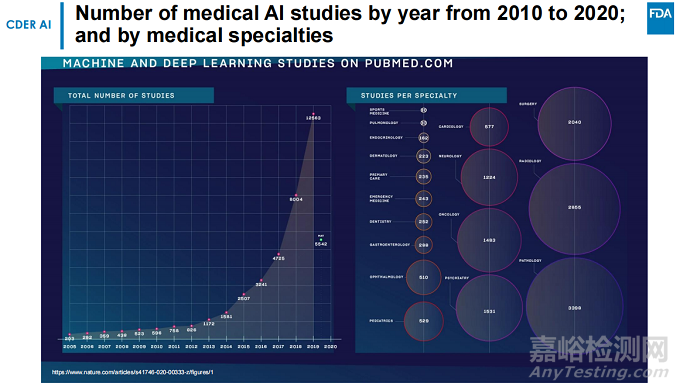
近年来有关AI的研究也在逐年增加,包括病理学、放射学、外科等领域,除此之外还包括肿瘤学、神经等。
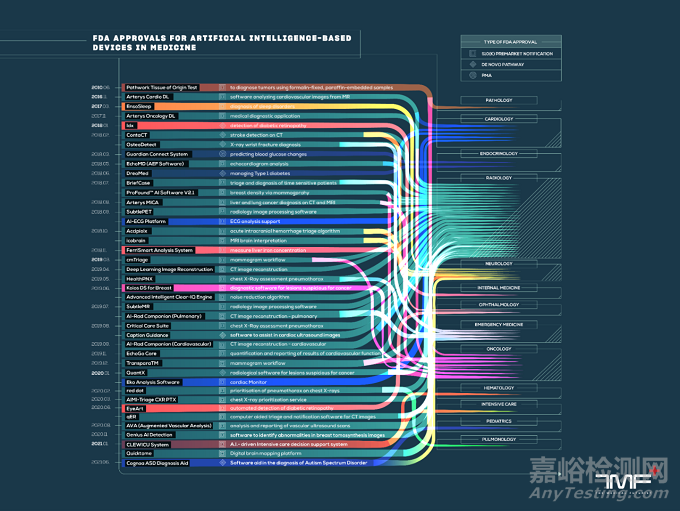
在批准数据方面,放射学领域获得最多,拥有多达392 种批准的设备。排在第二位的是心脏病学,有57台设备。除此之外,其他专业(骨科、麻醉学、病理学、眼科等)只能看到少数设备。主要原因还是放射学的数据量大,深度学习能够大有所为。
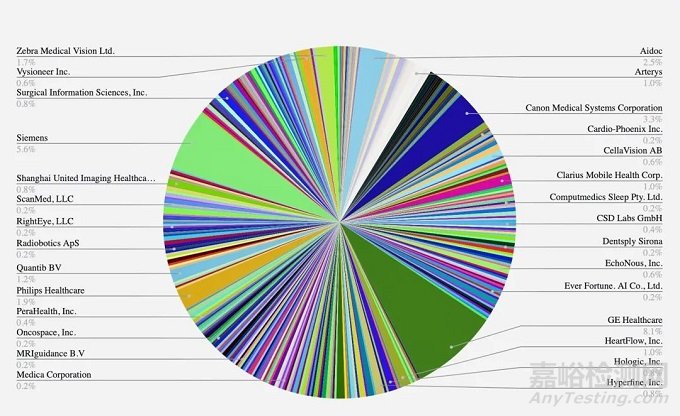
另外有公司拥有多项FDA许可,GE42款设备;西门子29款设备;佳能:17 款设备;Aidoc 13 款;飞利浦10 款设备;Zebra Medical Vision:9 款设备获得批准;上海联影医疗6款设备。
从批准方式来看,FDA在AI设备上主要承认三种不同类型:510(k)、上市前批准(Premarket approval)和De Novo认证(De novo pathway)。
510(k)的途径最简单(有可对比的上市产品),需要向FDA提供与一个或多个相似的合法销售的器械进行比较,并提出和支持他们的实质等同声明,不需要新的临床试验。
而De Novo认证则没有可对比的上市产品,企业需要提供且其有效性可通过一般或特殊过程取得保证的文件,一般用于低风险或中风险设备。
同时,上市前批准(Premarket approval)是最严格的设备上市申请流程。它适用于高风险设备,它要求制造商提供临床证据证明该设备的安全性和有效性。这通常涉及临床试验,这反过来又使其变得昂贵。
510(k)是医疗设备厂商最受欢迎的审批方式,获得500个批准,占比达96%而De Novo认证和上市前分别获得了18个和3个批准。
FDA批准的AI设备全景图:
监管的态度
CDRH也提到了 针对AI/ML用于医疗器械开发的指导原则,大致可以分为以下几个点。
利用多学科专业知识贯穿整个产品生命周期;
良好的软件工程和安全性,并且已经落实实践;
临床研究参与者和数据集是目标患者代表人口;
训练数据集独立于测试集;
选定的参考数据集基于最佳可用方法;
重点放在人类-人工智能团队性能上;
在临床相关条件下测试展示设备性能;
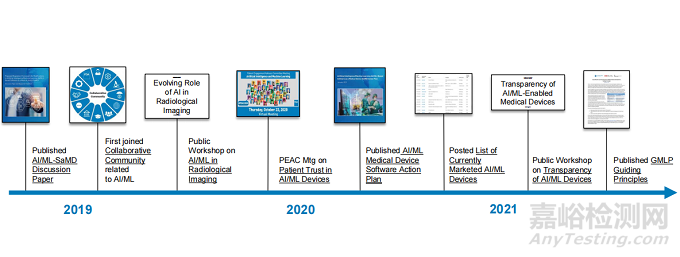
近年来CDER 与 CDRH、CBER 和其他中心就AI医疗设备问题也一直开展合作,CDER 于 2020 年成立了人工智能指导委员会,以促进有效在 CDER 的决策和运营中使用和维持人工智能,包括后续开展了研讨会、白皮书、讨论文件、协调和根据药物开发定制 GMLP等,其本质都是制定并采用灵活的基于风险的监管促进创新和保护患者安全。
参考链接:
《AI in Drug Development—CDER Office of Medical Policy》
https://medicalfuturist.com/the-current-state-of-521-fda-approved-ai-based-medical-devices/