摘 要 / Abstract
2022 年8 月23 日,世界卫生组织(WHO)宣布我国再次通过疫苗国家监管体系评估,为我国疫苗进入国际市场创造了良好的条件。疫苗作为控制传染病最行之有效的措施,WHO 及各国和地区都在积极提高疫苗接种率,以最经济有效的方式挽救更多生命。本文分析了疫苗国际市场采购数据及全球疫苗免疫联盟的需求预测,对比了我国国内市场数据与国际市场采购数据及通过WHO 资格预审的疫苗产品之间的差异性,并分析了我国疫苗进入国际市场的机遇。
On August 23, 2022, the World Health Organization (WHO) announced that China once again passed the evaluation of National Regulatory Authority for vaccines, creating favorable conditions for Chinese vaccines to enter the international market. As the most effective measure to control infectious diseases, vaccines are being actively promoted by the WHO and various countries to save more lives in a most cost-effective way. This article analyzes the data of vaccine procurement in the international market and the demand forecast by the Global Alliance for Vaccines and Immunization. It compares domestic market data with international procurement data and WHO-prequalified vaccine products, highlighting the opportunities that Chinese vaccine exports face in the international market.
关 键 词 / Key words
疫苗;资格预审(预认证);国际市场;疫苗监管体系
vaccines; pre-qualification; international market; vaccine regulatory system
1、背 景
世界卫生组织(World Health Organization,WHO)对国家监管体系(National Regulatory Authority,NRA)的疫苗质量管理体系的评估,是体现国家对疫苗监管能力的重要举措和有效手段,是一项全球范围内公认的、可以科学全面评估一个国家疫苗监管水平的国际考核。我国疫苗监管体系已于2011年、2014 年、2022 年先后三次通过评估,2022 年7 月迎来了WHO 升级评估标准后的新一轮全面评估。此次评估指标大幅增加、内容更加全面、标准更加严格。
我国通过NRA 评估,不仅意味着我国拥有稳定、运行良好且完整统一的监管体系,能确保在我国生产、进口或流通的疫苗质量可控、安全、有效, 也是我国疫苗出口全球的重要基础。WHO 将通过NRA 评估作为采购该国疫苗产品的前提,即只有通过NRA 评估,该国企业才能申请WHO 疫苗产品的资格预审,并列入联合国等国际组织采购清单。此外,通过NRA 评估也是其他国家注册和采购他国疫苗产品的重要参考[1]。
2、疫苗产品资格预审
2.1 资格预审目的及意义
WHO 的资格预审已经成为国际社会保证医药制品质量和安全的重要标准之一。多数国际资助机构都要求采购的药品经过WHO或者严格监管机构(Stringent Regulatory Authority,SRA)的认证。对于疫苗产品,全球疫苗免疫联盟(The Global Alliance for Vaccines and Immunisation,GAVI) 和联合国儿童基金会(United Nations International Children's Emergency Fund,UNICEF)只接受通过WHO 资格预审的疫苗[2]。我国疫苗想要进入国际市场,需经过WHO 的资格预审。
药品资格预审制度( Prequalification Team :medicines,PQTm)于2001 年建立, 现称为药品资格预审(Prequalification of Medicines Programme,PQ), 亦称为药品预认证,是指由WHO 牵头,由资格预审项目组负责具体任务,审核范围涵盖制剂、原料药以及药品检验实验室,并以资格预审药品目录为依托的联合国行动计划。该项目旨在通过对药品注册资料的评审、生产现场的检查和提高企业的药品生产及监管能力,在全球范围内提高患者对于亟待治疗和预防疾病药物的可及性,同时保障这些药品的质量[3]。
2.2 资格预审申请条件
申请WHO 资格预审的疫苗必须满足以下条件:① NRA 必须具备监管职能并持续保持该能力, 即NRA 必须通过WHO 对质量管理体系的评估和再评估。②资格预审的疫苗需要得到生产国和地区NRA 的批准。③相关疫苗的技术指南或科学建议已经以《 WHO 技术报告系列》(WHO Technical Report Series,TRS)的形式得到批准和公布,即资格预审疫苗的科学审评将以TRS 报告作为重要的科学依据。WHO对于急需的疫苗可以紧急起草相关技术指南。④ 提出申请的疫苗须为WHO 优先采购目录中列入的疫苗[4]。
2.3 资格预审程序
疫苗资格预审包括两种程序:常规程序和简化程序,其中,简化程序适用于通过SRA 批准的药物。截至目前,SRA 指定名单仅更新至2015 年10 月23 日,目前我国尚不在其中,简化程序还不适用于我国[5]。
WHO 对疫苗资格预审的常规程序:疫苗企业提出申请,WHO 给予受理或不受理的初步反馈;已获受理的申报单位向 WHO 提交产品摘要文件(product summary file,PSF),WHO 对文件进行科学审评;一旦PSF 被接受,WHO 将要求申报单位进行3~5 批疫苗样品的送检,该项检验由WHO 指定的合作实验室进行;当 PSF 评估和样品检验完成后,WHO 将组织对申报单位的生产现场进行GMP检查。在上述流程通过后,WHO会给联合国相关机构GAVI 和UNICEF 发送资格预审通过的确认信。在获得疫苗资格预审许可后,WHO 还会对生产企业进行持续追踪,包括产品和生产工艺的变更评价、资格预审通过后质量及安全性的监测等环节。通过资格预审的生产企业需每年向WHO 提供年度报告[4]。
3、全球免疫计划与疫苗市场分析
通过研究WHO 战略发展方向、市场需求预测和近几年市场采购量,可以进一步了解和提升各类疫苗全球市场未来的增长空间。
3.1 全球免疫计划
2005 年,WHO 与UNICEF共同起草了《2006~2015 年全球免疫远景与战略》,旨在提高疫苗接种覆盖率,降低死亡率和发病率,实现了首个10 年战略计划[6]。
2012 年,第六十五届世界卫生大会通过了“全球疫苗行动计划” 决议, 确定了2010~2020年充分实现免疫接种的10 年战略框架。该战略框架提出2015年和2020 年的具体目标,其中2020 年具体目标包括:至2018年消灭脊髓灰质炎至实现全球无脊髓灰质炎状态;在至少5 个WHO 区域内消除麻疹和风疹;国家免疫规划疫苗接种率达到90%,区域内达到80% ;在低收入和中等收入国家推出一种或更多新疫苗或未得到充分利用的疫苗等具体目标[7]。
WHO 在“全球疫苗行动计划”之后,又批准了针对特定疾病的具体目标,包括至2030 年使慢性乙型病毒性肝炎新病例减少95% ;媒介传播的乙型脑炎发病率降低至少60%,死亡率降低至少75% ;消除脑膜炎在各国和地区的流行;使因狂犬病而死亡的人数减少至零等具体目标[8]。
2019 年,随着“全球疫苗行动计划”接近尾声,WHO 免疫战略咨询专家组回顾了疫苗10 年的工作进展。在尚未实现的目标中,关于实现全球无脊髓灰质炎的工作仍然面临挑战,衍生的脊髓灰质炎病毒还在一些国家和地区传播;消除麻疹的目标虽然多国和地区已做了很多努力,但麻疹病毒依然在全球范围内进行传播,且接种第一剂麻疹疫苗的全球覆盖率约为86%,目前尚无法实现消除目标;关于2020 年至少5 个区域内消除风疹和先天性风疹综合征的目标目前也无法实现;在全球疫苗接种率方面,许多疫苗的覆盖率都有所提高,但尚未达到90% 覆盖率的目标[9]。
2020 年 8 月,第七十三届世界卫生大会采用书面默许程序,通过了 WHA73(9)号决定,其中批准了《2030 年免疫议程》。该议程提供了战略框架,以应对2021~2030 年初级卫生保健和全民健康覆盖范围内与免疫接种有关的关键问题[10]。
2021 年5 月14 日,WHO发布的《实施2030 年免疫议程:通过协调一致的计划、监测与评价、自主与问责以及沟通与宣传建立行动框架》中制定,3 个目标[11] 分别为:①预防疾病,挽救生命,降低死亡率和发生率。通过接种疫苗来减少疾病的死亡率,包括乙型肝炎疫苗、b 型流感嗜血杆菌疫苗、人乳头瘤病毒疫苗、乙型脑炎疫苗、麻疹疫苗、A 群脑膜炎疫苗、肺炎链球菌疫苗、轮状病毒疫苗、风疹疫苗、黄热病疫苗、白喉疫苗、破伤风疫苗、百日咳疫苗、卡介苗,至2030 年在全球范围内避免5000万人死亡;根除脊髓灰质炎,消除麻疹、风疹传播,作为公共卫生问题消除人乳头瘤病毒、孕产妇和新生儿破伤风、乙型肝炎,控制乙型脑炎;大规模或破坏性疫情的暴发呈下降趋势。②增加新疫苗和现有疫苗的公平使用,减少零剂接种儿童数量,至2030 年零剂接种儿童数量减少50%, 在低收入和中等收入国家引进新疫苗或未充分利用的疫苗,包括:出生首剂乙型肝炎疫苗、b 型流感嗜血杆菌疫苗、人乳头瘤病毒疫苗、第二剂灭活脊髓灰质炎疫苗、第二剂麻疹疫苗、肺炎球菌结合疫苗、轮状病毒疫苗、风疹疫苗、加强用百白破疫苗、新冠病毒疫苗、乙型脑炎疫苗、黄热病疫苗、A 群脑膜炎疫苗、多价脑膜炎疫苗、伤寒疫苗、霍乱疫苗、登革热疫苗、狂犬病疫苗、甲型肝炎疫苗、流感疫苗、水痘疫苗和腮腺炎疫苗。疟疾和其他相关疫苗在未来行动建议中可能会被列入。③为提高全球疫苗覆盖率,建立疫苗强化接种计划,至2030 年,第三剂百白破疫苗、第二剂麻疹疫苗、第三剂肺炎球菌结合疫苗和人乳头瘤病毒疫苗(完整系列)全球覆盖率达到90%。
3.2 疫苗资格预审优先级
WHO 为支持各国和地区免疫规划目标的实现,制定了疫苗资格预审的优先级,优先级共分为四级,包括高、中、低和非优先级,且每两年更新一次。UNICEF 和泛美卫生组织均采用优先级清单进行采购。该清单的制定原则主要包括联合国市场需求,适用于WHO 免疫规划需要,采用WHO免疫战略咨询专家组的建议和供应安全[12]。本文列举了WHO 网站公布的最新疫苗资格预审优先级清单(2018~2020 年),详见表1。
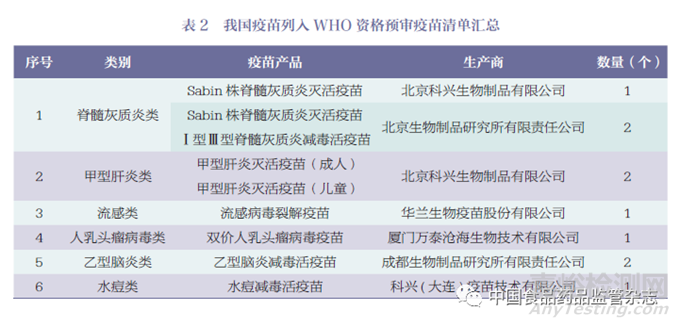
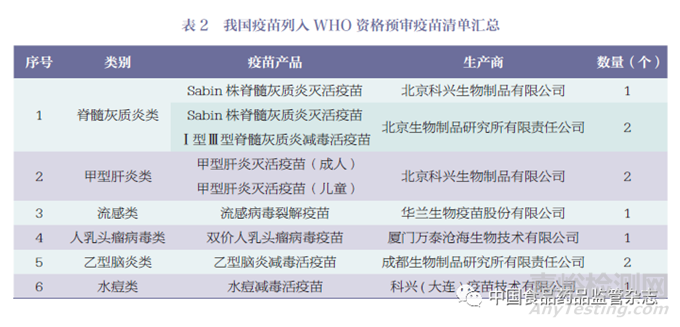
据WHO 官网显示[13],数据查询截至2023 年5 月15 日,列入资格预审疫苗清单的疫苗共计249 个疫苗产品,其中印度106个疫苗产品(占43%)、比利时21 个疫苗产品(占8%)、韩国21 个疫苗产品(占8%)位列榜单前三位,疫苗产品数量合计占比超过清单中总数量的59%。截至目前我国通过WHO 资格预审的仅有10 个疫苗产品(占4%)。主要国家和地区通过WHO 资格预审的疫苗数量情况如图1 所示。我国通过WHO 资格预审的疫苗产品,详见表2。
3.3 GAVI 基本需求预测
2021 年,GAVI 第五版疫苗基本需求预测, 涵盖了2021~2030 年GAVI 支持的74个国家和地区疫苗基本需求[14]。基本需求预测表,详见表3。
GAVI 基本需求预测表中共有12 种疫苗,其中肺炎球菌结合疫苗、人乳头瘤病毒疫苗、麻疹-风疹疫苗、灭活脊髓灰质炎疫苗、轮状病毒疫苗、伤寒结合疫苗和黄热病疫苗均属于高优先级疫苗,麻疹疫苗属于中优先级疫苗。高、中优先级疫苗在GAVI 基本需求预测表中占2/3,说明WHO 通过免疫规划目标所提出的高、中优先级可以反映市场采购量需求,此类疫苗未来的市场值得关注。
在上述预测表中,2021~2030年,肺炎球菌结合疫苗每年保持2 亿多剂的市场需求,共计需求21 亿多剂;麻疹- 风疹疫苗每年需求量虽有起伏,但预测总计在23 亿多剂;与麻疹-风疹疫苗相比,麻疹疫苗的需求量相对较少,近5.9 亿剂;轮状病毒疫苗需求量呈上升趋势,共计17 亿多剂;人乳头瘤病毒疫苗需求量整体趋势向上,共计4.7 亿多剂;根除脊髓灰质炎一直是WHO 及各国和地区努力的方向,灭活脊髓灰质炎疫苗需求量约为8.1 亿剂,需求量虽高,但根据预测情况2024 年开始呈下降趋势;伤寒结合疫苗在2026 年需求量达到最大,共计8.5 亿多剂;A 群脑膜炎球菌疫苗和黄热病疫苗需求量分别为3.1 亿多剂和7.3 亿多剂。
除此之外,未列入WHO 高、中优先级的疫苗品种,六联疫苗在2024 年需求量开始增长;百白破- 乙型肝炎-b 型流感嗜血杆菌联合疫苗虽未在高、中优先级,但10 年需求量在20 亿多剂;乙型脑炎疫苗虽属于低优先级,需求量也在4.7 亿多剂。
3.4全球疫苗市场采购分析
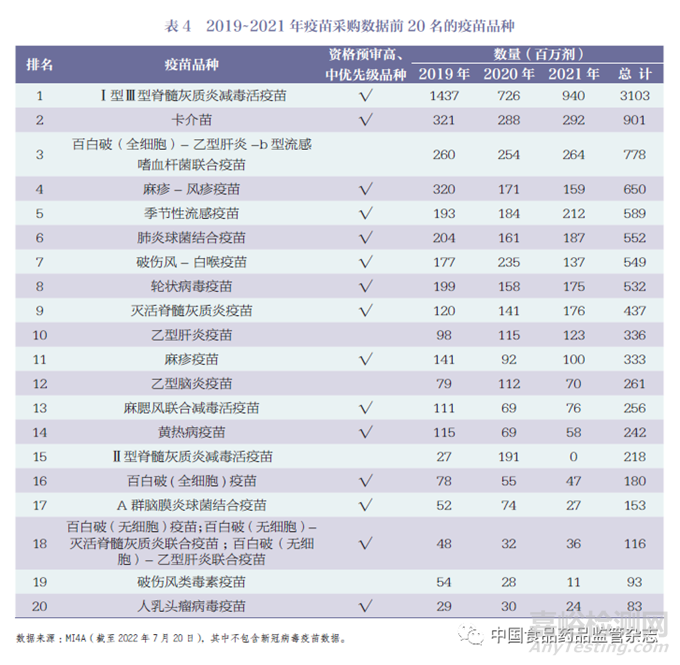
WHO MI4A(Market Information for Access) 发布的疫苗采购数据包含150 多个国家和地区通过WHO、UNICEF报告的疫苗采购信息,数据显示2019~2021 年疫苗采购前20 名疫苗产品,详见表4[15]。
通过采购数据分析, Ⅰ型Ⅲ型脊髓灰质炎减毒活疫苗、卡介苗和百白破(全细胞)- 乙型肝炎-b 型流感嗜血杆菌联合疫苗为采购量前三的疫苗品种。采购量前20 名中属于高、中优先级的产品共有15 种,占75%,由此可见,WHO 资格预审疫苗的优先级顺序同时反映了市场需求。
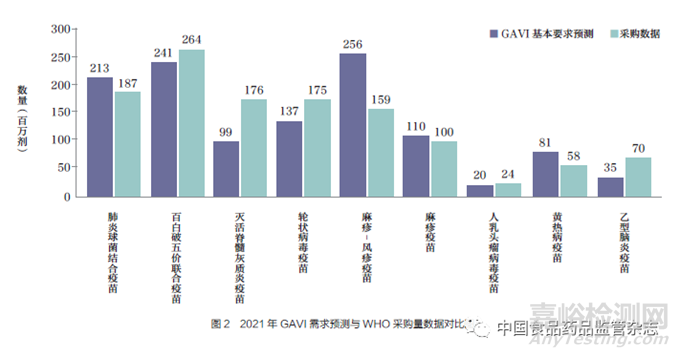
对比WHO 实际采购的疫苗产品与GAVI 基本需求预测表中的疫苗类型,需求预测表的12 种疫苗产品中共有9 种位于采购量的前20 名。以2021 年为例,百白破( 全细胞)- 乙型肝炎-b 型流感嗜血杆菌疫苗(百白破五价联合疫苗)、肺炎球菌结合疫苗、麻疹疫苗和人乳头瘤病毒疫苗这4 类疫苗的需求量和采购数据基本一致。轮状病毒疫苗、灭活脊髓灰质炎疫苗和乙型脑炎疫苗实际采购量比预测量增加, 相反麻疹- 风疹疫苗和黄热病疫苗的采购量未达到预期,如图2所示。
除此之外,根据WHO 的建议,麻疹- 风疹疫苗和麻腮风联合减毒活疫苗在常规免疫计划将逐步取代单价麻疹疫苗,未来单价麻疹疫苗的市场预计将减少[16]。关于人乳头瘤病毒疫苗,2020 年,世界卫生大会宣布了加速消除宫颈癌全球战略。在未来10 年内,将在低收入和中等收入国家和地区进行大量投资,并改进免疫规划活动,实现90% 的覆盖率目标。人乳头瘤病毒疫苗在获得首次上市许可后的第16 年,WHO的60% 成员国已将人乳头瘤病毒疫苗纳入了国家常规免疫计划[17]。由此推断,未来人乳头瘤病毒疫苗市场将会有较大增长。
新冠病毒疫苗作为2021 年和2022 年市场上的重要疫苗产品,根据WHO 成员国报告的新冠病毒疫苗采购数据中可以看出,2021 年采购了18 亿剂、2022年共采购46 亿剂[18]。
4、我国疫苗市场分析及机遇
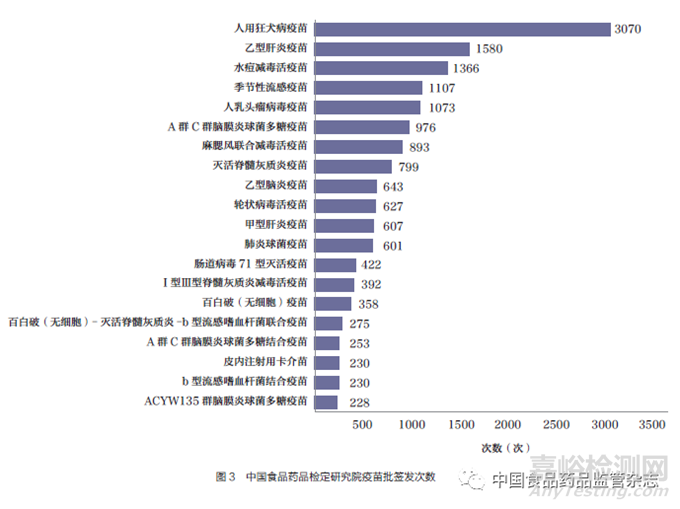
根据中国食品药品检定研究院在网站上公示的批签发疫苗数据(数据查询截至2023 年5 月15日),2020 年1 月6 日~2023 年5 月7 日公布的批签发次数中前5项分别为人用狂犬病疫苗、乙型肝炎疫苗、水痘减毒活疫苗、季节性流感疫苗和人乳头瘤病毒疫苗[19],如图3 所示。
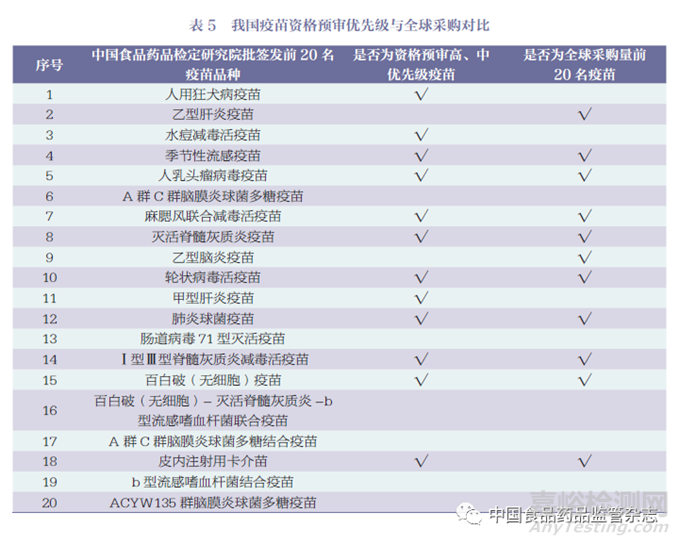
将中国食品药品检定研究院批签发前20 名疫苗与全球采购数据及WHO 资格预审高、中优先级疫苗进行比对,结果表明季节性流感疫苗、麻腮风联合减毒活疫苗、人乳头瘤病毒疫苗、灭活脊髓灰质炎疫苗、轮状病毒活疫苗、肺炎球菌疫苗、百白破(无细胞)疫苗、Ⅰ型Ⅲ型脊髓灰质炎减毒活疫苗和皮内注射用卡介苗等均属于高、中优先级疫苗,且均位列全球采购量前20 名,说明我国市场成熟疫苗在国际市场也具有巨大发展空间,值得我国疫苗生产企业的关注,详见表5。
根据国家药监局网站上公布的信息显示(数据查询截至2023年5 月15 日),我国已注册的疫苗共327 个产品,但通过资格预审的疫苗仅有10 个产品。我国是全球疫苗企业最多的疫苗生产国,国家药监局网站显示获得注册的疫苗产品共涉及50 余家疫苗相关生产企业,是全球为数不多的能够依靠自身能力解决全部计划免疫疫苗的国家和地区之一,应有能力面对更加广阔的国际市场。提高我国疫苗在国际市场的占有率,需要我国疫苗生产企业付出更多的努力[20]。
2019 年12 月1 日,《疫苗管理法》正式实施,第九十八条规定:“国家鼓励疫苗生产企业按照国际采购要求生产、出口疫苗。出口的疫苗应当符合进口国(地区)的标准或者合同要求”[21]。如今,我国疫苗监管体系再次通过NRA 评估,我国疫苗国际化也面临前所未有的机遇。在进一步优化疫苗产业链供应链的关键环节方面,建议可通过借鉴先进的NRA 监管经验,例如建立“仅供出口”疫苗审评审批的独立专用通道[22],必将加速畅通我国疫苗出口路径,激励我国更多企业依靠其产能优势走出国门。随着我国疫苗供应链服务的不断完善和质量提升,可以更快地为全球更多的国家和地区提供安全、有效、质量可控的疫苗。疫苗作为公共产品将更好地助力全球公共健康事业的发展。