近年来,小核酸药物成为生物制药企业的研发热点,小核酸药物专指靶向作用于RNA或蛋白质的一类寡核苷酸分子,包括反义寡核苷酸(ASO)、siRNA、aptamer等。截至目前,我国已上市的小核酸药物总共有两款,一款为诺西那生钠(spinraza)全球首个用于治疗儿童和成人脊髓性肌萎缩症(SMA,致命性遗传病)的新药,2019年spinraza在中国获批;另外一款为乐可为(leqvio),是一款长效降脂药,2023年08月在中国获批;这两款药均是进口至中国。通过查询CDE得知,诺西那生钠和乐可为的注册分类属于化学药5.1类。
虽然小核酸药物是按照化学药物申报,那么小核酸药物的研究要点有哪些?下面从序列设计思路、单体合成、序列合成、质量控制、递送系统等五个方面进行讨论。
序列设计思路
小核酸药物的序列是药物的核心,序列的设计也是重中之重的任务,下面我们来粗略地探讨下序列设计的思路。
首先需要确定ASO的基本需求,确定是属于招募RNase-H还是不招募RNase-H;根据文献得知,ASO的作用机制主要分为两类,一类为招募RNase-H,另一类是不招募RNase-H;在ASO与目标RNA结合后,通过招募RNase-H的机制主要是利用RNase-H,切割ASO-mRNA,使mRNA被裂解;而另一类不招募RNase-H的作用机制,主要是通过ASO与mRNA紧密结合,使得mRNA抑制翻译和转录,作用机制见下图1;了解了我们的目标机制,我们还需要了解目标对象是什么?目标基因是什么-外显子,间隔子还是其他?
第二步:设计8~10个ASO序列,在设计ASO序列时,需要考虑的因素:①确定某些序列是否会加强或减弱ASO的活性;②G/C的含量:大于55%的G/C的含量会增强ASO的结合力;③可以通过计算模型来设计ASO;④确保序列能够识别的是唯一基因;理想的ASO是有大于3个碱基与其他基因无法匹配;
第三步:确保是否可以购买到合适的单体用于制备ASO;比如:对于需要招募RNase-H,可以采用PS修饰;对于不需要招募RNase-H,可以采用PS修饰或PMO修饰;对于招募RNase-H机制,可以对前5个和后5个碱基进行2'位置进行修饰,对于非招募RNase-H的药物,可以对所有碱基进行2'位置进行修饰;
第四步:通过适当的体外细胞研究,筛选8~10个ASO;确保基因能够在细胞中被表达;使用6~200nM浓度的ASO进行实验,收集24h的mRNA并分析它的有效性,选择4~5个有效的ASO进行体内实验;
第五步:在体内模型筛选合适的ASO,确保目标ASO能够在小鼠/小鼠细胞中表达;
第六步:选择最佳的ASO进行药效研究,确定ASO的有效剂量。
图1 ASO的作用机制[1]
序列设计思路[1]
合成过程的研发要点
核苷单体合成的要点
小核酸药物的关键原料为核苷单体,如图2所示,DNA的亚磷酰胺单体主要是由碱基、脱氧核糖、5'-DMT和3'端的2-氰乙基以及二异丙胺基组成;而RNA的亚磷酰胺单体在DNA的亚磷酰胺单体的基础上,需要对2'-OH进行保护,该保护基团一般为TBDMS(叔丁基二甲基硅基);此外,由于腺嘌呤,鸟嘌呤和胞嘧啶上存在伯胺基,因此也需要一定的基团保护,通常用作这些氨基保护基的是酰基如苯甲酰基(Bz),乙酰基(Ac),异丁酰基等;然而,对于该步骤中,最关键的
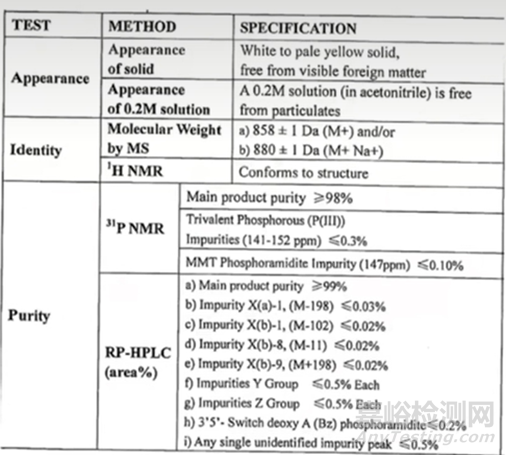
主要有三个,第一个是进行必要的化学修饰,采用何种化学修饰将会影响最终的核酸药物的成药性、以及药物的酶抗性;目前常见的修饰方法主要有,磷酸骨架的修饰(比如PS)、2'位羟基核糖的修饰(比如:2’-O-甲基修饰,2’-O-甲氧乙基修饰(2’-MOE),氟(F)等取代),核糖五元环骨架修饰(比如:LNA,PMO等);第二个关键点:核苷单体的质量控制,由于核苷单体合成技术环节众多,同时核苷单体经过各种修饰,结构也变得更加复杂多变,杂质团的种类也变得更加繁多,因此在质量控制上也是具有极大的挑战;通常情况下,亚磷酰胺单体的纯度要求一般≥99.0%,下图3是某单体质量要求的质量标准要求;第三个关键点:由于市场目前处于早期,要使单体投入生产领域其成本较高,特别是要想获得比较大的生产量,也是较大的挑战之一。
图2 亚磷酰胺单体结构式[2]
图3 单体的检测质量标准[3]
序列合成的挑战
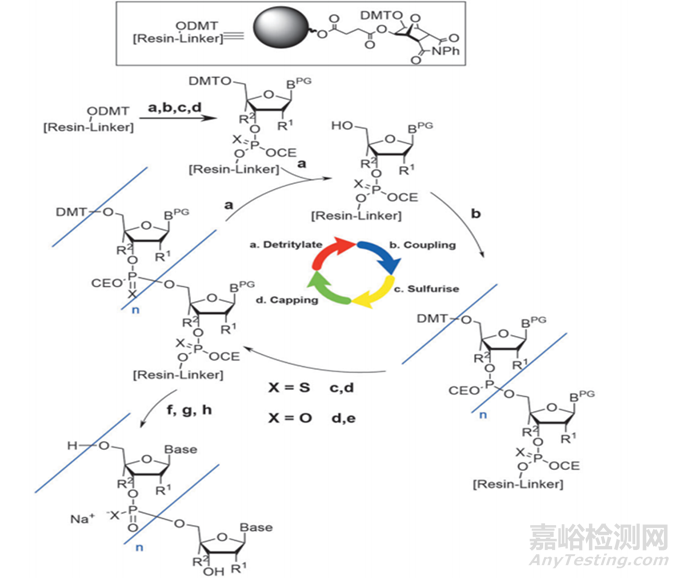
单体合成后,需要进行下一步,对其序列进行合成纯化,工业上合成纯化方法主要包括:化学合成法、RNA酶解法、微生物发酵法及生物催化法,其中化学合成主要方法又包括反相色谱法(固相合成—反相色谱纯化—脱三苯甲基化—乙醇沉淀法等—冻干)、离子交换层析法(固相合成—离子交换层析—浓缩/深层过滤—冻干)、疏水层析结合离子交换层析(固相合成—疏水层析—脱三苯甲基化—离子交换—UF/DF—原料药溶液);目前已上市的核酸药物大多采用化学合成法中反向色谱法和离子交换层析法,该方法的具体步骤包括去DMT(脱三苯甲基)保护、偶联、氧化、加帽,循环(见下图4)达到所需要的序列长度后,再进行裂解和脱保护(Cleavage and Deprotection,C&D),最终得到我们所需要的序列;然而,在这一过程中,若工艺参数控制不好很有可能会产生一系列的杂质,包括产生N-X序列如N-1,N+X的序列(longmer sequences)如N+G,硫代磷酸酯键(PS)产生的非对映异构体和氧化产生PO杂质,胞嘧啶和5-甲基胞嘧啶脱氨基引起的杂质,其他杂质如碱基脱嘌呤杂质,2'-5'连接异构杂质,序列异构体等。
图4 寡核苷酸合成路线图[4]
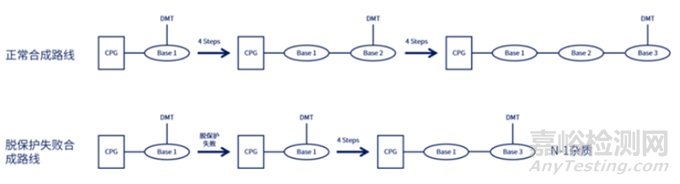
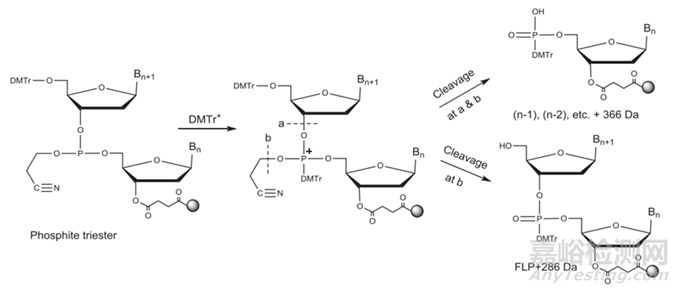
N-X序列(shortmer sequences),如N-1的产生主要原因包括:①脱保护时间的长短,以及脱保护剂的酸碱性,脱保护反应时间不够/脱保护剂酸性太弱会产生N-1杂质;而脱保护时间又取决于流速和柱子的尺寸;②空间位阻导致脱保护剂脱离效率低产生N-1的杂质;
N+X的序列(longmer sequences),如N+G,N+A的产生主要原因包括:①脱保护试剂冲洗不干净导致N+1杂质的产生;②亚磷酰胺单体自身形成二聚体,然后与5'-OH反应;③新加入的亚磷酰胺单体被偶联两次;
硫代磷酸酯键(PS)产生的非对映异构体和氧化产生PO杂质主要原因:在氧化过程中,使用的氧化试剂可以将已形成的PS键氧化为PO键;
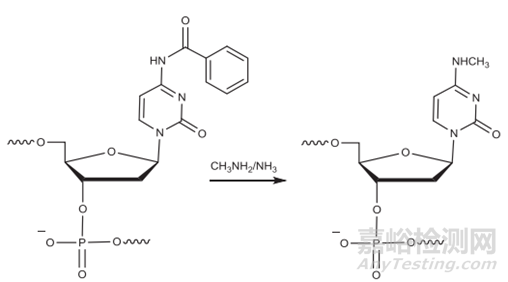
胞嘧啶和5-甲基胞嘧啶脱氨基引起的杂质:在断裂和脱保护过程中,甲胺与胞苷残基(被苯甲酰基保护)反应形成N-4-甲基胞苷杂质。
由此可见,序列合成过程中主要有以下几个关键要点,第一:合成工艺,工艺参数以及试剂的质量将会影响药物的质量,比如:柱子使用尺寸、流速、脱保剂的酸碱度等等。第二:核酸原料药生产使用固相合成技术,其在工艺放大和质量控制上存在较高壁垒;第三:核酸原料药固相合成配套设备、洁净环境等前期投入非常大;
质量控制的挑战
由于小核酸药物处于早期,目前无明确的法规对其进行指导,2021年FDA[5]发布关于反义寡核苷酸药物的化学、生产控制指南中提出;对于原料药,FDA推荐采用两种方法进行鉴别,鉴别包括:分子量及序列,其他方法包括熔点(Tm)、液相保留时间;原料质量研究内容包括:序列(质谱分析)、熔点(Tm)、成盐形式、残留溶剂、水分、微生物检测、细菌内毒素、杂质个数、特定杂质含量、总杂、元素杂质、重金属等等;
关于杂质限度的制定,暂无明确的法规进行参考,根据OSWG白皮书[6]第10章关于寡核苷酸药物中杂质中指出,建议鉴定限为1.0%,界定限为1.5%;文章给出制定该标准的理由有三点:第一:寡核苷酸药物的新杂质或未知杂质的大部分来源于合成,而这些杂质的化学结构很可能与目标化合物相似,它们的化学性质也有可能与目标化合物相似,比如水溶性、与蛋白结合力、分子量等;第二:由于寡核苷酸药物的分子量与小分子的分子量差异很大,比如,小分子的分子量大概为500Da,而寡核苷酸药物的分子量可能要达到5000Da,它们的分子量相差10倍,因此,在相同的临床剂量下,由于分子量的差异,寡核苷酸的杂质水平为1.0%与小分子药物0.1%的数量相当;第三:根据现有的毒理学数据,无法证明寡核苷酸药物的毒性是来源于杂质。同时文章中,还给出了关于寡核苷酸药物杂质鉴定决策树(详见下图5);具体报告限或鉴定限(小分子化药与OSWG白皮书)对比表。
图5寡核苷酸药物杂质鉴定决策树[6]
对于小核酸药物药物分析中还存在一个很重要的要点,那就是杂质分析方法的开发,由于在化学合成过程中,很容易产生n-1的杂质,该杂质通常比母体少一个碱基,因此它的的化学性质与目标化合物也是非常相似的,这就容易造成分离的困难,特别是对于较长序列的药物,据文献报道,序列越长,杂质越难被分离。在早期,人们是通过聚丙烯酰胺凝胶电泳分离,通过UV来检测;1980年,主要采用CGE分离不同长度的序列,这个方法主要是在聚丙烯酰胺凝胶电泳的基础上,填加了毛细管,从而提高理论塔板数;阴离子交换(AEX)HPLC后来被广泛应用,主要是用来定量分析硫磷二酯中的PO杂质;最近,离子对(IP)HPLC技术流行开来,在很多情况下,已经替代了CGE方法,用于分离不同长度序列的杂质;近年来,ESI-MS和IP-HPLC-ESI-MS技术被广泛使用。
表2 双链寡核苷酸活性成分的检测项目和分析方法[7]
表3 单链寡核苷酸活性成分的检测项目和分析方法[7]
递送系统的挑战
递送系统是小核酸药物研究的重点项目之一,递送系统关系到药物的安全性和有效性,对于不同疾病不同药物类型可能千变万化;目前已上市siRNA的产品均采用递送系统,而目前已上市的ASO未采用递送,但最终是否需采用递送系统还是要考虑众多因素;①作用靶点在哪些位置,脑部?肝?肺?肌肉组织?;②注射途径是什么?③风险与收益的平衡;
比如海昶生物对治疗原发性肾癌的HC0201进行了纳米脂质体优化,形成了差异化创新的抗原发性肝癌药物HC0301,两者为同一核酸API Mychexin;HC0201通过纳米脂质体技术,使它的稳定性和生物分布得到更佳的优化,同时对肿瘤内皮细胞和肿瘤微环境还有一些靶向的作用,通过递送系统,使药物精准作用肝脏,因此用于肝癌,而未采用递送系统则是用于治疗原发性肾癌。
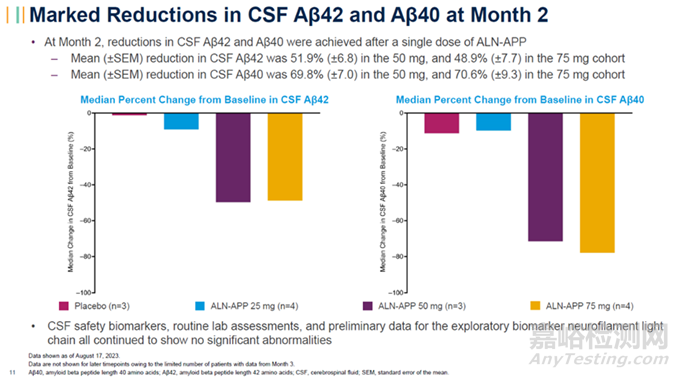
又比如针对治疗阿尔茨海默病(AD)和脑淀粉样血管病(CAA)等疾病,这些疾病的病变部位主要是脑部,因此目前较为成熟的递送手段LNP和GalNAc修饰手段,主要递送至肝脏,无法达到脑部;Alnylam Pharmaceuticals所开发的C16偶联技术经过优化,使得能够到达中枢神经系统组织,在今年10月底,针对治疗阿尔茨海默病(AD)和脑淀粉样血管病(CAA),Alnylam公布了在研的ALN-APP产品,目前该产品临床1期试验的中期结果获得了积极效果。结果显示,单剂ALN-APP的持续药代动力学活性可以长达10个月,同时观察到与AD和CAA相关的淀样蛋白片段Aβ42和Aβ40的显著降低。
比如已上市的Golodirsen,主要是用于治疗杜氏肌营养不良症,该产品主要是通过PMO修饰,并未使用递送系统,抗肌萎缩蛋白是一种细胞骨架蛋白主要布于心肌和骨豁肌肌纤维膜的胞质,最主要是分布在神经肌肉接头处,而被修饰后的Golodirsen,通过静脉注射,药物可以与血浆蛋白结合,自动进入细胞内,而该蛋白是处于心肌与骨骼肌纤维膜的胞质中,即药物仅进入外周组织即可达到效果。
图片来源于海昶生物官网
ALN-APP显著降低脑脊液中的Aβ42和Aβ40水平(图片来源:Alnylam官网)
总结:
一个药物被成功开发,最终走上市场需要经历千锤百练,需要考虑的因素也是非常众多;对于小核酸药物CMC的研发要点远远不止于此,在这里仅仅是粗略谈论了序列的设计思路、合成的研发要点、质量控制的研发要点、以及递送系统需要考虑的要点。
参考文献:
[1] DeVos, Sarah L.; Miller, Timothy M. (2013). Antisense Oligonucleotides: Treating Neurodegeneration at the Level of RNA. Neurotherapeutics, 10(3), 486–497. doi:10.1007/s13311-013-0194-5 ;
[2]Pourshahian, Soheil (2019). THERAPEUTIC OLIGONUCLEOTIDES, IMPURITIES, DEGRADANTS, AND THEIR CHARACTERIZATION BY MASS SPECTROMETRY. Mass Spectrometry Reviews, (), mas.21615–. doi:10.1002/mas.21615
[3] Comprehensive medicinal chemistry ,3rd.ed manufacturing of oligonucletides
[4] William F. Kiesman,Perspectives on the Designation of Oligonucleotide Starting Materials 10.1089/nat.2020.0909
[5] FDA发布指南草案:IND Submissions for Individualized Antisense Oligonucleotide Drug Products for Severely Debilitating or Life-Threatening Diseases: Chemistry, Manufacturing, and Controls Recommendations Guidance for Sponsor-Investigators
[6] Capaldi, Daniel; Teasdale, Andy; Henry, Scott; Akhtar, Nadim; den Besten, Cathaline; Gao-Sheridan, Samantha; Kretschmer, Matthias; Sharpe, Neal; Andrews, Ben; Burm, Brigitte; Foy, Jeffrey (2017). Impurities in Oligonucleotide Drug Substances and Drug Products. Nucleic Acid Therapeutics, (), nat.2017.0691–. doi:10.1089/nat.2017.0691
[7] Capaldi, D.; Ackley, K.; Brooks, D.; Carmody, J.; Draper, K.; Kambhampati, R.; Kretschmer, M.; Levin, D.; McArdle, J.; Noll, B.; Raghavachari, R.; Roymoulik, I.; Sharma, B. P.; Thurmer, R.; Wincott, F. (2012). Quality Aspects of Oligonucleotide Drug Development: Specifications for Active Pharmaceutical Ingredients. Therapeutic Innovation & Regulatory Science, 46(5), 611–626. doi:10.1177/0092861512445311