您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-05-11 18:04
近日,国家药品监督管理局(NMPA)公示文件表示,不予通过宁波健世科技经导管三尖瓣置换瓣膜LuX-Valve系统的注册申请。
LuX-Valve是健世科技自主研发的,全球首款经导管三尖瓣瓣膜置换器械,曾备受青睐,被预言有望成为中国经导管三尖瓣置换市场的首款获批产品,其第二代升级产品LuX-Valve Plus也广受好评。
被寄予厚望的LuX-Valve(Plus)瓣膜
LuX-Valve瓣膜是健世科技主打的核心产品,专为重度三尖瓣返流及高手术风险患者设计。2019年1月,LuX-Valve获国家药监局纳入创新医疗器械特别审查通道(即“绿色通道”),因此获准了快速审评审批资格。不仅如此,LuX-Valve瓣膜还被写入了《2021欧洲心脏病学会/欧洲心胸外科协会瓣膜性心脏病管理指南》,并且荣获多项国际大奖。

图源:美港股观察社
2022年2月,公司完成了LuX-Valve确证性临床试验6个月的随访,2022年8月完成1年的确证临床试验随访。在当时,LuX-Valve是第一款完成确证性临床试验受试者入组的在研产品,因此业界都认为LuX-Valve可能会成为全球首批获准商业化的经导管三尖瓣置换产品之一。
表现如此优异的LuX-Valve瓣膜,究竟有哪些独特的设计优势?LuX-Valve具有全球首创的“非径向支撑力”和“室间隔锚定”设计,攻克了人工瓣膜难以固定在心腔内的难题,摆脱了传统径向支撑力的固定理念,结合两个“兔耳朵”形状的夹持件结构,使人工瓣膜的锚定更加稳固。同时,配合自适应编织环克服了三尖瓣反流患者瓣环易扩张而引发的瓣周漏问题,且对三尖瓣周围自体组织无压迫,有效避免术后传导阻滞的发生。
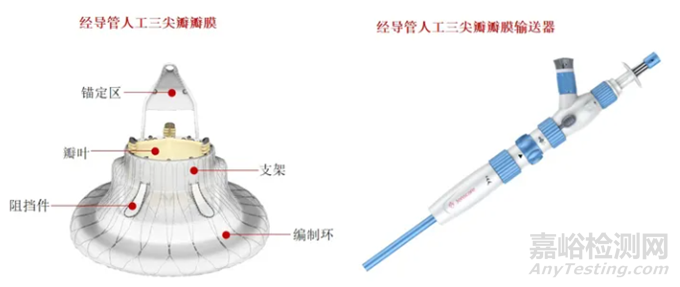
LuX-Valve瓣膜系统
从手术技术层面分析,LuX-Valve同样显示出了显著的优势。LuX-Valve操作简便,器械操作时间短,器械使用流畅度和容错率高,且瓣膜释放过程中可实现回收;术中影像依赖程度低,简便的瓣叶夹持和锚定方式减少术中对超声影像的依赖,使得术者能够快速推进手术进程、降低患者的手术风险;输送器调弯性能好,术中可进行五维调整,保证了人工瓣膜良好的同轴性,且能够不受起搏器/植入型心律转复除颤器导线的影响。
LuX-Valve Plus系统是第二代创新型产品,与第一代相比其不仅延长了输送器,既能够在水平方向进行调弯,将瓣膜送至右心室,又可在垂直方向上调弯以调整瓣膜与瓣环的同轴性;转动旋转控制按钮,可控制瓣膜自身旋转,有助于瓣膜锚定件与室间隔平行;具有较高精巧性的鞘输送系统(33-F),可实现三平面运动同轴对准和阀门方向调整,径向力独立锚定机制有助于确保瓣膜植入过程中的稳定性和安全性。

LuX-Valve Plus瓣膜
LuX-Valve(Plus)确证性临床试验
LuX-Valve确证性临床试验是一项前瞻性、多中心的单臂研究,中国医学科学院阜外医院胡盛寿院士、潘湘斌教授为主要研究者团队,包括阜外医院、安贞医院等在内的中国九家顶级医疗机构参与了该临床试验。共纳入126例重度三尖瓣反流患者,主要终点为术后一年累积全因死亡率。
1年随访数据显示,99.1%的患者三尖瓣反流得到改善,94.4%的患者三尖瓣反流分级降至轻度及以下,75.7%的患者恢复至无/微量反流。一年全因死亡率为10.32%;Ⅲ度房室传导阻滞或需要安装永久性起搏器发生率仅为1.6%,卒中2.4%,肺梗塞和瓣膜支架断裂发生率均为0。
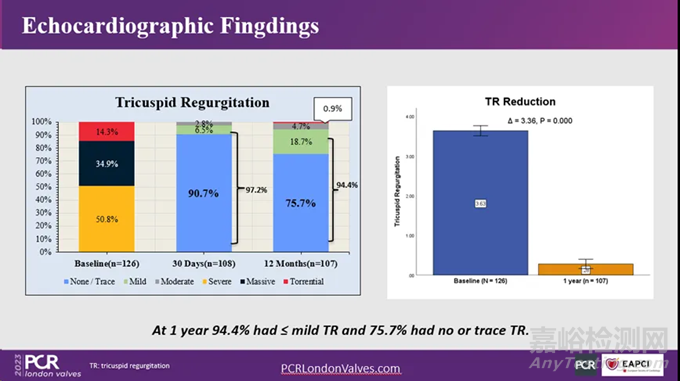
LuX-Valve确证性临床研究一年期结果显示出该产品优异的疗效和安全性,显著改善患者的三尖瓣反流症状,同时大幅提高患者术后的身体状态和生活质量。目前,第二代产品LuX-Valve Plus也已经完成了NMPA确证性临床试验(TRAVELⅡ)的1个月的随访工作,数据亦进一步证实了该产品的优异性能和治疗效果。
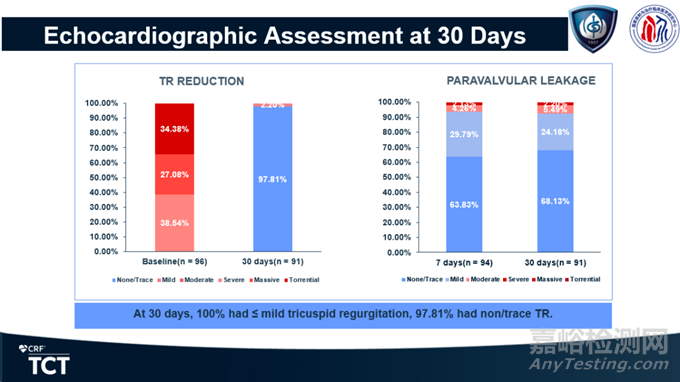
TRAVELⅡ是一项前瞻性、多中心、单臂临床试验,由葛均波院士作为PI,联合中国15家医院共同完成,最终纳入96例患者。主要终点为术后30天复合事件发生率。
30天有效性结果显示,100%患者三尖瓣反流降低至轻度及以下,97.81%患者显示无/微量瓣周漏。患者心功能和生活质量明显改善。安全性方面,全因死亡率为1.08%,心梗、卒中、使用ECMO或IABP、危及生命的大出血事件等发生率均为0。
单组目标值设计或为未过审原因
这样一款近乎完美的三尖瓣器械,为何没能通过注册审批?
2020年3月,国家药品监督管理局医疗器械技术审评中心批准健世科技开展经导管人工三尖瓣瓣膜临床试验。可以看到,无论是LuX-Valve还是LuX-Valve Plus,临床试验均为单组目标值设计,主要评价终点分别设定为一年内累计死亡率、术后30天复合事件发生率。
关于该产品注册未获通过的原因,有业内人士猜测:现在药监局要求所有三尖瓣产品都要和药物进行对照研究。
根据之前的报道,在近期一次面向投资者的专题交流会上,健世科技公司透露,LuX-Valve由于临床试验中未设置对照组,未能通过国家药品监督管理局(NMPA)的注册审批。
健世科技发布公告,公司将继续评估本次国家药监局决定的影响并推进LuX-Valve系列产品的全球商业化进程,包括但不限于尽快取得LuX-Valve Plus的国家药监局上市注册批准、推进完成CECertificate注册临床试验与上市注册批准、推进完成美国早期可行性临床研究及后续临床研究和上市注册批准。
单组目标值设计的临床试验,还能开展吗?
说到单组目标值设计,国家药品监督管理局医疗器械技术审评中心曾发布文件指出,随机、设盲、平行对照的临床试验设计,被认为可提供高等级的科学证据,应当被优先考虑;单组目标值设计仅在有限条件下被允许,例如设置对照在客观上不可行。
颅内药物涂层球囊扩张导管不符合单组目标值设计的基本原则,不能开展单组目标值临床试验,建议选择随机对照试验设计进行临床试验。目前允许开展单组目标值设计的临床试验领域包括TAVR、退行性二尖瓣夹、ECMO,对冠状动脉冲击波球囊的试验设计要求现在并不明确。赛禾医疗冠状动脉冲击波球囊的注册试验采用的是单组目标值设计,产品已获批,是我国首个获批上市的冠脉冲击波球囊产品。后续相关产品是否仍能采用单组目标值设计犹未可知。

来源:医心


