您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-07-04 08:36
几十年来,许多亚硝胺被认为是致癌的。尽管几种亚硝胺前体经常用于药物产品的制造,但由于缺乏对它们在制造过程中如何形成的了解,它们在药物产品中的潜在存在以前被忽视了。从风险评估可以清楚地看出,亚硝胺或其前体可能存在于成品剂型的任何组分中。作为风险缓解策略,应避免使用极有可能形成亚硝胺的成分。在没有合适替代品的情况下,必须采取足够的措施将亚硝胺维持在可接受的摄入量以下。必须广泛研究赋形剂生产途径,以确定可能导致亚硝胺形成的可能赋形剂成分。制造商不得仅依赖原料药和辅料的药典规范,还应制定和实施额外的策略来控制亚硝胺杂质。该制剂可以补充亚硝化抑制剂,如维生素C,以停止亚硝胺的产生。本综述的目的是确定药物剂型中亚硝胺形成的关键风险因素,并提供有效的控制策略,将其控制在可接受的每日摄入量限值以下。
1.介绍
已知许多亚硝胺具有致癌活性。各种组织已经认识到N-亚硝基二甲胺(NDMA)作为人类诱变致癌物的作用。此外,导致它们产生的机制甚至在20世纪50年代之前就已为人所知。尽管如此,考虑到许多亚硝胺前体(磺胺类抗生素、二甲双胍和N,N二甲基甲酰胺(DMF)通常用于其产品中,制药工业和监管机构都没有意识到它们在药品中存在的高可能性准备。一个颠覆性事件(缬沙坦召回)动员了行业并制定了新的监管策略来控制药品中亚硝胺的存在。因此,在2018年,当缬沙坦片中检测到浓度可能对人类构成风险的NDMA水平时,就拉响了警报,引发了缬沙坦片剂的召回。随后,在缬沙坦片中发现了其他值得关注的亚硝胺杂质,如N-亚硝基二乙胺(NDEA),在氯沙坦片中发现了N-亚硝基-N-甲基-4-氨基丁酸(NMBA)。
最初,这些杂质被认为与血管紧张素II受体阻滞剂(ARB)中四唑环形成的特定制造过程有关。然而,当在二甲双胍、雷尼替丁和尼扎替丁等非ARB分子中也发现NDMA时,这一假设很快就失效了。在适当的时候,利福平和利福喷丁中也分别报告了1-甲基-4-亚硝基哌嗪(MNP)和1-环戊基-4-亚硝基哌嗪(CPNP)(表I),表明不同的制剂成分可能有助于药物中亚硝胺的产生产品。这意味着亚硝胺可以存在于典型剂型的任何组分中,包括活性药物成分(API)(特别是具有胺官能团的那些)、赋形剂、加工助剂、溶剂、试剂、再循环溶剂(含亚硝酸钠的DMF)、包装材料、制造设备和制造工艺。
表1: 制剂中检出/报告的潜在N-亚硝胺杂质
2.N-亚硝胺生物活化机理
NDMA和其他N-亚硝基二烷基胺的致突变性和遗传毒性归因于它们通过细胞色素P450催化的一系列反应转化为烷基重氮离子和烷基碳离子。N-亚硝胺本身不致癌。由于它们在生理pH下的稳定性,它们需要代谢活化。细胞色素P450依赖性酶引起涉及几个步骤的生物活化。活化通过α-碳的羟基化引发,随后醛的自发损失或形成亚硝胺。亚硝胺在生理条件下也是不稳定的,并且非酶分解成碳正离子或重氮化合物(图1)。这两种化合物都能够烷基化各种细胞大分子,如DNA、RNA和染色体,形成加合物。鸟嘌呤的N-7烷基化导致DNA的不稳定和断裂增加。因此,由此产生的DNA损伤导致癌症。具有可氧化碳中心α至亚硝基的N-亚硝胺似乎是代谢依赖性致癌性的关键要求。此外,活化亚硝胺增加通过增加活性氧如超氧化物和过氧化氢的产生从而增加脂质过氧化和蛋白质加合物形成的氧化应激。

图1 亚硝胺杂质的生物活化机理
3.亚硝胺形成机理
亚硝化反应在亚硝化剂的存在下进行,并且该反应通过有利的化学环境条件如介质的pH和胺的pKa的存在而促进。在胺中,仲胺表现出形成亚硝胺的最高潜力。亚硝酸盐和硝酸不直接参与亚硝化反应,而是在两个平衡步骤中转化为亚硝化剂。首先,亚硝酸根离子(NO2)被质子化形成亚硝酸(HNO2),亚硝酸可以与作为亚硝化剂的无水三氧化二氮(N2O3)处于平衡状态。反应在酸性条件下以更快的速度进行。在第二步中,胺的去质子化在较高pH下进行。该反应的速率取决于胺的浓度和亚硝酸盐浓度的平方(图2)。另一方面,反应性较低的氨基化合物不与N2O3反应,但可以与在低pH下由硝酸产生的亚硝基离子(NO+)反应,其速率取决于胺化合物的浓度、亚硝酸盐浓度和水合氢离子浓度(图2)。胺(碱性氮)的pKa对反应速率的作用可以从胺的未质子化形式显示的事实推断出来与亚硝化剂反应的高度倾向。例如,pKa为5.1的氨基比林显示出比pKa为10.7的二甲胺(DMA)更大的反应性。
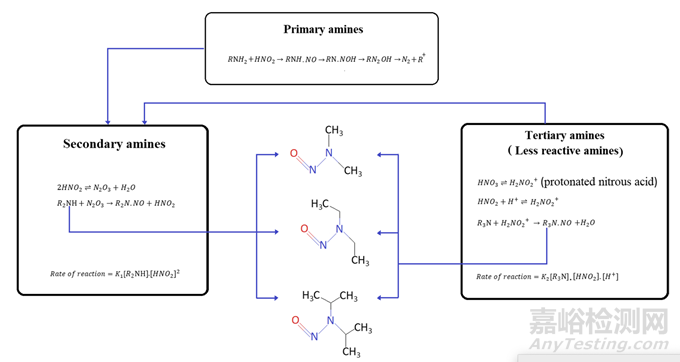
图2 亚硝胺杂质形成机理
在叔胺的情况下,还提出了NDMA形成的四步机制。氯胺亲核取代之后是氧化、脱水和亚硝化。亚硝化是该序列中的限速步骤,并控制叔胺中的NDMA水平。此外,在DMA部分旁边具有官能团如苄基、芳族杂环和二烯取代的亚甲基的叔胺可以作为NDMA的重要前体[23]。在雷尼替丁的情况下,King等人。表明雷尼替丁的分子间反应导致雷尼替丁的缓慢降解,导致NDMA的形成,而不涉及杂质。影响降解速率的风险因素是热、湿度和晶体形态。其他作者得出结论,储存环境、固态形式和制剂成分也可能导致NDMA的产生。
类似地,亚硝胺也可以在环境室温(25°C)下在接近中性和碱性条件(pH 6-14)下形成,这表明当暴露于被二氧化氮污染的空气时,在生理pH下,如在肺部,有产生亚硝胺的风险。然而,在这些条件下的亚硝化以与上述不同的机制进行,涉及亚硝化剂二氧化氮或其平衡对应物N2O3和N2O4气体。此外,高溶解度亲脂相中的游离胺碱(反应性更强的形式)可以在生理条件下增强亚硝胺的形成,而不依赖于pH。
值得注意的是,服用低剂量(mg/Kg)缬沙坦的患者终生癌症风险被确定为低。例如,EMA(欧洲药品管理局)计算出服用含有NDMA(6年)和NDEA(4.6年)的缬沙坦的患者的癌症发展的累积终生风险为0.03%,最高日剂量为320 mg。与欧盟约50%的终生癌症风险相比,这种超额风险非常低。
4. 亚硝胺形成的风险因素
胺
仲胺和叔胺以及仲酰胺显示出经历亚硝化反应的趋势,尽管程度不同。具有二烷基、二芳基、烷基芳基、N-烷基脲、环状仲胺、N-烷基氨基甲酸酯和N-烷基酰胺等官能团的药物高度敏感,可形成亚硝胺。除了活性药物成分(API)之外,胺也可以通过起始材料、中间体、试剂、催化剂、酰胺溶剂和存在于酰胺溶剂中的仲胺杂质(例如:DMA杂质在DMF中)。当长时间加热时,酰胺溶剂如DMF、N-甲基吡咯烷酮、N,N-二甲基乙酰胺和N,N-二乙基乙酰胺会降解并形成仲胺。类似地,叔胺试剂如三甲胺可以含有痕量的仲胺如二丙胺和异丙基乙胺,而季胺试剂如四丁基溴化铵已被证明降解为仲胺(二丁胺杂质)和叔胺(三丁胺杂质)。
残余胺也可以存在于回收的溶剂、试剂和催化剂中。事实上,亚硝胺可能在回收过程本身中形成。例如,在回收过程中用亚硝酸淬灭叠氮化二钠会导致亚硝胺的形成。根据它们的沸点和溶解度特性,随后的纯化步骤可能不会完全去除它们。不完善的生产工艺以及不充分的过程控制(如pH、温度等)也会导致亚硝胺的形成。
亚硝化剂来源
像亚硝酸钠这样的亚硝酸盐通常被添加到肉类中,要么是为了增强其感官吸引力,要么是为了保存。此外,制造过程如发酵可诱导硝酸盐和其它氮源如氨基酸转化为亚硝酸盐形式。吸烟、环境污染等也可产生高活性亚硝化剂如氮氧化物。如上所述,气态形式N2O3和NO2甚至可以在生理条件下导致亚硝胺的形成。一种底物的亚硝基通过转亚硝化作用甚至可以在与具有形成亚硝胺潜力的另一底物接触时触发亚硝胺的形成。
硝酸盐和亚硝酸盐也以足以促进亚硝化反应的水平存在于人唾液和胃中。众所周知,水果和蔬菜、加工食品(肉类)和水中存在硝酸盐。此外,亚硝酸盐和硝酸盐也可以内源性产生。因此,必须将药品亚硝胺暴露的影响与膳食亚硝胺进行比较,并评估是否存在任何显著差异。粮农组织(粮食及农业组织)/世卫组织(世界卫生组织)食品添加剂联合专家委员会(JECFA)建议硝酸盐的可接受日摄入量(ADI)为3.7毫克/千克/天,相当于60公斤的人每天222毫克硝酸盐。每天400克(蔬菜和水果)的均衡饮食暴露量相当于大约157毫克/天的硝酸盐。
辅料
微量的亚硝化杂质(亚硝酸盐和硝酸盐)也存在于常用的赋形剂中,包括预胶化淀粉、聚乙烯吡咯烷酮、交联羧甲基纤维素钠、淀粉乙醇酸钠、交联聚乙烯吡咯烷酮和乳糖。辅料中这些杂质的来源可以追溯到加工用水和生产工艺,尤其是涉及使用酸和漂白剂的工艺。干燥过程中的氧化是一种高风险事件,最终会形成亚硝胺。在二甲双胍片剂的情况下,已经表明工艺参数(水和热)以及辅料的硝酸盐和亚硝酸盐含量的共存在NMDA的产生中起着关键作用[29]。鉴于二甲双胍的主要缓释剂量制剂已被召回,似乎含有较高水平亚硝胺杂质并经常用于缓释制剂中的纤维素基聚合物显著有助于这些制剂的较高亚硝胺负载。
受污染的原材料也可能是亚硝胺杂质的来源。污染可以通过各种方式发生,包括储存容器之间的转移,具有硝酸盐部分的原材料(如硝酸钾)通常含有亚硝酸盐杂质,以及由于低效的清洁过程而来自其他亚硝胺生成过程的交叉污染。这凸显了严格控制原材料供应链的必要性。清洁验证计划应考虑亚硝胺交叉污染的风险。
减少/消除亚硝胺形成的控制策略
药品的有效控制策略应考虑所有成分,即活性药物成分(API)、赋形剂、包装材料和制造工艺[14](图3)。FDA(美国食品药品监督管理局)和EMA建议采取三步法控制药品中的亚硝胺杂质。
步骤1(风险评估):如果API、已上市产品或待批准产品中怀疑存在亚硝胺杂质,则进行风险评估。应优先选择亚硝胺污染风险高的药品。
步骤2(确认):如果产品中存在亚硝胺形成的可能性,则进行确认测试应使用具有可接受的专属性、色谱分离和检测能力的分析方法进行(对于高剂量产品,LOD(检测限)和LOQ(定量限)应尽可能低)。
步骤3(监管沟通):如果污染物超过ADI阈值,应向监管机构发出警报,并调整制造方法。应制定有效的控制策略以降低风险。应评估由此产生的变更对已批准申请的影响,并根据情况更新监管提交的文件。

图3制剂中亚硝胺杂质的风险评估
活性药物成分
FDA建议采取以下步骤来减轻和控制API中亚硝胺的存在
解决方式:
应避免产生亚硝胺的可能性高的反应条件。如果替代路线或条件无法部署;然后,必须实施适当的控制措施,以确保亚硝胺水平始终降低到可接受水平以下
如果合成路线正在产生亚硝胺;然后,仲胺、叔胺或季胺必须用其他(替代的)碱代替
无论何时使用酰胺溶剂,都必须格外小心
在叠氮化物分解操作中,不应使用亚硝酸盐作为猝灭剂
必须设计和优化工艺,对反应顺序、工艺和反应条件(如pH、温度和反应时间)有足够的控制
必须包括去除亚硝胺污染物的下游加工方法
应从主反应混合物中去除猝灭步骤。相反,叠氮化物应该从母液中分离到有机相中,然后从有机相中分离含水废物相,然后可以在没有猝灭剂与API接触的风险的情况下猝灭
原材料、起始材料、中间体、试剂,溶剂等供应链中,如有必要,必须采取额外的控制措施,如对有风险的原材料制定严格的质量标准
必须实施控制措施,使回收的材料仅用于收集材料的同一步骤或同一工艺的较早步骤。这将有助于防止交叉污染。此外,回收的材料在再利用之前应符合严格的规格。外包承包商进行的回收需要这些实验室必须遵守的一系列严格要求,包括清洁程序的验证和质量体系的监控
应监测合成中使用的便携式水的硝酸盐和亚硝酸盐。如果需要,应在使用前对水进行净化
可进行再加工和返工以控制亚硝胺水平
控制策略
如果API中检测到高于LOQ的亚硝胺,则应制定控制措施。用于此目的的分析方法应非常灵敏,LOQ≤0.03 ppm[30]。对于高剂量API,方法的LOD和LOQ应尽可能低。如果存在一种以上的亚硝胺,则需要经过验证的分析方法,LOQ甚至低于0.03 ppm。
有效的控制策略应包括质量标准限度,以确保亚硝胺水平保持在ADI限度以下。如果产品中检测到的亚硝胺水平高于LOQ,则应对每批产品进行检测。不应放行亚硝胺水平高于ADI的API批次。FDA应该被告知上市产品中亚硝胺的存在,这一点怎么强调都不为过。根据临床结果和产品停产的风险,FDA偶尔会同意亚硝胺含量大于ADI的批次仍可使用。例如,一些销售含有1-甲基-4-亚硝基哌嗪(MNP)的利福平或含有1-环戊基-4-亚硝基哌嗪(CPNP)的利福喷丁(CPNP)高于可接受摄入量限值(MNP为0.16 ppm,CPNP为0.1 ppm)的制造商被允许暂时销售产品,直到他们减少或消除杂质,前提是MNP和CPNP水平分别低于5 ppm和14 ppm。
制剂
与API的情况一样,FDA提出了成品的三步风险评估方法。药品制造商应与API制造商密切合作,确定合成路线的潜力,并产生亚硝胺的加工条件[30]。正如雷尼替丁的案例所示,风险评估还应考虑API在生产或储存过程中可能导致亚硝胺形成的降解途径[25]。在不存在风险的情况下,无需采取进一步措施。另一方面,如果确定制剂中存在亚硝胺的风险,则应使用经验证的分析方法对批次进行确认性检测。如果在成品中检测到亚硝胺,应调查根本原因并改变生产工艺以减轻或减少亚硝胺杂质。
药品生产企业采取的控制策略应包括以下内容:
在使用任何来料成分(包括大量风险API)之前,药品制造商必须测试所有来料成分的代表性样品并继续测试API批次,直到他们验证API供应商能够始终如一地生产API而不含不可接受水平的亚硝胺
评估是否在使用风险API的制造过程中可能存在亚硝酸盐
评估在药品有效期内成品中是否可能形成亚硝胺
如果外部因素导致亚硝胺污染,应消除污染源
如果亚硝胺杂质高于LOQ,则需要采取策略将亚硝胺水平控制在ADI限值以下。控制策略应包括确定的亚硝胺的质量标准限度,以及确定是否由于API结构、API合成路线或API或制剂的生产工艺而固有引入亚硝胺。每个批次都应进行检测
任何发现亚硝胺杂质含量等于或高于推荐ADI的药品批次均不应由药品制造商放行进行分销,除非FDA基于药品短缺对患者的严重影响而同意暂时允许此类产品的分销
根据上述建议,以下章节讨论了常用药品中亚硝胺的控制策略。
盐酸二甲双胍
二甲双胍由DMA盐酸盐和2-氰基胍合成。因此,残留的DMA可被带入API,因此API被控制在不超过0.05%的水平。然而,即使在这种低浓度下,它也会产生亚硝胺杂质在与含有亚硝化剂的赋形剂接触时。因此,消除或限制API中残留的DMA可以显著降低亚硝胺生成的风险(图4)。幸运的是,NDMA表现出高水溶性和高挥发性,这有利于其在下游结晶和干燥过程中的去除。由于它们的离子特性,亚硝酸盐和DMA在水相中的分配进一步促进了它们的去除。DMA、亚硝酸盐和NDMA的水/二氯甲烷分配系数(log P)分别为-4.75、-2.89和-0.54。事实上,实践表明,在下游过程中,NDMA可以降低到<1 ng/g的水平。因此,采用纯化步骤如多个结晶步骤可以从NDMA中释放二甲双胍API。考虑到产品中30 ng/g的适用限度,二甲双胍API的贡献可以忽略不计。与NDMA一样,DMA水平可在多个纯化步骤期间降低至10-100 μ g/g的水平。为了控制API中的DMA水平,使得未来批次中的NDMA低于ADI的30%,进行了API DMA水平与NDMA浓度之间的线性回归分析。作者提出DMA的内部控制限度为60 μ g/g作为二甲双胍片的控制策略。
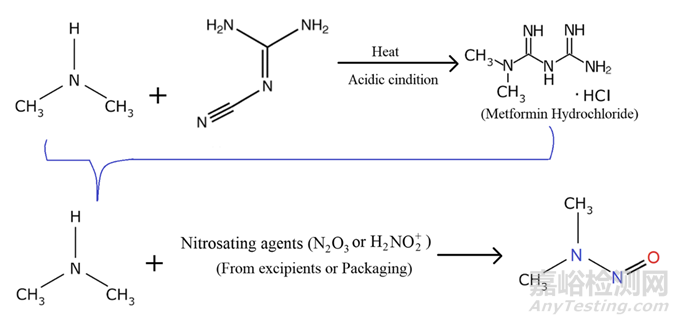
图4: 二甲双胍中N-亚硝基二甲胺的生成机理
考虑到前面的讨论以及大多数二甲双胍缓释剂型被召回的事实,二甲双胍API的风险微不足道。事实上,已经证明通常用于控制药物释放的赋形剂,如HPMCE4和HPMC K15,含有高亚硝胺水平,并有助于二甲双胍缓释制剂中较高的亚硝胺水平。
雷尼替丁
雷尼替丁含有叔胺基团,在固态和液态下都缺乏稳定性。而且,雷尼替丁易于光介导降解,导致乙醛肟、噻唑、DMF、二甲基乙酰胺、5-甲基糠醛和其他降解产物的形成气相色谱法在测定雷尼替丁原料药和雷尼替丁片剂中的NDMA水平方面无效,因为该方法没有选择性,峰分辨率较差,导致NDMA水平较高。FDA推荐了一种替代的、经过验证的液相色谱和高分辨率质谱光度计方法(LC-HRMS),该方法可防止雷尼替丁降解和随后NDMA的形成。该方法的LOD为0.011 ppm,LOQ为0.033 ppm。
接近到期的产品显示出比新产品更高的NDMA水平,表明降解是NDMA形成的原因。雷尼替丁粉末和片剂中的NDMA水平在加速条件(40℃/75%相对湿度)下分别从0.19 ppm增加到116 ppm和从2.89 ppm增加到18 ppm,超过了FDA为雷尼替丁片剂设定的0.32 ppm的每日摄入限值(1 g雷尼替丁中存在0.32 μ g NDMA或300 mg/天雷尼替丁最大日剂量中存在0.096 μ g NDMA)。
当外推至室温条件时,这代表了显著的风险。强制降解研究表明,氧化和水分可能是导致NDMA增加的因素。已经提出了雷尼替丁中NDMA形成的各种其他机制。雷尼替丁会发生自我分解,导致储存过程中亚硝酸盐浓度增加。反应速率受热、湿度和晶体形态的影响。柱状晶体显示出较慢的降解速率。雷尼替丁释放的DMA在与亚硝化剂接触时也可能导致NDMA的形成。类似地,水的氯胺化也被认为是雷尼替丁片剂中亚硝胺形成的来源。一些报道甚至表明,口服雷尼替丁后,胃肠道中存在的亚硝酸盐导致体内NMDA的形成。
Yokoo等人进行的强制降解研究表明,除了雷尼替丁之外,杂质A、C、D、E、H和I在固态或液态下以不同的速率产生NDMA。USP(美国药典)和EP(欧洲药典)规定了雷尼替丁中的11种杂质(A、B、C、D、E、F、G、H、I、J和K)(表2)。杂质A、C、D、E和I含有DMA和/或N,N二烷基-2-硝基乙烯-1,1-二胺基团。有趣的是,不含胺部分的杂质H也导致固态NDMA的形成,表明NDMA形成的不同途径。作者认为,杂质H的N-甲基的水解产生甲胺,甲胺与硝基甲烷(通过杂质H的水解和脱羧形成)反应形成DMA和亚硝酸,亚硝酸反应形成NDMA。无定形杂质A、C和E导致以比结晶盐酸雷尼替丁高约100倍的速率形成NDMA。杂质I显示出在中等温度下形成NDMA的潜力。因此,必须严格控制这些杂质。Yokoo采用的分析方法类似于FDA推荐的方法,即LC-HRMS,但有一些微小的变化。
表2: 雷尼替丁中的杂质
沙坦类药物
沙坦类药物中亚硝胺的存在可追溯到四唑环形成过程中使用的试剂、溶剂、催化剂和反应条件。大多数已获得上市许可的产品中使用的API是通过使用遗传毒性叠氮化物试剂(叠氮化钠)合成的,该试剂在酸性条件下用亚硝化剂(亚硝酸钠)猝灭(图5)。使用催化剂如路易斯酸来加速反应。此外,大量的试剂、高温条件和溶剂(DMF、二甲基亚砜和N-甲基吡咯烷酮(NMP)以及与它们相关的杂质)提供了亚硝胺形成所需的合适环境。后来证实,可以通过在猝灭前分离原料药来防止亚硝胺的形成。
发现亚硝胺的形成通过两种途径产生。在一种途径中,DMF和N-甲基吡咯烷酮由于水解和/或热介导的降解分别形成仲胺,即DMA和4-甲基氨基丁酸。随后,DMA和4-甲氨基丁酸与亚硝化剂反应并形成NDMA和NMBA。在第二种途径中,试剂(三甲胺、二异丙基乙胺和DMA)经历N-亚硝化脱烷基化,形成NDEA(N-亚硝基二乙胺)、NDIPA(N-亚硝基二异丙胺)、NEIPA(N-亚硝基乙基异丙胺)和NMPA(N-亚硝基甲基苯胺)。所有的反应物,包括溶剂、试剂和催化剂,如果被仲胺和叔胺杂质污染,会产生亚硝胺。
在某些条件下将亚硝化剂、胺衍生试剂、溶剂和催化剂结合在一起为亚硝胺的产生提供了合适的环境。这些药物的组合代表亚硝胺形成的高风险,因此,应避免组合。
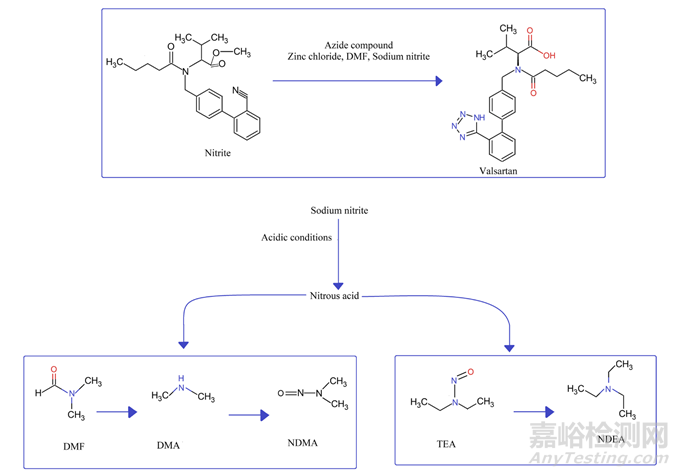
图5:沙坦类药物中亚硝基杂质的形成机理
吡格列酮药物
吡格列酮通常通过两种途径合成。在路线I中,亚硝酸钠用于苯胺衍生物的亚硝化重氮化,而路线II不使用任何亚硝化剂。确定根本原因是在上游工艺中使用亚硝酸钠和溴化氢,在下游工艺中使用DMF和盐酸,这表明在引入DMF之前,亚硝酸钠(或另一种形式的亚硝化剂)在几个步骤中携带。避免创建NDMA的一个选择是替换DMF。
除了上述机制有助于亚硝胺形成的可能性之外,在吡格列酮的情况下,发现来自先前步骤的胺和亚硝酸盐的残留导致亚硝胺形成。因此,回收的溶剂、试剂和催化剂以及交叉污染(在多用途设施中)是潜在的亚硝胺来源。印度Lantech Pharmaceuticals Limited收到FDA警告信,称该工厂回收的溶剂含有NDEA和NDMA。
赋形剂和制造工艺
候选药物可以直接与赋形剂反应,例如在伯胺和乳糖的情况下。然而,在大多数涉及氧化降解的情况下,是辅料杂质导致了与API的反应/相互作用。与API(具有明确的组成)不同,赋形剂通常含有多种负责药物-赋形剂相互作用的成分(图4)。已知与API反应的主要辅料杂质是过氧化物、过氧化氢、甲醛和甲酸。因此,谨慎的做法是了解辅料的生产途径,以识别可能与可能与API发生反应的辅料相关的潜在成分。赋形剂是合成的或源自天然来源(植物、动物和采矿)或工程(基因修饰、生物技术和配制)。通常,辅料来源决定其组成和杂质。赋形剂中存在的痕量加工助剂也可能积极参与药物-赋形剂相互作用或可能促进这些相互作用。
在其他杂质中,硝酸盐和亚硝酸盐也通常存在于赋形剂中。含有痕量硝酸盐和亚硝酸盐的赋形剂的实例是交联羧甲基纤维素钠、聚乙烯吡咯烷酮、乳糖、预胶化淀粉等(图6)。硝酸盐和亚硝酸盐的存在在赋形剂中也与加工水和加热过程中的漂白和氧化等加工步骤有关。因此,含有硝酸盐和亚硝酸盐的辅料存在在含有胺的API的产品中产生亚硝胺的风险官能团,尤其是更易受攻击的仲胺。

图6:常用药用辅料中亚硝酸盐和硝酸盐含量
辅料在亚硝胺形成中的作用可以通过二甲双胍案例研究来了解。证据表明,二甲双胍对二甲双胍片剂中发现的NDMA水平没有显著影响。相反,制造过程,特别是涉及加热和亚硝酸盐引入的过程,会产生大量的NDMA。事实上,当辅料的亚硝酸盐负载降低时,产品中的NDMA水平得到控制,并且已被提出为有效的控制策略。在一项这样的研究中,Nasr等人。建议在颗粒内部分使用PVP K30作为二甲双胍IR片剂的粘合剂,无论溶剂和干燥温度条件如何,都可以添加该粘合剂。相反,当通过颗粒内添加羟丙基甲基纤维素(HPMC)E5(分散在水中,亚硝酸盐负载为40ppm,硝酸盐负载为25ppm)然后在60℃下干燥来制备制剂时,观察到NDMA水平(0.135 ppm)的惊人增加,对应于269ng/天的日剂量,远远大于可接受的日摄入量。然而,当相同制剂在较低温度(25℃)下干燥时,NDMA水平(0.034 ppm)适度增加,对应于67ng/天的日剂量。当颗粒外添加(没有水和热量)时,含有高水平亚硝酸盐(100 ppm)和硝酸盐(155 ppm)的Polytox®甚至没有显示出可检测到的NDMA水平,这表明水和热量在NDMA生成中的作用[29]。该结果在另一项研究中也得到了验证。NDMA的增加被证明与压缩过程中的热量、水分和应力以及PVP K30和HPMC作为亚硝酸盐来源有关[29]。这些研究支持了问题似乎出在控释赋形剂(特别是纤维素基赋形剂)上的观点,并解释了为什么大多数召回的药物都是控释制剂。
辅料制造商和成品制剂制造商之间沟通的重要性怎么强调都不为过。需要密切合作来控制硝酸盐和亚硝酸盐的残留水平。然而,期望辅料制造商修改其工艺以满足制药行业的需求是不现实的。制药公司只占其客户群的一小部分,一些关键药物和辅料已经供不应求。因此,辅料供应商不太可能有兴趣广泛测试他们的材料的亚硝酸盐含量。因此,客户将不得不承担测试的负担,这在经济上是不可行的。可能优选用碱性稀释剂重新配制或添加抗氧化剂,而不是通过额外测试控制赋形剂。更好的替代方案可能是使用碱性稀释剂或添加抗氧化剂而不是通过额外测试控制赋形剂进行重新配制。
在API合成和成品制剂生产制粒过程中通常用作溶剂的便携式水也可能含有亚硝酸盐和亚硝胺杂质。在制剂开发过程中选择辅料时,应考虑辅料的硝酸盐和亚硝酸盐负载量并评估其影响。另一种控制策略是选择在剂型中提供中性或碱性微环境的赋形剂,因为亚硝胺反应在酸性条件下更有利地进行。目前API和辅料的药典规范不足以控制亚硝胺杂质。因此,API制造商和成品制剂制造商除了遵守相关药典专论外,还必须制定和实施控制这些杂质的策略。
Lhasa Limited正在维护一个与常用辅料中亚硝酸盐水平相关的数据库,该数据库使用经过验证的分析方法进行测量。该数据库提供了一个有用的平台来估计辅料中存在的亚硝酸盐对药品中亚硝胺生成的风险。作为制剂的主要组分的稀释剂或填充剂预期贡献最高水平的亚硝酸盐。幸运的是,稀释剂含有低亚硝酸盐水平,并显示出不同批次间腈水平的低可变性,导致典型制剂中亚硝酸盐的平均值为1 μ g/g。例如,对于微晶纤维素和乳糖一水合物,报告的平均亚硝酸盐水平分别为0.70 μ g/g和0.54 μ g/g。相比之下,交联聚维酮显示出6.5 μ g/g的非常高的平均亚硝酸盐水平。数据库中报告的玉米淀粉、交联羧甲基纤维素钠、羟丙甲纤维素、硬脂酸镁、聚维酮和胶体二氧化硅的平均亚硝酸盐水平分别为0.21、0.42、0.80、2.6、0.83和1.3 μ g/g。大多数赋形剂的亚硝酸盐水平低于10 μ g/g。数据库可用于计算制剂中的平均亚硝酸盐含量。
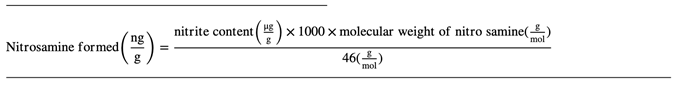
考虑到亚硝胺形成的有利条件,提出了以下方程来估计制剂中由亚硝酸盐形成的亚硝胺的量(ng/g)。
稳定性评价
雷尼替丁案为药品中亚硝胺的来源提供了新的线索[25]。含有不稳定胺的产品,如雷尼替丁,应在加速(40°C/75%RH)和实时稳定性设置(30°C/75%RH-IVB区为最差情况)下进行严格的稳定性研究。强制降解研究可用于绘制降解曲线并预测在实时储存条件下可能产生的潜在降解杂质。例如,雷尼替丁片剂在60°C/75%RH下储存在打开/关闭的真空小瓶中1周,表明水分、氧气和高温条件诱导NDMA形成[25]。同样,Dharani等人报告了二甲双胍速释片和缓释片在使用储存条件下形成亚硝胺,这意味着风险产品的使用稳定性评估应成为正式稳定性计划的一部分,并应提供适当的使用储存建议,以确保使用期间药物的安全性[50]。对于有风险的产品,在选择包装时必须特别小心。
在稳定性计划中评价产品时,为该计划选择的辅料批次应代表典型的生产工艺。考虑到大多数亚硝胺是通过LC-MS/MS(三重四元)方法分析的,将亚硝胺测试添加到药品所经受的一系列测试中肯定会产生成本影响。
包装材料
在某些情况下,亚硝胺可追溯到基本包装材料。硝化纤维素是铝箔上使用的印刷底漆、印刷油墨和清漆的主要成分之一[37]。由于它们可以简单地印刷在铝箔和纸箔上,它们被广泛用于医药和食品应用。起泡操作通常需要高温(>180℃)以形成袋并在基底和盖箔之间有效密封。高温会导致硝化纤维素热分解,导致硝酸(NO)和二氧化氮(NO2)的释放,与水接触后会形成亚硝酸【49】。亚硝酸可引起胺(例如DMA和DEA)的亚硝化,所述胺也存在于泡罩盖箔上使用的油墨中。亚硝胺可以在热封起泡过程中通过蒸发和冷凝转移到产品中。Schlingemann及其同事证实了硝化纤维素基油墨(在带状包装铝箔上)在NDMA形成中的作用[37]。事实上,即使当片剂被密封在铝条包装内时,也会形成NDMA,铝条包装显示出对硝酸纤维素、NO和NO2的优异阻隔性能。作者认为硝酸纤维素可能沉积在箔的内表面上,箔以圆柱形卷的形式提供。换句话说,硝酸纤维素可能已经渗透穿过玻璃纸层,并附着在通常与片剂接触的内部低密度聚乙烯层上[37]。因此,基于硝化纤维素的盖箔应该让位于不含硝化纤维素的盖箔。事实上,不含硝化纤维素的印刷油墨可商购获得,在铝箔和泡罩箔上具有优异的印刷性。然而,与其他因素相比,产生亚硝胺杂质的风险相对较低。
亚硝化反应抑制剂
当添加到固体剂量制剂中时,抑制剂可以通过充当氨基的竞争物来抑制亚硝胺的形成,氨基作为亚硝化剂的底物。例如,在一项研究中,这些抑制剂(抗坏血酸、抗坏血酸钠、α-生育酚(维生素E)、咖啡酸、丁基化羟基甲苯、丁基化羟基茴香醚和阿魏酸)在含有仲胺药物4-苯基哌啶盐酸盐(易形成亚硝胺)的制剂组合物中添加至1%浓度时,抑制亚硝胺生成超过80%[51]。据估计,在80%抑制下,在影响因素条件(50℃/75%RH,1个月)下,片剂中亚硝胺的量为7 ng,低于毒理学数据不足的N-亚硝胺毒理学关注阈值18 ng。抑制剂很可能通过氧化还原途径(将亚硝化剂还原为非亚硝化一氧化氮)或通过硝化反应减少亚硝胺的形成。具有伯胺基团的氨基酸如甘氨酸、赖氨酸和组氨酸凭借其重氮化作用已显示出作为液体剂型的潜在抑制剂的前景。
在温和酸性条件下,抗氧化防腐剂BHA(丁基羟基茴香醚)被亚硝酸盐转化为硝基苯酚,阻止了NDMA的形成[52]。有人提出,硝基苯酚可能经历代谢转化并形成有毒物质,如羟胺衍生物。BHA和亚硝酸盐之间的反应还导致另外八种化合物的形成,包括1-羟基-2-叔丁基-4-甲氧基-6-硝基苯[52]。最近的研究表明,硝基苯酚是一种非遗传毒性杂质,可以设定更高的阈值限度。
亚硝胺杂质的监管策略
对于含有单一亚硝胺的药品,FDA和EMA建议NDMA和NMBA的ADI不超过96 ng/天,NMBA的ADI不超过26.5 ng/天。NDEA、NMPA、NIPEA和NDIPA。这些限度假设患者每天暴露于药物产品70年,癌症风险为1:10 0,000。这些限度仅适用于制剂含有单一亚硝胺杂质的情况。FDA建议,如果药品含有一种以上机构列出的亚硝胺杂质,且亚硝胺杂质总量基于最大日剂量不超过26.5 ng/天,则制造商应寻求FDA的指导。
对于MDD(最大日剂量)<880 mg/天的药品,总亚硝胺限度为0.03 ppm(ppm=ADI(ng/天)/MDD(mg)),相当于不超过26.5 ng/天,被认为是可接受的[30]。另一方面,对于MDD大于880 mg/天的药品,作为高剂量的风险缓解策略,需要调整亚硝胺的限量,以便不超过26.5 ng/天的推荐限量[30]。需要定量限低于0.03 ppm的分析方法来准确定量不超过26.5 ng/天的亚硝胺总水平[30]。然而,针对API开发的最灵敏分析方法的LOQ为0.005(5 ppb)。药品中的LOQ可能要高得多。此外,由于最大日剂量超过1000mg,将需要灵敏度低于0.03 ppm的分析方法。
ADI不可用的亚硝胺的可接受摄入量可通过使用ICHM7(R1)指南[54-56]中提供的风险评估途径来确定。指南中描述的毒理学关注阈值(TTC)方法使用最敏感物种和最敏感肿瘤诱导部位的TD50(中位毒性剂量)数据,将产生50%肿瘤发病率(TD50)的剂量外推至1/106发病率的简单线性关系。对于大多数致突变污染物,1.5 μ g/天的TTC(相当于10-5的终生癌症风险)被认为是可接受的。然而,黄曲霉毒素样、N-亚硝基和烷基偶氮氧化合物已被确定为高效致突变致癌物为“关注队列”(COC)。对于COC化合物,低于TTC的暴露甚至会导致显著的癌症风险,这表明它们需要控制在低得多的限度[56]。根据ICHM7,应进行化合物特异性风险评估以得出ADI值。
多博等人。根据共同的结构特征将N-亚硝胺杂质分为13组[57]。根据组中存在的最有效的N-亚硝胺将ADI分配到组中。13组ADI用于将ADI分配给结构相关的复杂N-亚硝胺杂质。他们将N,N-二烷基亚硝胺(NDMA、NDEA等。)放在第1组中,并根据NDEA公布的ADI值为26.5 ng/天。第7组(N-烷基-N-烷-2-酮型N-亚硝胺衍生物)和第9组(N-亚硝基哌啶衍生物)为分别分配了最低(17 ng/天)和最高(499 ng/天)ADI。有趣的是,在7个组中,至少存在一种亚硝胺,其TD50值≥1.5 mg/kg/天,对应于ICH M7(R1)中未归类为COC的致突变杂质的可接受终生日摄入量1.5 μ g/天。在五组中,至少存在一种非致癌性N-亚硝胺,证实并非所有N-亚硝胺都是COC致癌物。根据作者的说法,复合N-亚硝胺的低致癌潜力可能是由于它们的空间和电子特性,这可能会阻止细胞色素介导的生物活化[57]。换句话说,α-碳的空间位阻和β-碳的吸电子基团与致癌效力的降低相关。亚硝胺原料药相关杂质(NDSRIs)是另一类亚硝胺,据报道在生产或有效期储存期间也会在某些药品中形成。这类亚硝胺在结构上类似于API。最近,辉瑞公司召回了喹那普利/氢氯噻嗪(HCTZ),原因是其未能达到亚硝胺ADI限值,并召回了戒烟药物伐尼克兰的最新批次,因为存在高于ADI水平的可能致癌物N-亚硝基伐尼克兰。FDA将N-亚硝基伐尼克兰的可接受限度设定为37 ng/天[60]。2020年4月,所有雷尼替丁产品在美国被召回[11]。2020年9月,EMA建议在欧盟暂停所有雷尼替丁药物[46]。该负面建议的主要原因是雷尼替丁本身在有效期内的降解导致了NDMA水平。Apotex Inc.生产的另一种含胺药品阿昔洛韦片也因存在高于ADI水平的NDMA而被召回[61]。同样,由于存在高于ADI水平的亚硝基奥芬那君杂质,Sandoz将13批枸橼酸奥芬那君100 mg缓释(ER)片剂召回至消费者水平[33]。FDA提出了多管齐下的控制策略,以将NDSRIs保持在可接受的水平以下,包括供应商资格认证计划、抗氧化剂的使用以及通过使用碳酸钠等赋形剂创造中性或碱性制剂微环境。
自2018年7月缬沙坦片剂中报告第一个亚硝胺杂质NDMA以来,超过每日ADI限值的亚硝胺的存在已导致超过1400种产品从美国市场召回/撤回。此后不久,在其他产品中检测到亚硝胺,包括氯沙坦、厄贝沙坦、二甲双胍和抗组胺药(雷尼替丁和尼扎替丁),导致召回。此次召回是由于存在致癌亚硝胺杂质NDMA、NDEA和NMBA。NDMA和NDEA已被国际癌症研究机构(IARC)、美国环境保护局(USEPA)和国家毒理学计划(NTP)作为具有已知致癌潜力的物质,而NMBA已被证明可诱导大鼠膀胱癌和肾癌[63]。含沙坦的药品被召回最多。此外,主要含有沙坦类药物和其他API(如缬沙坦/HCTZ、氯沙坦/HCTZ、氨氯地平/缬沙坦、氨氯地平/缬沙坦/HCTZ和厄贝沙坦/HCTZ)的组合药物产品也因ADI限值高于可接受阈值而被召回。
检测了二甲双胍原料药(251份样品)和二甲双胍成品(875份样品)是否存在亚硝胺杂质。在这些样品中检测到的唯一亚硝胺是NDMA。就二甲双胍API而言,检测的215个批次中有213个批次未显示可测量的NMDA水平,而在成品中,17.8%的样品(157个样品)的NMDA高于ADI水平。这意味着82.2%的二甲双胍药品样品符合质量和安全要求[64]。当分析来自患者的众包二甲双胍片剂的亚硝胺时,也获得了类似的结果。大约16%的样品的NMDA水平高于AI限值,在一个二甲双胍500 mg片剂样品中发现的最高NMDA水平为748 ng,约为ADI限值的31倍。在这项研究中,74%的样本中检测到DMF[65]。DMF具有与NDMA大致相同的分子量(74),除非使用具有合适灵敏度的分析方法,否则在二甲双胍分析期间DMF可能与NDMA混淆,这可能导致人为的高结果。
结论
缬沙坦片中NDMA的存在将亚硝胺问题推到了风口浪尖。在沙坦类中发现的四唑环被认为是NDMA和其他短烷基链亚硝胺形成的原因。然而,它们很快也在非沙坦类产品中被检测到,引起了对亚硝化剂形成机制和来源的担忧。例如,在N-亚硝基伐尼克兰的情况下,需要关注的是药物相关杂质。亚硝胺或其前体可以存在于成品剂型的任何组分中。为了将其在药品中的存在控制在ADI水平以下,一种有效的方法是评估所有制剂成分的风险,包括API、赋形剂、包装材料和制造工艺。建议不要使用容易产生亚硝胺的成分。在没有合适替代品的情况下,必须采取足够的措施将亚硝胺维持在ADI水平以下。必须广泛研究赋形剂生产途径,以确定可能导致亚硝胺形成的可能赋形剂成分。为了理解辅料的硝酸盐和亚硝酸盐负载、辅料供应商和成品制剂制造商之间的有效沟通至关重要。制造商不得仅依赖原料药和辅料的药典规范,还应制定和实施额外的策略来控制亚硝胺杂质。避免使用基于硝化纤维素的盖箔可以降低产品中亚硝胺杂质的风险。该制剂可以补充亚硝化抑制剂,如维生素C,以停止亚硝胺的产生。

来源:文亮频道


