您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-07-09 20:53
前言
药械组合(Drug-Device Combinations,DDCs)产品指由药品与医疗器械共同组成,并作为一个单一整体上市的医疗产品。常见的一体式药械组合(Integral DDCs)产品有含药物涂层的血管支架、带抗菌涂层器械或预装药物递送套件(如预装针剂)等。药械组合产品按首要作用方式分为以药品作用为主的DDCs和以医疗器械作用为主的DDCs。药械组合产品拟申报前,应充分评估其产品属性,不确定的需向药监局申请药械组合产品属性界定。以药品作用为主的DDCs常见产品有利培酮口服给药系统、Erdafitinib膀胱内给药系统、钇[90Y]微球注射液、一次性使用平板型血液滤过器等;以器械为主的药械组合产品常见有药物洗脱支架、他克莫司泪点栓塞、可注射生物活性骨修复材料、关节软骨修复支架等。本文主要总结了以医疗器械作用为主的DDCs产品的药代动力学研究法规要求,并通过两类器械产品药代动力学研究分析,以期为药械组合产品研究提供参考。
指导原则要求
根据中国国家药监局2022年发布的《以医疗器械作用为主的药械组合产品注册审查指导原则》[1]建议,药械组合医疗器械重点关注药物局部应用的安全性和有效性,组合应用后血药浓度大于常规药物使用的血药浓度时,也需对系统毒性进行评价。对于DDCs中的药物活性成分,建议优先采用已批准上市销售的药物,提供药物已有的吸收、分布、代谢、消除等信息。如果组合后的产品可能引起体内药代动力学(PK)特征改变的,如载药量或给药途径改变等,则建议开展临床前研究,提供产品的PK信息,也可以在医疗器械动物试验中合并评价药物自身的药代动力学,不单独开展药代动力学试验。虽然药械组合医疗器械的血药浓度通常远低于单独作为药物使用后的浓度,但局部组织浓度可能会远高于药物血药浓度,所以应特别关注局部组织浓度变化情况。体内的药代动力学研究需考虑多个产品联合应用的情形,因此建议评估最高药物暴露剂量水平下的药代动力学。
欧盟委员会2009年发布指导原则《Medical Devices: Guidance document》[2],根据组合产品的整体性(integral)和药物的辅助性(ancillary),将相关产品分为医疗器械(Medical devices)和医药产品(Medicinal products)。根据欧盟委员会指导原则建议,通常情况下,如果组合产品中药物成分是已上市药物,则可以使用已有的文献、书籍数据等支持该产品的安全性和有效性,不需要单独开展药代动力学实验。如果组合产品包含未上市或未经披露的药物活性成分,需要按新药申报要求开展实验。如下数据需酌情提供:
组合产品中药物成分的局部和系统暴露情况;
当药物暴露水平(AUC)波动时,应考虑最高暴露水平和持续时间;
DDCs中药物的暴露量较高可能达到毒性水平时,应考察药物最高暴露水平下的药代动力学特征,并关注个体差异;
药械组合后,如果有新的活性物质产生,则需要考察该活性物质的吸收、分布、代谢和排泄情况。
根据FDA 2006年发布的《Early Development Considerations for Innovative Combination Products》建议[3],如果DDCs产品中药物成分使用了新的剂型、规格或给药途径等,或患者人群、适应症改变,则需要开展额外的体内药代动力学研究,评估暴露量、持续时间或药物分布的改变,如释放速率、药物的局部峰浓度、局部分布和全身生物利用度(Cmax、Tmax等)。
药械组合产品类型多样,通用指导原则仅对常见DDCs产品提供一般建议。对于特定DDCs产品,需要在通用指导原则基础上,结合特定产品的研究指导原则具体分析。以器械作用为主的DDCs产品中两种常见药物递送形式是药物洗脱支架(DES)或球囊(DCB)和预填充给药系统,以下将对这两种DDCs相关指导原则和药代动力学研究内容做详细介绍。
药物洗脱支架(DES)或球囊(DCB)
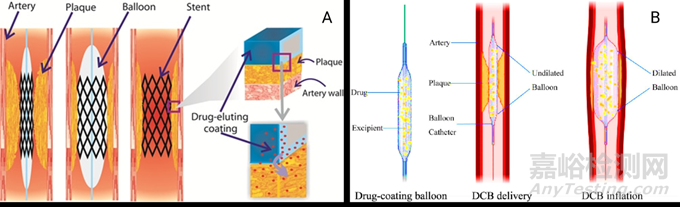
图1. DES(A)和DCB(B)示意图[4,5]
对于如动脉粥样硬化导致的血管狭窄等腔内血管疾病,药物洗脱支架(Drug-Eluting Stent, DES)是一种行之有效的介入治疗方法。通过介入手术将DES植入病变血管内,DES的含药涂层缓慢释放药物,根据载药类型不同,可发挥抑制血管平滑肌增生、促进内皮生长、抗凝抗血栓或抗炎抗菌作用。此法既能最大化病灶部位的药物吸收,发挥药物如抑制新内膜增生作用,降低再狭窄率;同时DES靶向性好,全身副作用小。
药物涂层球囊(Drug-Coated Balloon, DCB)是近年新兴的一种介入治疗手段,体现了“介入无植入”的新型介入理念。其通过球囊扩张把抗增殖药物带到血管壁上并均匀释放,抑制血管内皮细胞、平滑肌细胞和成纤维细胞,发挥减少球囊扩张后再狭窄的作用,常用于支架内再狭窄、分叉病变、小血管病变以及有出血倾向的患者。
裸支架或球囊在DES或DCB产品中对恢复血管的通畅性和改善血流有重要支撑性作用,药物的应用对减少血管内膜增生和炎症反应及降低血管再狭窄的风险亦具有关键的助力作用。而DES或DCB中药物药代动力学特征评估可以反映局部血管毒性,了解药物释放动力学,将有助于从源头设计DES或DCB的药物释放,实现最佳的药物递送方式及递送量,降低局部血管毒性风险。
根据欧洲药品管理局2008年发布的指导原则《Guideline on the Clinical and Non Clinical Evaluation During the Consultation Procedure on Medicinal Substances Contained in Drugeluting (Medicinal Substance-Eluting) Coronary Stents》[6],可以将DES产品分为以下A、B、C、D四类,具体如下:
1. 该组合产品中的药物成分已经在上市的组合产品中使用;
a) 和上市产品有类似的药物释放特征(A):
i.相同的支架材料、涂层和相同的递送系统;
ii. 相同的支架材料,不同的涂层和递送系统;
iii. 不同的支架材料,相同的涂层和递送系统;
iv. 不同的支架材料,不同的涂层和递送系统。
b) 和上市产品无类似的药物释放特征(B);
2. 药物成分是已披露或已上市的药物但未在药效组合产品中使用(C);
3. 药物成分是新的活性物质(D)。
对于Ai类DES产品,非临床药代动力学可以仅开展体外实验,如药物体外溶出实验,以获得药物体外释放动力学数据。对于Aii-iv、B、C、D类组合DES产品,开展临床前实验研究药物成分的药代动力学特征,应着重考虑组织、器官和全身系统的药物暴露量和持续时间。此外,支架的几何形状、组织相容性和药物疏水性等可能影响药物的体内药代动力学特征,开展临床前实验研究时应考虑这些影响的因素。
根据中国国家药监局2018年发布的《冠状动脉药物洗脱支架临床前研究指导原则》[7]以及2023年发布的《药物涂层球囊扩张导管注册审查指导原则》[8],开展DES或DCB相关产品的体内药代动力学研究时,建议对血液、治疗部位血管组织、上游或下游肌肉/组织及远端组织,例如跟腱、肝脏、肺和肾脏等组织器官中的药物浓度进行分析,动态观察上述部位药物浓度的出现、达到峰值水平、低于定量限的变化趋势。药代动力学研究中,也需考虑DES或DCB重叠使用以及药物剂量安全范围上限,以评估最高药物暴露剂量水平下的药代动力学信息。此外,在药代动力学实验中合并考察药物的安全性,即安全边际(Safety Margin)剂量研究,以评估临床治疗剂量与中毒剂量间的范围,充分保证动物试验的药物安全性结果能外推到各种临床条件下的安全使用。安全边际剂量通常是数倍于药物涂层球囊的治疗剂量,一般推荐选择3-5倍的治疗剂量,常采用4倍剂量。
种属选择
常见动物的血管结构和人存在固有差异,但长期研究表明,在动物中开展局部血管毒性和药代动力学等研究仍是必要且可行的[9,10]。在众多动物模型中,猪的心血管系统在解剖结构、脂蛋白代谢机制、系统功能特点、药物反应性等方面与人类具有良好的相似性,并且猪的侧支血管较少[11]。支架植入后内膜生长随时间变化的特征类似于人,可以通过猪冠状动脉支架模型预测支架诱导的血栓形成;另外,猪的正常血液学常数和血液动力学参数的测定值与人类近似,其凝血因子和纤溶活性与人的相近程度远远优于其它动物,并且猪与人类心肌细胞内均缺乏可促进大量氧自由基产生的黄嘌呤氧化酶系,且巴马猪良好的机体承受能力保证了损伤模型建立的可行性及术后存活率,因此小型猪经常被用于DEC和DCB临床前研究的动物种属。此外,兔髂动脉的尺寸、分布和损伤反应也与人体血管类似,兔的动脉壁比猪更坚固,操作过程中不易破裂,所以兔也常被用做DEC和DCB临床前早期研究的替代种属[12]。
临床前PK试验设计
对于新的DCB或DES产品,首先建议通过数据调研确定DDCs产品分类(如A、B、C或D等)。对于B、C、D类DDCs产品,开展临床前PK实验研究时,根据适应症,选择适当规格器械,模拟临床治疗剂量。通过测定血药浓度(每个时间点不少于3个平行)计算相关PK参数,包括血药浓度-时间曲线下面积(AUC)、峰值血药浓度(Cmax)、达峰时间(Tmax)、消除半衰期(T1/2)以及总体清除率(CLt)等。此外,根据具体的DES或DCB特征,局部组织浓度测定对DDC有着重要作用,如下研究内容可作为补充:
设置常规剂量和最高暴露治疗剂量两个剂量组,研究药物体内药代动力学特征变化及安全边际剂量;
监测DES或DCB治疗血管部位组织的药物浓度;
监测DES或DCB近和远端血管组织中的药物浓度;
监测DES或DCB远段组织(如跟腱、肝脏等)中的药物浓度;
测药物浓度低于定量限。
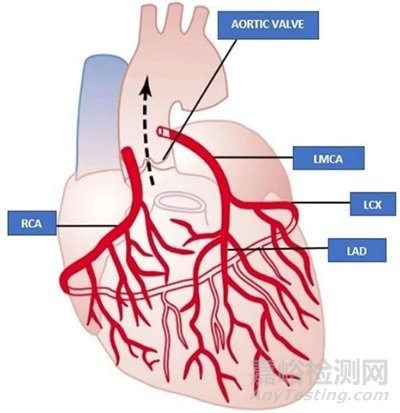
图2. 冠状动脉示意图。
LMCA:左冠状动脉主干,LAD:左冠状动脉前降支,LCX:左旋冠状动脉,RCA:右冠状动脉[13]
案例分析
如图2冠状动脉分布示意图,一般可以在LAD、LCX和RCA中单独或同时植入支架。在一项关于雷帕霉素洗脱支架的研究中,通过分析支架上剩余药物浓度可以看到支架植入1天后药物在迷你猪体内累计释放可达50%,随后药物释放速率逐渐降低,植入60天后药物累计释放约90%,并在120天后全部释放。冠状动脉组织中药物浓度显示,植入1天后药物浓度逐渐升高并在90天时达到峰值,120天后药物浓度迅速下降,但仍维持在较高水平。支架植入1天后药物在肝、肾和肺等组织中的浓度即达到峰值,14天后仅有少量药物,30天后药物浓度低于定量下限。整个实验过程在血浆中药物浓度均低于定量下限[14]。另一项关于紫杉醇洗脱支架研究显示,血浆中的药物在12小时内完全消除(如图3)[15],随着药物的缓慢释放,药物由血管组织逐渐分布到近心肌和远端组织中,这也印证了支架药物涂层的局部组织释放的特征。
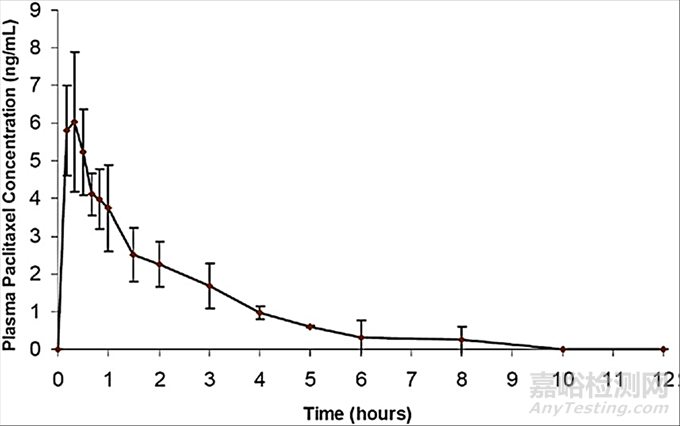
图3. 支架植入后迷你猪血浆PK曲线[15]
预填充给药系统
另一种常见的DDCs药物递送是以预装针剂(Prefilled syringes, PFS)为代表的预填充给药系统。以药物治疗作用为主的PFS归于药品范畴,在此不做讨论。以器械作用为主的PFS主要包含医美行业的含药软组织填充产品和美容针产品等(如除皱针或水光针)。预填充给药系统结合药物使用方式,通常是在软组织填充剂或美容剂中添加麻醉药成分,通过局部麻醉减轻注射时造成的疼痛,辅助器械使用。
PFS产品使用时注射角度、深度、注射时间、组织创伤程度及因操作导致的个体差异等均可能影响药物在体内的药代动力学特征。根据FDA指导原则《Bridging for Drug-Device and Biologic-Device Combination Products Guidance for Industry》建议[16],如有类似PFS产品已上市,如相同的适应症、剂量、剂型和给药途径等,新PFS产品申请前应评估药物PK特征是否类似。若PK特征基本无变化,则不需要开展临床前PK或毒理实验;如果新产品的Cmax或AUC等PK特征有变化,则需要评估这些差异可能产生的临床影响。
种属选择
根据使用目的不同,大小鼠、兔和猪等都可以用于皮肤给药的动物种属[17,18]。猪皮和人的皮肤具有相似的组织学结构、皮肤厚度、毛囊结构、皮下脂肪、皮下血管、胶原结构及其排列方式等[19]。Bartek等通过放射性同位素实验比较了几个常见药物在大鼠、兔、小型猪和人的经皮吸收(Percutaneous absorption)差异。如图4显示,药物经皮肤渗透吸收水平由高到低依次为兔、大鼠、小型猪和人。小型猪和人的经皮吸收曲线最为接近,具有相似的的吸收速率和吸收程度[20],在医美产品的器械研究中4月龄的巴马猪是最优选择。
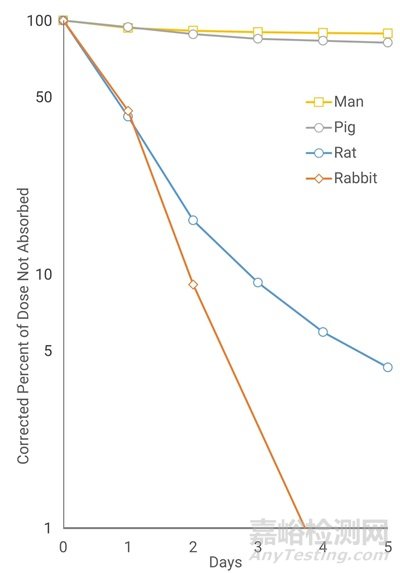
图4. 大鼠、兔、小型猪和人经皮吸收曲线[21]
临床前PK试验设计
如前所述,PFS产品使用时,注射方式、注射深度或注射体积等可能产生不同的药物药代动力学特征,开展PK实验时应结合DDCs产品临床使用场景,合理设计动物给药,尽量保持给药操作(如注射深度和体积等)和临床一致。评估PFS产品中药物成分的PK特征时,一般设置一个剂量单次给药,剂量选择临床使用的最高剂量。还应考虑载药基质对药物清除半衰期的影响,必要时应适当延长采样时间,以获得更完整的PK曲线。每个采样点建议设置3-5个平行以评估动物个体差异。局麻药物本身具有体内快速清除的特点,且伴随DDCs产品使用的浓度较低,如美容针剂中lidocaine加入量仅0.3%左右,PK研究时定量下限应在pg/mL级。PFS中含药成分比类似产品剂量高时(或暴露量高于药物单独使用时的暴露量),也可以设置血管内给药组以评估药械组合后药物成分的生物利用度等。建议针对具体的DDCs产品case-by-case设计实验。
案例分析
交联的透明质酸(cross-linked hyaluronic acid (cHA))常被作为组织填充剂注射至面部皮肤,实现支撑填充或除皱的医美目的。有实验研究了两种常用局麻药(lidocaine和mepivacaine)在两个医美使用场景的cHA凝胶(PNT-1和PNT-4)中的体内、外动力学特征。如图5A所示,cHA凝胶对药物有缓释作用,但两种交联程度的cHA对药物体外释放特征没有影响,药物均在6小时内基本完全释放。载药cHA经大鼠皮下给药后,药物在大鼠体内迅速吸收并快速消除,血浆半衰期为1~2小时(图5B)。
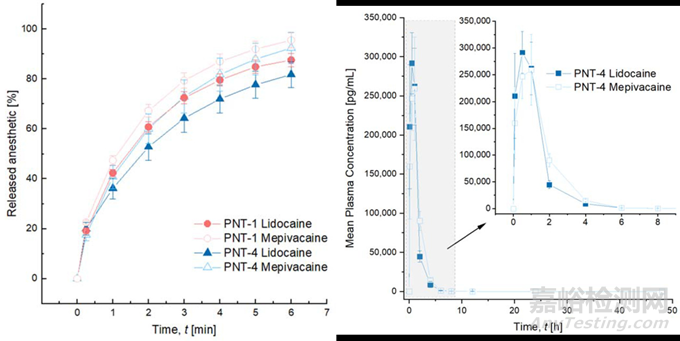
图5. 载药cHA填充剂体外溶出(A)和体内PK曲线(B)[22]
结语
DDCs产品兼具器械和药物特征,受药品和医疗器械双重监管。药械组合使药物借助器械发挥作用,药物的DMPK性质可能会在组合后被放大或缩小或产生新的DMPK特征。为了评估临床前有效性或安全性风险,应根据全球不断完善的法规要求,充分研究药械组合后药物的药代动力学特征变化,提供充分的临床前数据支持。药明康德有全面的临床前动物实验测试和DMPK评价平台,可高效助力DDCs产品研发及申报。
参考文献:
[1]. 以医疗器械作用为主的药械组合产品注册审查指导原则
[2] Medical Devices: Guidance document, European Commission
[3] Early Development Considerations for Innovative Combination Products, FDA
[4] https://translumina.com/in/different-types-of-stents
[5] Cao Z, Li J, Fang Z, et al. The factors influencing the efficiency of drug-coated balloons[J]. Frontiers in Cardiovascular Medicine, 2022, 9: 947776.
[6] Guideline on the clinical and non clinical evaluation during the consultation procedure on medicinal substances contained in drugeluting (medicinal substance-eluting) coronary stents, European Medicines Agency, 2008
[7] 冠状动脉药物洗脱支架临床前研究指导原则,NMPA,2018
[8] 药物涂层球囊扩张导管注册审查指导原则,NMPA,,2023
[9] Virmani R, Kolodgie F D, Farb A, et al. Drug eluting stents: are human and animal studies comparable?[J]. Heart, 2003, 89(2): 133-138.
[10] Tesfamariam B. Local vascular toxicokinetics of stent-based drug delivery[J]. Toxicology letters, 2007, 168(2): 93-102.
[11] Lowe H C, Schwartz R S, Mac Neill B D, et al. The porcine coronary model of in‐stent restenosis: current status in the era of drug‐eluting stents[J]. Catheterization and cardiovascular interventions, 2003, 60(4): 515-523.
[12] Horvath C, Welt F G P, Nedelman M, et al. Targeting CCR2 or CD18 inhibits experimental in-stent restenosis in primates: inhibitory potential depends on type of injury and leukocytes targeted[J]. Circulation research, 2002, 90(4): 488-494.
[13] Mahanta D, Parhi D K, Gadade S V, et al. A Single Coronary Artery From the Left Coronary Sinus: The Continuing Conundrum[J]. Cureus, 2023, 15(9).
[14] Chen S, Yao Z, Guan Y, et al. High nitrogen stainless steel drug-eluting stent-Assessment of pharmacokinetics and preclinical safety in vivo[J]. Bioactive Materials, 2020, 5(4): 779-786.
[15] Dake M D, Van Alstine W G, Zhou Q, et al. Polymer-free paclitaxel-coated Zilver PTX stents—evaluation of pharmacokinetics and comparative safety in porcine arteries[J]. Journal of Vascular and Interventional Radiology, 2011, 22(5): 603-610.
[16] Bridging for Drug-Device and Biologic-Device Combination Products, FDA
[17] Ramly E P, Kantar R S, Alfonso A R, et al. Preclinical animal models in facial transplantation[J]. Plastic and Reconstructive Surgery Global Open, 2019, 7(9).
[18] Zhang Y J, Yin Q Q, Gong D Y, et al. The preclinical pharmacological study of a novel long-acting local anesthetic, a fixed-dose combination of QX-OH/Levobupivacaine, in rats[J]. Frontiers in Pharmacology, 2019, 10: 895.
[19] Sullivan T P, Eaglstein W H, Davis S C, et al. The pig as a model for human wound healing[J]. Wound repair and regeneration, 2001, 9(2): 66-76.
[20] Bartek M J, Labudde J A, Maibach H I. Skin permeability in vivo: comparison in rat, rabbit, pig and man[J]. Journal of Investigative Dermatology, 1972, 58(3): 114-123.
[21] Brusini R, Iehl J, Clerc E, Gallet M, Bourdon F, Faivre J. Comparative Preclinical Study of Lidocaine and Mepivacaine in Resilient Hyaluronic Acid Fillers. Pharmaceutics. 2022 Jul 26;14(8):1553. doi: 10.3390/pharmaceutics14081553. PMID: 35893810; PMCID: PMC9329866.

来源:药明康德DMPK


