您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2024-08-12 19:39
目的:比较我国现行《血液制品病毒去除/灭活验证指导原则》[国药监注(2002)160号]与世界卫生组织(WHO)《血液制品病毒去除/灭活验证指南》,旨在推动我国血液制品病毒风险控制与管理水平的提高及血液制品的合理应用。
方法:从去除/灭活病毒方法的选择、常用去除/灭活病毒方法评价、特定的去除/灭活病毒方法验证、生产工艺去除/灭活病毒能力、去除/灭活病毒方法再验证、临床试验、输血用病毒灭活血浆和正在开发的新型病毒灭活方法等几个方面进行比较,对血浆及其制品生产工艺中病毒灭活/去除的相关方法及其验证进行研究。
结果与结论:我国现行《血液制品病毒去除/灭活验证指导原则》与WHO《血液制品病毒去除/灭活验证指南》总体要求基本一致,对我国血液制品去除/灭活病毒技术方法与验证工作仍具有适用性和指导性。
血液制品(Blood Products)指源自人类血液或血浆的治疗产品,如人血白蛋白、人免疫球蛋白和人凝血因子等[1],是由健康人的血浆或特异免疫人血浆分离、提纯制成的治疗产品,用于诊断、治疗或被动免疫预防。但通过血浆和纯化血浆制品传播血源性病毒仍然被认为对使用者构成风险。历史上与血液制品相关的主要具有威胁性的病毒主要有乙型肝炎病毒(Hepatitis B Virus,HBV)、丙型肝炎病毒(Hepatitis C Virus,HCV)、人类免疫缺陷病毒(Human Immunodeficiency Virus,HIV)、甲型肝炎病毒(Hepatitis A Virus,HAV)和细小病毒B19等[2]。因此,血液制品病毒的安全性控制尤为重要。目前,指导我国血液制品病毒去除/灭活工作的主要依据为《血液制品去除/灭活病毒技术方法及验证指导原则》(国药监注[2002]160号)(以下简称《指导原则》)[3]。国际上主要参考世界卫生组织(WHO)技术报告中的《病毒去除/灭活验证指南》(以下简称《WHO指南》)[2]及欧盟和美国各自的有关规定。为此,本文对我国《指导原则》与《WHO指南》中有关去除/灭活病毒方法的选择、常用去除/灭活病毒方法评价、特定的去除/灭活病毒方法验证、生产工艺去除/灭活病毒能力、去除/灭活病毒方法再验证、临床试验、输血用病毒灭活血浆以及正在开发的新型病毒灭活方法等方面进行比较和阐述,以期为血液制品病毒安全性提供参考。
1、我国血液制品去除/灭活病毒技术方法及验证指导原则的历史沿革
20世纪80年代前后,法国、日本、加拿大和英国等国家相继发生因血液制品中含有艾滋病病毒和丙型肝炎病毒等导致成千上万人群感染艾滋病和丙型肝炎的重大事件[4]。为了提高我国血液制品的安全性,使我国血液制品病毒去除/灭活工作与WHO血液制品病毒去除/灭活指南接轨,中华人民共和国卫生部和国家药品监督管理局组织有关专家先后对“卫药政发(1994)第264号”和“卫药生发(1997)第443号”做了进一步修改和完善,对国内在血液制品病毒去除/病毒灭活方法及其验证和论证程序方面提出初步要求。国家药品监督管理局于2002年发布了《指导原则》,从不同制品去除/灭活病毒方法的选择、常用的去除/灭活病毒方法评价以及去除/灭活病毒的方法验证等5个方面进行了规范。
2、去除/灭活病毒方法的选择
《指导原则》中对不同类血液制品选择的去除/灭活病毒方法侧重点提出大致要求,基本原则是应有特定的能去除/灭活脂包膜和非脂包膜病毒的方法,可采用一种或多种方法联合。
《WHO指南》虽然没有对不同血液制品类别明确提出侧重点建议,但在已上市血液制品已建立的专用病毒灭活和清除程序汇总表中进行了举例。这些举例对生产企业来说参考性和实用性更强。
3、常用去除/灭活病毒的方法评价
《指导原则》中主要提供了5种常用的灭活/去除病毒方法,包括巴氏消毒法、干热法、有机溶剂/去污剂处理法、膜过滤法和低pH孵放法等,并对每种方法的参数、技术要点有明确要求,具体见表1。


表1 常用去除/灭活病毒方法
其中,膜过滤法是《指导原则》中唯一的病毒去除的方法,该方法的主要作用机制是粒径排阻分子筛和吸附。在生产过程中企业常采用35~50 nm孔径的膜去除病毒,随着制品生产过程中纯化水平的提高,目前15~20 nm孔径的膜也常有应用。该方法可去除大部分病毒,尤其对细小病毒B19可有效去除。该方法可串联、针对性强、下游污染少、蛋白回收率高,便于整合到工艺过程的多个工段。但由于过滤器滤膜只能一次性使用,成本较高。随着人们对滤膜研究的深入了解,不同滤膜生产企业的滤膜性能存在差异,预过滤层和精密截留层应考虑不同品牌滤膜和不同批次过滤器滤膜性能的一致性和适用性。如果工艺中有可能使用预过滤器,在设计验证研究时,必须确定是否使用了预过滤器以及如何将其纳入研究设计。一些蛋白呈现出时间依赖性的聚体倾向,尤其会在冻存过程产生聚体,因此,应考虑放置时间与冻存的影响。无论是高流速低通量还是低流速高通量,除病毒过滤的过程一般要保证连续过滤,压力中断可能导致病毒穿透的风险外,还应考虑膜过滤去除病毒过程中出现的压力释放情况,需如何评价和处理。
《WHO指南》中对公认的病毒去除/灭活方法进行了比较详尽的综述,分为病毒灭活和病毒去除两部分,并在病毒灭活方法部分增加蒸汽加热法,在病毒去除方法部分增加沉淀法和色谱法,并对每种方法在优点、注意事项和需记录的关键参数方面进行了详细汇总。见表2、表3。
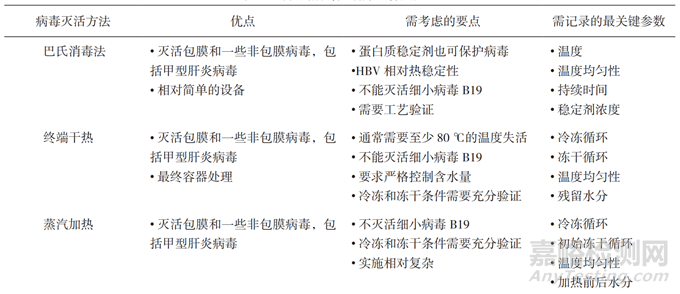

表2 公认的病毒灭活方法特点汇总

表3 公认的病毒去除方法特点汇总
4、特定的去除/灭活病毒方法验证
《指导原则》在方法验证部分包括指示病毒的选择、方案设计、观察指标和效果判定。
4.1指示病毒的选择
《指导原则》和《WHO指南》中均列举了HIV、HBV和HCV 3种主要的指示病毒,并在基因组、脂包膜和大小等特性方面进行了描述。所选择的指示病毒至少应包括HIV-1、HBV和HCV模拟病毒以及非脂包膜病毒。《指导原则》和《WHO指南》的汇总见表4。
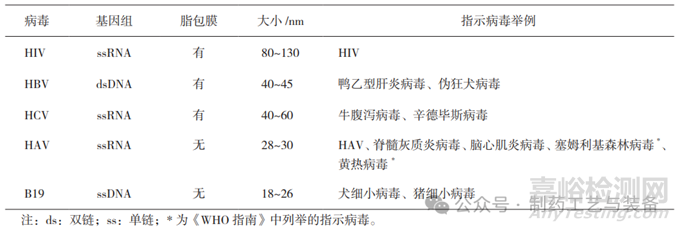
表4 经血液传播疾病的相关病毒及验证可选用的指示病毒(举例)
塞姆利基森林病毒是一种与疾病的关系尚未明确的披膜病毒科虫媒病毒,从很多种蚊虫和某些没有临床症状的鸟和动物宿主中分离出来。病毒学和血清学研究结果表明,该病毒广泛分布于非洲,可能也分布于南亚和南欧。由于国内研究甚少,国内未选择将其作为指示病毒。黄热病毒与登革病毒、寨卡病毒、西尼罗病毒和乙型脑炎病毒抗体等有较强的交叉反应,我国是登革热和乙型脑炎流行区,人群中有较高的抗体背景,因此,黄热病毒也不适合作为指示病毒。
4.2方案设计
《指导原则》从8个方面对方案设计进行了明确要求,《WHO指南》则分散在不同段落予以描述。总体来讲,二者的要求基本一致,但我国的《指导原则》要求更具体,参考性和操作性更强。二者的比较见表5。
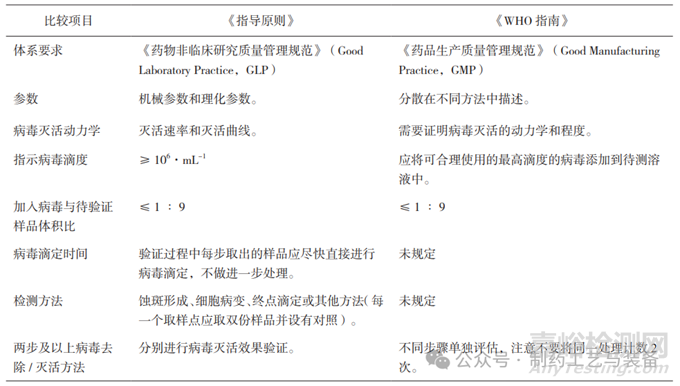
表5 《指导原则》与《WHO 指南》在方案设计方面的比较
4.3观察指标
《指导原则》分别在病毒方面、病毒去除/灭活各参数允许变化范围、蛋白质方面进行了相关规定,《WHO指南》未对观察指标进行总上体的明确要求,在一般注意事项和各灭活方法部分进行部分描述。二者的比较见表6。

表6 《指导原则》与《WHO指南》在观察指标方面的比较
4.4效果的判定
《指导原则》中对病毒去除/灭活验证的效果判定标准有明确规定,《WHO指南》中未明确表明判定标准,在一般注意事项和传染源等部分有相关描述。二者的比较见表7。

表7 《指导原则》与《WHO指南》在效果判定的比较
5、生产工艺去除/灭活病毒能力的验证需要特殊考虑的问题
《指导原则》从6方面强调了生产工艺去除/灭活病毒能力验证过程中需要特殊考虑的问题。归纳为步骤选择、工艺参数、病毒选择、核酸扩增技术、有效病毒去除步骤的判定及验证目的。《WHO指南》未明确列出,在一般注意事项及方法描述各部分有所提及。二者的比较见表8。
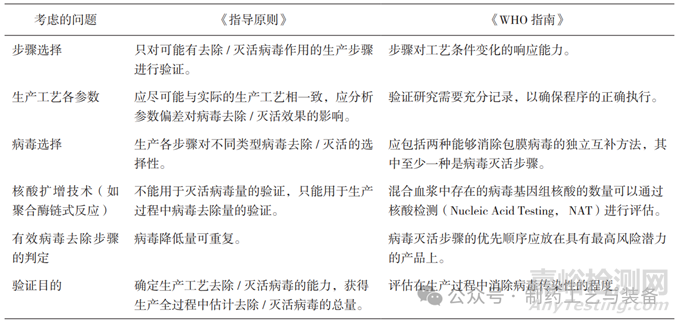
表8 验证需要特殊考虑的问题
6、研发中的新型去除/灭活病毒方法
随着科学技术的进步,一些新的去除/灭活病毒技术也在血液制品生产中有所应用,可提供更广泛的病毒覆盖范围、补充现有方法、降低成本和/或提高新鲜冷冻血浆(Fresh Frozen Plasma,FFP)的适用性。我国《指导原则》中未具体涉及这部分内容,《WHO指南》中对研发中的新型去除/灭活病毒方法进行了综述,例如采用补骨脂素S-59联合使用A波段紫外线(Ultra-violet A,UVA)处理,可灭活血浆中的病毒;254 nm波长紫外照射(Ultra-violet C,UVC)在人血白蛋白和人免疫球蛋白灭活病毒中的应用;60Coγ射线辐照;碘浓度为1.05 mg·mL-1的淀粉结合碘导致模型脂质包膜和非包膜病毒失活7 logs以上等方法。在许多情况下,这些方法几乎没有临床验证,故在实际血液制品生产中的使用意义不大。因此,我国《指导原则》中未具体提及这些方法。虽然我国有的血液制品企业也在研究60Coγ射线辐照、UVC等新型病毒灭活/去除方法,但是由于照射可能会造成蛋白质损害、蛋白活性失活、制品存储期间稳定性降低、污染环境等多方面影响,限制了这些新方法的应用和国家药品监管机构的认可。
7、其他比较
除了上述几大方面比较外,本文还从其他细节方面对我国《指导原则》和《WHO指南》进行比较,具体见表9。

表9 《指导原则》和《WHO指南》的其他比较
8、讨 论
经过数十年的努力,关于供血浆者筛查、供血浆者和血浆检测、生产工艺引入特定去除/灭活病毒方法3方面,我国相继发布了各种法规条例,通过多种控制措施确保血液制品的病毒安全性,包括《血液制品管理条例》、GMP、《单采血浆站管理办法》《关于实施血液制品生产用原料血浆检疫期的通知》[5-8]《指导原则》等。另外,2020年版《中国药典》新增“生物制品病毒安全性控制”相关内容[1],对生物制品病毒安全性控制从风险评估、全过程控制和全生命周期管理3方面进行了指导,不同类别生物制品病毒安全性控制要点中明确表明,人血液制品起始原材料为健康人血浆,存在经血液传播病毒的安全性风险,人血液制品的病毒安全性控制应包含生物制品病毒安全性控制的所有要素,重点应考虑人血浆来源的病毒风险控制和生产工艺的病毒清除能力,必要时应实施对上市产品病毒安全性的追溯。
《指导原则》自2002年发布以来,在去除/灭活病毒技术方法研究方面不断取得进展,如使用核黄素和基于紫外线的光化学处理法[9-10]、过氧化氢和电子束辐照法[11]、阿莫沙林/紫外线A光或阿莫他林/谷胱甘肽法[12-13]、氧依赖性激光灭活法[14]、铁电絮凝法[15]、连续蛋白A层析法[16]和脉冲电晕放电等离子体法[17]等。近年来,新的去除/灭活病毒技术发展积累了新的病毒清除验证认识,检验检测技术也有了提高,质量控制和监管理念也有所创新。《中国生物制品规程》也已并入《中国药典》2005年版三部,经过2010、2015和2020年版《中国药典》三部不断升级改版,其中血液制品的质量标准也不断提升。因此,在下一版《指导原则》修订时,建议考虑对新的去除/灭活病毒技术方法如蒸汽加热法、补骨脂素S-59 联合UVA法的考量,对S/D法处理后有机溶剂/去污剂残留量的考量,去除/灭活病毒方法再验证情况增加更换新生产线、新去除/灭活病毒设备,以及涉及再验证的工艺变更的界定等,以提高《指导原则》的适用性和指导性。
参考文献
[1] 中华人民共和国药典:三部[S]. 2020:25-702.
[2] WHO Technical Report,Series No.924,Annex 4,Guidelines on Viral Inactivation and Removal ProceduresIntended to Assure the Viral Safety of Human Blood PlasmaProducts[S]. 2004:150-224.
[3] 国家药品监督管理局药品审评中心. 血液制品去除/灭活病毒技术方法及验证指导原则[EB/OL].(2008-09-04)[2022-12-06]. https://www.cde.org.cn/zdyz/domesticinfopage?zdyzIdCODE=1df43aa707869a9c8bc11afe1ed48ff1.
[4] National Hemophila Foundation(NHF). History ofBleeding Disorders[EB/OL]. (2014-03-04)[2022-12-06]. http://www.hemophilia. org/Bleeding-Disorders/History-of-Bleeding-Disorders.
[5] 中华人民共和国国务院. 血液制品管理条例(中华人民共和国国务院令第208号)[EB/OL].(1996-12-06)[2022-12-06]. https://www.nmpa.gov.cn/xxgk/fgwj/qita/19961206010101537.html.
[6] 中华人民共和国卫生部. 药品生产质量管理规范(2010年修订)[EB/OL].(2011-01-17)[2022-12-06]. https://gkml.samr.gov.cn/nsjg/bgt/202106/t20210629_331742.html.
[7] 国家食品药品监督管理局. 单采血浆站管理办法[EB/OL].(2012-01-10)[2022-12-06]. https://www.nmpa.gov.cn/xxgk/fgwj/qita/20120110145001374.html.
[8] 国家食品药品监督管理局. 关于实施血液制品生产用原料血浆检疫期的通知[EB/OL].(2007-07-18)[2022-12-06]. https://www.nmpa.gov.cn/xxgk/fgwj/gzwj/gzwjyp/20070718010101836.html.
[9] Keil SD,Bengrine A,Bowen R,et al. Inactivationof Viruses in Platelet and Plasma Products Using aRiboflavin-and-UV-based Photochemical Treatment[J].Transfusion,2015,55(7):1736-1744.
[10] Zhang S,Gao L,Wang P,et al. A minimally ManipulatedPreservation and Virus Inactivation Method for Amnion/Chorion[J]. Front Bioeng Biotechnol,2022,10:952498.
[11] Cusinato R,Pacenti M,Martello T,et al. Effectivenessof Hydrogen Peroxide and Electron-beam IrradiationTreatment for Removal and Inactivation of Viruses inEquine-derived Xenografts[J]. J Virol Methods,2016,232:39-46.
[12] Laughhunn A,Huang YS,Vanlandingham DL,et al.Inactivation of Chikungunya Virus in Blood ComponentsTreated with Amotosalen/Ultraviolet A Light or Amustaline/Glutathione[J]. Transfusion,2018,58(3):748-757.
[13] Lanteri MC,Santa-Maria F,Laughhunn A,et al.Inactivation of a Broad Spectrum of Viruses and Parasitesby Photochemical Treatment of Plasma and Platelets usingAmotosalen and Ultraviolet A Light[J]. Transfusion,2020,60(6):1319-1331.
[14] Kingsley D,Kuis R,Perez R,et al. Oxygen-dependentLaser Inactivation of Murine Norovirus Using Visible LightLasers[J]. Virol J,2018,15(1):117.
[15] Kim K,Narayanan J,Sen A,et al. Virus Removal andInactivation Mechanisms during Iron Electrocoagulation:Capsid and Genome Damages and Electro-FentonReactions[J]. Environ Sci Technol,2021,55(19):13198-13208.
[16] Goussen C,Goldstein L,Brèque C,et al. ViralC l e a r a n c e C a p a c i t y b y C o n t i n u o u s P r o t e i n AChromatography Step Using Sequential Multi ColumnChromatography[J]. J Chromatogr B Analyt Technol BiomedLife Sci,2020,1145:122056.
[17] Song K,Wang H,Jiao Z,et al. Inactivation Efficacy andMechanism of Pulsed Corona Discharge Plasma on Virus inWater[J]. J Hazard Mater,2022,422:126906.
本文作者徐宏山,岳广智,杨立宏,刘欣玉,李玉华,中国食品药品检定研究院,来源于中国药事,仅供交流学习。

来源:Internet


