您当前的位置:检测资讯 > 生产品管
嘉峪检测网 2024-09-10 20:15
无菌医疗器械包装是保护医疗器械、预防感染的最后一道防线,包装失效会对病人和护士人员的健康和生命带来威胁。无菌医疗器械包装也称为无菌包装屏障系统,不同于食品行业的无菌包装。医疗器械无菌包装不仅需要有阻隔微生物的屏障能力,还要确保灭菌后能在一定期限内维持器械的无菌状态,并能够经受如环氧乙烷、伽马辐照、等离子过氧化氢、蒸汽等方式的灭菌。因此无菌医疗器械包装也被认为是医疗器械组成的一部分。
1、无菌医疗器械包装材料分类
目前市面上的无菌医疗器械包装材料,按照材料可分为纸、聚烯烃非织造布、塑料膜、玻璃等;按照包装形式可分为塑料袋、纸塑袋、纸质袋、铝塑袋、吸塑盒等。选择包装,需要考虑很多的因素,如包装系统与产品的适应性、与使用时的适应性等,还应结合有效期、灭菌、运输等综合评价,包括安全性要求、微生物屏障要求、密封完整性要求、密封强度要求、外观要求、印刷要求等。
2、无菌医疗器械国内外标准
我国无菌医疗器械虽然已走过 30多年的历程,早期的无菌医疗器械包装发展相对有些落后。在 2005 年,我国等同采用了 ISO 11607-1997 发布了 GB/T196663-2005《最终灭菌医疗器械的包装》标准,该标准的发布,标志着无菌医疗器械包装标准体系的正式建立,推动了我国无菌医疗器械包装的迅速发展。
2.1国外常用标准
国外通用标准 ISO 11607 分为两部分,ISO 11607-1 第 1 部分:材料、无菌屏障系统和包装系统的要求[1]以及 ISO11607-2 第 2 部分:成型、密封和装配过程的确认要求。该标准是无菌医疗器械包装的一个纲领性标准。此外,还有欧盟发布的 EN 868 系列,ASTM 系列。比较常用的如:ASTM F1980-21 StandardGuide for Accelerated Aging of SterileBarrier Systems and Medical Devices;ASTM F88/F88M-23 Standard TestMethod for Seal Strength of Flexible BarrierMaterials;ASTM F1929-2015 StandardTest Method for Detecting Seal Leaks inPorous Medical Packaging by Dye 等。
2.2国内常用标准
2005 年,我国等同采用了 ISO11607-1997 并发布了 GB/T 19633-2005《最终灭菌医疗器械的包装》,之后我国又先后转化了 ASTM 等试验方法标准, 形 成 了 YY/T 0681 和 YY/T 0698的系列。后来不断更新标准年份,目前GB/T 19633 已经随着 ISO 11607 更新为两部分,即 GB/T 19633.1-2015 最终灭菌医疗器械包装第 1 部分:材料、无菌屏障系统和包装系统的要求[2] 以及 GB/T19633.2-2015 最终灭菌医疗器械包装第 2部分:成形、密封和装配过程的确认的要求[3]。
现在行业里比较常用的无菌医疗器械包装材料,比如特卫强、PE/PET 复合膜、吸塑盒,国内外测试参考使用的标准通常见表1。
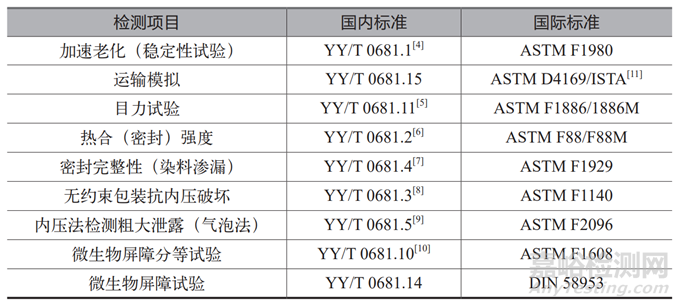
表1 无菌医疗器械包装材料检测项目的国内外标准
3、无菌包装质量控制
无菌包装最终要保护器械的安全和有效,在包装研发设计时,其流程和常见形式包括设计输入阶段,设计输出阶段以及设计验证阶段。
3.1 无菌医疗器械包装设计的输入阶段
在包装研发设计时,设计输入通常来自于 DFEMA、PFEMA、产品的需求、法规标准以及市场同类包装的分析等。DFEMA、PFEMA 通过设计阶段和生产过程阶段,分析包装系统所有组成的失效模式和后果情况。比如一些骨科植入产品,通常产品重量大、有棱角。这时候去选择无菌包装,首先要考虑的无菌包装是吸塑盒类。吸塑盒相对袋类、膜类等包装,保护性能更加卓越,可有效避免医疗器械在运输、存放等环节被破坏,保证了产品的完整性及功能性。但是吸塑盒也有缺点,如材料价格相对较贵,封口设备价格较高。
在产品的需求和法规标准上,选择无菌包装的时候首先要满足法规标准,法规标准是最低限度要求。包括对无菌包装的物理性能、化学性能、生物相容性、毒理学特性、微生物屏障、与成型与密封过程的适应性、与预期灭菌过程的适应性、与标签系统的适应性、灭菌前后储存寿命(加速老化)的评价、运输过程的评价。在产品的需求上,要兼顾考虑产品打开使用前的携带、交叉污染、微粒污染、方便快捷的使用操作等。
对于市场上成熟的同类包装系统,通常也有参考意义。毕竟医疗器械无菌包装主要材料也就是固定的几类,同类产品在市场上经受了考验,其材料特性也可以借鉴。一般器械本身的价值属性也决定着包装材料的选用。我们的医疗器械是低值耗材还是高值耗材,包装形式是否会对现有包装设备适用,相应的检验设备是否适用,灭菌方式是否变化等情况。
3.2 无菌医疗器械包装设计的输出阶段
有了设计输入,就会有输出。接收输入并转换为输出的活动,都是一个过程,设计开发输入阶段的输出,为设计过程开展的一系列活动提供了依据。内容包含设计文件以及工艺的输出。
在设计文件中,首先要输出的是设计方案、图纸、质量标准和印刷文件。在生产工艺上要输出设备及工装、图纸、SOP、工艺流程图、参数等信息。在设计方案里要充分考虑对于无菌包装材料或预成型无菌系统接收准则或技术要求。
3.2.1 设计方案、图纸、质量标准和印刷文件输出
在设计方案里,要明确使用的材料。例如无菌包装是选择吸塑盒还是特卫强袋,或者 PE 复合膜等等。还有为什么选择这些材料,这些材料包装产品的优势是什么。如下是常用的包装方式:
● 纸纸袋,是纸 / 纸 PP 或纸 / 纸 PE为材料,一面是多孔纸,主要是为灭菌提供气体通道,另一面是不涂层或涂层的复合材料(PP 或 PE),纸面材质为医用透析纸。特点是袋体承重小,价格低廉。
● 塑料袋,PA/PE/PET 尼龙复合膜和易撕膜 / 复合膜 / 共挤膜的组合,这类材料可视内包装器械产品,适合辐照灭菌。
● 纸塑袋,特卫强纸 + 复合膜,特卫强纸有涂层和非涂层模式,复合膜有PE/PET,CPP/PET 等,这类材料承载重量较轻,可视内包装器械产品,价格稍高。
● 铝纸复合袋,材料主要是铜版纸 /AL/PE+ 铜铝纸 /AL/PE,袋体避光、耐腐蚀、阻隔性强。
● 顶头袋,膜 / 复合膜,头部位置是同包装袋等宽度或较小宽度的透析纸,材料一般是多层共挤 PE 和特卫强纸,或者 PET/PE 和特卫强纸。特点是细菌阻隔能力强,透气性良好,洁净剥离。可用于环氧乙烷和辐照灭菌、等离子灭菌等。有大体积器械考虑使用,相对价格也比较高。
● 吸塑盒类,由吸塑盒和透析纸组成,盒体材质一般是 PET 或者 PETG,盖材是医用涂胶纸,特卫强纸。这类材料密封性能好,保护性好,便于运输。可用于环氧乙烷和辐照灭菌、等离子灭菌等,但是价格较高。
此外产品和无菌包材的灭菌方式最终也决定了选用哪种合适的无菌包装。如果后期灭菌使用环氧乙烷,那无菌包装就要选择透气材料,如纸、复合透析纸、无纺布、通气型硬质容器等,不能选择非透气的材料,如 PE/PET 复合膜、金属箔、聚氯乙烯等。常用的灭菌方式除了环氧乙烷,还有高温蒸汽灭菌、辐照灭菌、过氧化氢灭菌等。这些灭菌方式的优缺点如下:
● 环氧乙烷灭菌,环氧乙烷(EthyleneOxide, EO),分子式 C2H4O,优点是低温低湿,可在常温下杀灭各种微生物,EO 气体的蒸气压比较大,所以对灭菌物品的穿透力强,可以灭菌到包装和器械深处,杀菌范围广,成本低;缺点是灭菌时间长、效率较低,有化学残留,环境也有污染。适用的包装需要是透气包装。影响环氧乙烷灭菌效果的因素众多,因此没有通用的灭菌参数,为了保证灭菌效果,不同的无菌包装应对灭菌过程进行验证。任何一个因素改变时,都需要重新进行验证,因此需要对过程严格控制,与环氧乙烷灭菌过程控制相关的标准有 GB 18279.1-2015《医疗保健产品灭菌环氧乙烷 第 1 部分:医疗器械灭菌过程的开发、确认和常规控制的要求》[12],GB 18279.2-2015《医疗保健产品灭菌 环氧乙烷 第 2 部分:GB 18279.1应用指南》[13] 等。
● 高温蒸汽灭菌,优点是成本较低,设备简单,灭菌时间短,无环境污染;缺点是有些不耐高温产品不能使用,灭菌有效期也比较短。适用的包装也是需要耐受高温高湿。一些不耐高温、高湿的物品不能采用,如塑料、皮革、毛皮、内镜等,蒸汽无法穿透的物品也不能用,如凡士林、甘油、粉等是湿热隔绝者,蒸汽只能达到表面,不能穿透到内部进行灭菌。
● 辐照灭菌,优点是灭菌彻底,操作安全,没有残留;缺点是辐照灭菌的建设成本比较高,并且对放射源储存的安全性要求高。适用的包装可以是不透气的包装,如铝箔,复合膜类。辐照灭菌主要是利用 X 射线,Y 射线和电子束杀灭微生物。穿透力较强,可直接用于成品包装。在灭菌过程中温度几乎不变,射线可以接到达器械内部,灭菌后的产品可以直接使用。但钴 60 射线对高分子材料和包装材料有一定的破坏性,对人和环境也存在潜在污染。与辐照灭菌过程控制相关的标准有 GB 18280.1-2015《医疗保健产品灭菌 辐射 第 1 部分:医疗器械灭菌过程的开发、确认和常规控制要求》,GB 18280.2-2015《医疗保健产品灭菌 辐射 第 2 部分:建立灭菌剂量》[14],GB/T 18280.3-2015《医疗保健产品灭菌 辐射 第 3 部分:剂量测量指南》[15],GB 18280-2007《医疗保健产品灭菌-辐射》[16],YY/T 0884-2013《适用于辐射灭菌的医疗保健产品的材料评价》[17] 等。
● 过氧化氢灭菌,优点是安全、快速,没有残留毒性物质;缺点是成本高昂,穿透力差,灭菌条件严格。适用于特卫强包装。
产品的特性也是选择无菌材料的重要依据,单件小件物品采用纸塑袋包装材料或吸塑盒包装材料,如牙科和骨科小部件等;大件物品或数量多的灭菌包则选择医用无纺布、硬质容器包装材料,如一些器械包,则选择纺织类包装材料。
在设计方案里确定选择的材料和使用的灭菌方式后,结合产品的重量、形状等特性,输出合适的无菌包装的尺寸。设计出适合预期用途的形状,包含内部保护性材料。使用的材料的名称、料号、长宽、厚度、公差范围均清楚的标识于图纸。图纸可收录于质量标准中,用于来料检验控制指标之一。
在质量标准中,需要更加详细的描述包材的物料信息、名称、料号、规格、组分、图纸、储存条件、有效期限、进货检验内容、年度检验内容等,包括印刷要求。
3.2.2 生产工艺设备及工装、图纸、SOP、工艺流程图、参数输出
生产设备以及工装,是基于无菌材料的选择。袋类的材料热封设备,可以采用脉冲加热,或者使用电动或气动压合的热封方式进行热封,热封设备比较小型,也比较通用,可对透析袋、塑料袋、铝箔袋等材质的包装袋进行热封处理。也有些非透气包装袋,结合产品需求,会进行抽真空和充氮气的操作。这类包装操作过程会用到一些合适的模具工装,设备相对只进行封口的设备,结构更复杂,体积也要大很多。
抽真空充氮气封口机的工作原理主要分为以下几个步骤:抽真空、充氮气、封口。首先,抽真空过程利用真空泵将袋内的空气抽取,降低袋内压力,为后续充氮气做好准备。接着,通过充氮气系统,向袋内注入一定量的氮气,达到防氧化的目的。最后,通过封口装置将袋口加热,将塑料薄膜封闭,确保医疗器械包装袋的密封性。
吸塑盒封口设备一般体积较大,采用加热和压力控制技术,实现封口的快速、均匀和牢固,确保产品的密封性,吸塑封口机通过恒温恒压式封口,也能够有效地保障产品的清洁度和安全性。
了解设备和工装的结构以及作用原理,生成工装图纸、模具图纸,根据设备特点生成操作规范。SOP 生效后,遵守相关的安全操作规程,保证操作人员和设备的安全。合理安装、维护设备,确保设备在正常工作状态下运行。
在工艺流程图里,确定工序和工序特点。无菌包装是在洁净室环境下进行,对成品的质量、性能、功能、寿命、可靠性及成本等有直接影响,同时该工序是质量需进行破坏性试验或采取复杂昂贵方法才能测量或只能进行间接监控的工序,通常把无菌包装封口定义为关键工序和特殊工序。对应的工艺规范、检验规范都要匹配在工艺流程图里。
无菌包装封口的参数输出,需要识别关键过程参数并确定各过程参数得特性曲线,如加热温度、冷却温度、压力、封口速度、预热时间等,利用高一级精度设备对以上参数的特性曲线进行确认。调节合适的封口温度、封口压力和封口时间,确保封口牢固、不易破损。
3.3 无菌医疗器械包装设计的验证阶段
设计验证是对设计输出项目进行的检查,确定输出活动满足了规定的要求。设计验证包含了原材料的评价、老化验证、运输模拟验证;工艺上要对设备验收、工艺验证、过程确认、批量的验证、软件确认。
3.3.1 原材料的评价、老化验证、运输模拟验证
根据无菌包装材料的不同,评价项目也不一样,通用的一些项目如下。
● 微生物屏障能力:评价微生物屏障特性的方法分两类:①适用于非透性材料的方法(ISO5636.5:2003 中规定的葛尔莱 Gurley 法、GB/T 458:2008 肖波尔法)。②适用于透气性材料的方法(YY/T 0681.10 透气包装材料微生物屏障试验、ISO 11607.1 中 5.2.3[1] 试验方法、以 0.45 μm 为参考值进行孔径评价法(一般认为对微生物过滤的最大孔径为 0.45 μm);微生物屏障还有 YY/T0681.14-2018《无菌医疗器械包装试验方法第 14 部分:透气包装材料湿性和干性微生物屏障试验》(等同 DIN 58953-6:2010)。
● 生物相容性和毒理学特性:生物相容性的要求参考 GB/T 16886.1,一般选择按照表面器械的生物学评价项目来进行包装材料的生物学评价是可以接受的选择。通常比较常规的生物三项,如致敏、皮肤刺激、细胞毒。包装材料在进行生物相容性评价前应经过更严苛的灭菌工艺灭菌。当无菌医疗器械包装中有液体时,还应对包材溶出物质进行评价。
● 物理性能:如抗张强度、厚度差异、抗撕裂性、透气性和耐破度、微粒污染水平、初始污染菌等。这些物理测试项目可以是供应商提供资料,使用方选择性进行验证评价,有条件的工厂实验室进行收货检验,不具备测试条件的企业,也可以委托有资质的第三方进行测试评价。其中材料的微粒污染水平、初始污染菌是风险项目,应重点检测评价。
● 化学性能:结合无菌包装材料特性,测试溶出物、pH、氯化物、重金属、易氧化物、硫酸盐含量,以满足包装系统或灭菌过程的要求[3]。
● 涂胶材料的要求:涂胶材料的涂层应是连续的;涂胶量要符合标称要求;密封后应满足最小密封强度规格;材料的基本重量(每单位面积质量)应与规定值一致[18]。
老化验证分为实时老化和加速老化两部分[4]。
加速老化参考的标准是 ASTMF1980 或 YYT 0681.1。由于产品储存期(有的产品 8 年) 比较长,如果按实际环境储存条件进行检测需要很长的时间才能获得结果,为了在实时有效期结果获得以前,有必要进行加速老化实验提供确定有效期的实验数据。加速老化试验的同时也要进行实时老化[4]。
加速老化试验的核心理论是:材料退化过程中的化学反应遵循阿列纽斯(阿伦尼乌斯)反应速率函数,均相过程的温度每增加或降低 10℃,其化学反应的速率加倍或减半[4]。
基于该理论,可通过下列公式估计加速老化因子。式中,AAF 指加速老化因子,TAA 指加速老化温度,TRT 指环境温度。Q10 指老化因子,一般通过在各种温度下对材料进行试验来确定该值。通常,取 Q10 等于 2,是计算加速老化因子的通用和保守方法[4]。
3.3 无菌医疗器械包装设计的验证阶段
设计验证是对设计输出项目进行的检查,确定输出活动满足了规定的要求。设计验证包含了原材料的评价、老化验证、运输模拟验证;工艺上要对设备验收、工艺验证、过程确认、批量的验证、软件确认。
3.3.1 原材料的评价、老化验证、运输模拟验证
根据无菌包装材料的不同,评价项目也不一样,通用的一些项目如下:
● 微生物屏障能力:评价微生物屏障特性的方法分两类:①适用于非透性材料的方法(ISO5636.5:2003 中规定的葛尔莱 Gurley 法、GB/T 458:2008 肖波尔法)。②适用于透气性材料的方法(YY/T 0681.10 透气包装材料微生物屏障试验、ISO 11607.1 中 5.2.3[1] 试验方法、以 0.45 μm 为参考值进行孔径评价法,一般认为对微生物过滤的最大孔径为 0.45 μm);微生物屏障还有 YY/T 0681.14-2018《无菌医疗器械包装试验方法第 14 部分:透气包装材料湿性和干性微生物屏障试验》(等同 DIN58953-6:2010)。
● 生物相容性和毒理学特性:生物相容性的要求参考 GB/T 16886.1,一般按照表面器械的生物学评价项目来进行包装材料的生物学评价是可以接受的选择。通常比较常规的生物三项为:致敏、皮肤刺激、细胞毒。包装材料在进行生物相容性评价前应经过更严苛的灭菌工艺灭菌。当无菌医疗器械包装中有液体时,还需要对包材溶出物质进行评价。
● 物理性能:物理性能包括抗张强度、厚度差异、抗撕裂性、透气性和耐破度、微粒污染水平、初始污染菌等。这些物理测试项目可以是供应商提供资料,使用方选择性进行验证评价,有条件的工厂实验室进行收货检验,不具备测试条件的企业也可以委托有资质的第三方进行测试评价。其中材料的微粒污染水平、初始污染菌是风险项目,应重点检测评价。
● 化学性能:结合无菌包装材料特性,测试溶出物、pH、氯化物、重金属、易氧化物、硫酸盐含量,以满足包装系统或灭菌过程的要求[3]。
● 涂胶材料的要求:涂胶材料的涂层应是连续的;涂胶量要符合标称要求;密封后应满足最小密封强度规格;材料的基本重量(每单位面积质量)应与规定值一致[9]。
老化验证分为实时老化和加速老化两部分[4]。加速老化参考的标准是ASTM F1980 或 YYT 0681.1。由于产品储存期 ( 有的产品 8 年 ) 比较长,如果按实际环境储存条件进行检测需要很长的时间才能获得结果,在实时有效期结果获得以前,有必要进行加速老化实验提供确定有效期的实验数据。加速老化试验的同时也要进行实时老化[4]。
加速老化试验的核心理论是:材料退化过程中的化学反应遵循阿列纽斯(阿伦尼乌斯)反应速率函数,均相过程的温度每增加或降低 10℃,其化学反应的速率加倍或减半[4]。
基于该理论,可通过下列公式估计加速老化因子。
AAF=Q10[(TAA-TRT)/10]
公式中,AAF 指加速老化因子,TAA 指加速老化温度,TRT 指环境温度。Q10 指老化因子,一般通过在各种温度下对材料进行试验来确定该值。通常,取Q10 等于 2,是计算加速老化因子的通用和保守方法[4]。获得 AAF 估计值后,可以使用公式确定加速老化时间。即加速老化时间(AAT)= 实际存储时间 RT/ 加速老化因子 AAF。
除了加速老化温度外,相对湿度也是重要影响因素,虽然该因素没有列入计算公式,但是相对湿度水平的高低会直接影响材料的老化损伤。大家应该基于对材料的了解,选择目标温度下适宜的相对湿度水平,避免材料受损。比如有些复合膜,在高温高湿(55℃,65%RH)的条件下,材料会分层,导致加速老化失败。截止目前,YYT0681.1-2018 无菌医疗器械包装试验方法 加速老化试验指南[4]里,没有明确推荐加速时使用的湿度要求,国内依据该标准,可以不控制湿度。新版 ASTM F1980-21 则有推荐,在加速老化研究中控制湿度时,应以 (45~55)% RH 为目标,除非有使用其他湿度条件的特殊要求(根据材料相关知识)。如果使用的包装材料不能使用该湿度,可能需要考虑将包装验证测试 (环境相对湿度) 与产品老化 (较高相对湿度) 分开进行。
无菌包装材料的加速老化后测试点一般是 0 时刻、中间点和结束 3 个时间点,每个时间点的测试项目和目标材料相关,通常是测试包装的目力试验[5](YY/T 0681.11 或 ASTM F1886/1886M)、密封强度(YY/T 0681.2 或 ASTM F88/F88M)、 密 封 完 整 性(YY/T 0681.4或 ASTM F1929)、 内压法检测粗大泄露(气泡法 YY/T 0681.5 或 ASTMF2096)。在结束时间点增加无菌,微生物阻隔性能,生物试验基础三项(致敏、皮肤刺激、细胞毒)。
加速老化试验后,还应进行运输模拟试验。包装由生产厂家、灭菌加工商、经销商到最终终端用户使用过程时,在这期间的运输过程也可能会对最终灭菌医疗器械包装的外箱、无菌包装带来影响,为了保证无菌医疗器械包装和产品在运输过程中不被破坏,企业可以通过模拟运输过程来验证包装和器械性能是否还能满足出厂时的预期性能要求,ASTM D4169 DC13[2] 是无菌医疗器械包装模拟运输测试的国际通用标准,也最为常用。
运输模拟包含以下测试项目:
● 温度和湿度测试:测试包装在不同温度和湿度条件下的耐受能力,以模拟不同地区和季节的气候条件。标准中推荐条件有:(23±2)℃,(50±2)%RH,放置 72 h[2]。有些材料产品运输过程没有控温措施,运往目的地有寒冷地区和高温地区,这时要考虑高低温对运输的影响。可以设置低温(如 -40℃)、高温(45℃)、高湿等存储温湿度。
● 人工搬运测试:模拟运输过程中样品搬运转移过程的跌落状况,考察包装的耐受能力。
● 振动测试:模拟运输过程中的震动,测试包装在不同频率、幅度和方向的振动下的耐受能力。根据样品实际运输状态进行选择(DC13 推荐 60 min 卡车测试加 120 min 的空运测试,测试参数按照标准进行即可。)
● 压缩测试:测试包装在运输过程中承受的压力和重量,以检查包装的耐受能力。该测试需要确认产品运输过程中堆码情况(例如,是相同的运输单元组成的运输环境还是混合货物组成的零担或小包装运输环境)[2] 和确认最大运输堆码高度 H 的值,以及确认综合堆码系数 F 的值。
● 低气压测试:测试包装在高海拔或航空运输中的耐受能力,以检查包装的密封性能和耐受能力。适用于对低气压环境敏感的产品和包装,如密封的不透气软包装、液体容器,或因其包装形式而使低气压环境会对它产生不利影响的透气性包装。当运输单元中有含透气性材料的初包装时,可取消本试验。
● 冲击测试:模拟运输过程中的冲击,测试包装在不同强度、方向和角度的冲击下的耐受能力。该测试只适用于单壁包装材料和塑料薄膜材料,如果样品不是这种包装,则无需进行冲击测试(如双层瓦楞纸箱)。
运输模拟的测试严酷等级分为3种,分别是 I :高水平试验强度;II :中水平试验强度;III :低水平试验强度[2]。在没有其他限定的条件下,建议采用保证水平 II。
3.3.2 设备验收、工艺验证、过程确认、批量的验证、软件确认
设备验收包含 IQ、OQ、PQ 部分。IQ 通常是确认设备:名称、编码、型号、数量、生产厂家、生产日期、供货商、合同号等信息;确认设备部件:对设备主机及辅助设备、零部件、备品备件,仪器仪表进行确认;设备材质确认;润滑剂、机械密封液的确认;安装过程的确认:安装位置、安装的环境、各部分的连接方式等是否符合设计的技术标准要求和使用要求;公用系统确认:水、电、压缩空气等;确认控制系统的安装;确认文件:包括设备随机文件,如厂家测试报告、合格证、设备使用说明书、设备操作手册、维修手册、设备清单、图纸等。OQ 确认可采用空机运行,必要时封口包材运行。对于一些关键性部件,除常规功能测试外,也考虑最差条件测试和临界测试(确定的参数的上限值、下限值的测试)。PQ 部分则是确认关键控制系统,如温度控制、压力控制;确认影响产品质量的关键工艺参数,如温度、压力;工艺参数:包括参数介绍、测试条件及方法、测试的频率、验证接受标准等。
工艺验证、过程确认也可以和设备 PQ 作为同步验证,同时验证从工艺实际运行中获得的数据可作为确定质量文件的依据,以证明工艺达到预定要求。
在验证确认过程中,实验设计DOE(DESIGN OF EXPERIMENT)在质量控制的整个过程非常重要。首先筛选主要显著的因子(如温度、压力、时间、冷却时间),找出较优的参数组合,并通过对实验结果进行分析和比较,确认最优化方案。有些无菌包装材料和封口设备的供应商是同一家企业,供应商也会提供一些适合的参数。对于供应商提供的极限参数或根据经验推知的极限参数,可直接进行参数验证。对于极限参数封合的产品,确定以下检验项目:
● 外观目视:YY/T 0681.11-2014 无菌医疗器械包装试验方法 第 11 部分 目力检测医用包装密封完整性[5](ASTMF1886/1886M)。
● 常见的可能出现的密封外观特征:未密封区,当包装未形成热封或已形成密封但随后又分离时就形成未密封区;欠封区,尽管形成了密封但没有规定的强度时或由于密封参数的变化引起的密封出现斑点或斑纹;过封区,由于密封参数过大引起过度密封,使包装发生熔化或变形,导致容易开裂;窄封,包装在密封条中的位置不正,两个材料偏移发生的情况产生窄封;通道,当一个未密封路径穿过密封宽度时便形成了通道;撕裂 / 针孔,一般发生在基质材料上。外观目视检验标准,应生成文件,将这些可目视的缺陷量化,比如欠封区要达到 10% 以下的密度,可作为接受条件。窄封要达到 6 mm 以上,也是可接受条件。定义这些接受条件时,应有来源或法规标准。这些量化的缺陷可作为后续量产时质量监控的有效依据。
● 密封强度试验:YY/T 0681.2-2010无菌医疗器械包装试验方法 第 2 部分:软性屏障材料的密封强度[6](ASTMF88/F88M)。该试验通过拉伸测试一段密封部分来测量包装密封的强度。该方法不能用来测量密封口的连续性或完整的密封性能,只能测量材料间密封的撕开力。密封强度的拉伸力用牛顿 /原始试样宽度(mm)表示,可接受标准为测试结果大于 1.5N/15 mm。大于1.5 N/15 mm 是最低要求,在定质量限的时候,可以根据材料的性能和包装的产品类型,适当提高质量接受线。
● 胀破 / 蠕变试验:YY/T 0681.3-2010 无菌医疗器械包装试验方法 第 3部分:无约束包装抗内压破坏[8];YY/T0681.9-2011 无菌医疗器械包装试验方法 第 9 部分:约束板内部气压法软包装密封胀破试验。胀破试验是对包装内部逐渐加压,直至包装破坏;蠕变试验是施加一个规定的压力并保持规定的时间或直至包装破坏。
● 染色渗透试验标准:YY/T0681.4-2021 无菌医疗器械包装试验方法 第 4 部分:染色液穿透法测定透气包装的密封泄漏[7](ASTM F1929)。使用染色液来检测包装密封边缘的泄漏,当染色液和包装密封位置接触一段时间后,目测检查染色液穿透情况。如果有缺陷,染色液会被吸入密封区域,因此缺陷区会有染色通道。测试吸水性材料密封性能时应加倍小心,须确认是由密封部位渗入而不是由纸的毛细作用透过,如有疑问,应撕开包装,检查密封条内甲苯胺蓝溶液渗入的痕迹。
● 染色渗透注入法:从包装中间开口,使用注射器向包装内注入足够的甲苯胺蓝溶液,使得染料可以在包装最长边形成大约 5 mm 的深度,并且注入量应确保包装的四个密封带都能测试到。使各边充分接触染色液最低 5 s,最多20 s。通过包装的透明面目力检验密封区,查看是否有染色液从包装内部穿透到外部的痕迹[7]。
● 染色渗透边缘浸入法:选择一个比被测包装袋最长边还长的容器。往容器内注入染料,使得染料可以覆盖容器的底部,深度约为 3 ~ 6 mm。如果被测包装袋的封口外边缘还有多余的材料(如裙边和一些易撕口结构),必须将这些材料去除。使用剪切设备,沿着封合区域的外边缘约 3 mm 的距离将多余的材料剪切去除。将包装的整个封边垂直向下放入到容器内,与染料接触。垂直向上取出包装,确认整个封口边都和染料接触。观察染料在封口宽度方向的侵入情况。对于四边封的包装,每个封边最多为 5 s,总时间小于或等于 20 s[7]。
确定好测试方法,检验样本量也要具有代表性。常见的样本量计算方法包括经验法、公式法和模拟法。考虑因素包括总体大小、预期效应大小、显著性水平、统计检验的类型以及效应大小的可信区间。
封口外观采用目测,是非破坏性的测试,所以封口外观目测后的样品可以用于无菌测试或染料渗透测试。封口外观测试和染料渗透测试的结果同属于离散数据,并服从二项分布(通过或失败),样本量 n 可以通过下列公式计算:
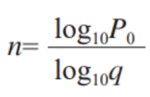
P0——未被发现的风险
C——置信水平 =(1–P0)
q——质量接受水平(1–p)
p——错误率(% 缺陷)
将未发现概率设为 5%(即 95% 的置信水平)以及 95% 的质量接受水平,通过计算:
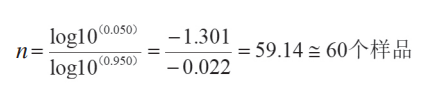
确认过程中,除了使用极限参数生产样品进行验证,还要验证不同模具、不同封条对包装的影响。灭菌过程也是影响封口质量的一个因素,灭菌前和灭菌后的封口质量对比也要充分考虑到。还要考虑批量的验证,包括不同人员在不同时间段,生产不同批次的包装产生的差异性。
验证确认过程中监控的仪器、传感器、显示器等,应通过校准。
灭菌验证,EO 具有极强的穿透性,可用于各种难通透部位的灭菌,如有些较细、较长的导管用其他低温灭菌方法很难达到灭菌效果,而只能选择 EO 或者辐照。由于环氧乙烷灭菌不存在通用的灭菌参数,影响灭菌效果的因素多且相互关联,灭菌过程控制复杂,所以为了保证灭菌效果,对其灭菌过程进行严格的验证是必要的。此外,若灭菌设备、被灭菌物品和装载方式任何一个因素改变时,都需要重新进行验证。验证灭菌设备有能力在指定的允差范围内提供特定的过程,如温度分布试验、湿度分布试验、泄漏试验、真空速率试验、空气循环试验等。证明过程的重现性,并且符合所有指定的可接受参数。这些过程包括预处理、处理、灭菌和通风阶段等,操作重现性确认一般至少需要 3次连续运行,适当时进行微生物挑战试验。环氧乙烷是致癌物,通风次数和解析放置的温度与时长对环氧乙烷的残留的影响,也需要做出相应的评价。微生物学性能验证,目的是证明在灭菌过程后,产品的无菌性能已经达到特定的要求 (SAL=10-6)。微生物性能验证的方法有:生物负载法和过度灭菌法。
辐照灭菌需要对辐射源、传送系统、附属设施 (包括相关的软件)、计量装置的计量状态、工作环境的符合性进行验证,如安全要求等。针对每个传送系统,通过测量不同位置的吸收剂量验证不同的辐照容器的计量分布,不同辐照容器以及容器内的不同位置的吸收剂量都在规定的范围内。一般在加源后、源的位置及形态改变、传送系统变化、辐照容器改变时都需要进行操作确认。灭菌验证包括物理性能确认和微生物性能确认。物理性能确认包括确认产品装载模式,包括日常产品的包装方式 (尺寸、密度等);剂量分布,包括最大和最小吸收剂量及位置,产品的最大可吸收剂量 (评价灭菌剂量对产品的影响)。微生物学性能验证,目的是证明在灭菌过程后,产品的无菌性能已经达到特定的要求 (SAL=10-6)。
软件确认:如果不涉及复杂的软件系统,不可配置软件一般性的确认就是进行各种各样的活动来证明对该软件的正常使用 ( 能够满足用户需求 ) 产生信任的过程。操作软件,功能参数符合输出要求和安全要求。
再验证:为证明设备经历过一段使用时间后,封口的质量仍能满足设计要求,设备仍然具备有效性和可靠性,再验证就很有必要。要根据设备使用频率、日常监控结果,制定合理的再验证期限,一般半年到一年的时间会进行再验证。
4、总 结
无菌包装生产技术已经成熟。随着法规和检测技术的不断完善,使用企业对质量要求在逐步提高。法规和质量标准的推出将进一步规范无菌包装产品的质量和性能,从而更好地保障无菌医疗器械的安全性和有效性。
参考文献
[1] ISO 11607-1 Packaging for terminallysterilized medical devices - Part 1:Requirements for materials, sterilebarrier systems and packaging systems
[2] GB/T 19633.1-2015《最终灭菌医疗器械包装》-第 1 部分:材料、无菌屏障系统和包装系统的要求
[3] GB/T 19633.2-2015《最终灭菌医疗器械包装》-第 2 部分:成形、密封和装配过程的确认的要求
[4] YY/T 0681.1 无菌医疗器械包装试验方法 第 1 部分:加速老化试验指南
[5] YY/T 0681.11 无菌医疗器械包装试验方法 第 11 部分:目力检测医用包装密封完整性
[6] YY/T 0681.2 无菌医疗器械包装试验方法 第 2 部分:软性屏障材料的密封强度
[7] YY/T 0681.4 无菌医疗器械包装试验方法 第 4 部分:染色液穿透法测定透气包装的密封泄漏
[8] YY/T 0681.3 无菌医疗器械包装试验方法 第3 部分 无约束包装抗内压破坏
[9] YY/T 0681.5无菌医疗器械包装试验方法第 5 部分:内压法检测粗大泄漏(气泡法)
[10] YY/T 0681.10无菌医疗器械包装试验方法第 10 部 分:透气包装材料微生物屏障分等试验
[11] ASTM D 4169运输容器和系统的性能试验规范
[12] GB 18279.1-2015《医疗保健产品灭菌环氧乙烷 第 1 部分:医疗器械灭菌过程的开发、确认和常规控制的要求》
[13] GB18279.2-2015《医疗保健产品灭菌 环氧乙烷 第 2 部分:GB 18279.1应用指南》
[14] GB 18280.2-2015《医疗保健产品灭菌 辐射 第 2 部分:建立灭菌剂量》
[15] GB/T 18280.3-2015《医疗保健产品灭菌 辐射 第3部分:剂量测量指南》
[16] GB 18280-2007《医疗保健产品灭菌-辐射》
[17] YY/T 0884-2013《适用于辐射灭菌的医疗保健产品的材料评价》
[18] YY/T 0681.8 无菌医疗器械包装试验方法 第 8 部分:涂胶层重量的测定
本文作者曹旭,江苏艾苏莱生物科技有限公司,仅供交流学习。

来源:制药工艺与装备


