您当前的位置:检测资讯 > 行业研究
嘉峪检测网 2024-09-26 16:56
摘要
病毒样颗粒(VLPs)是一类能够自行组装,具有重复抗原表位,能够刺激机体免疫反应且不含病毒遗传物质的蛋白纳米颗粒。在疫苗研发、药物靶向运输和生物工程材料方面VLPs具有重要的研发价值和应用潜力。本研究对VLPs疫苗诱导免疫反应的机制、现有的VLPs表达技术、防治病毒感染等方面的研究进展进行了综述,为VLPs疫苗的设计和研发提供参考。
疫苗接种能够以低成本且高效的方式应对公共卫生事件与各种流行病的传播,是人类目前最为重要的医疗干预措施之一[1]。目前的疫苗种类包括减毒疫苗、灭活疫苗、核酸(DNA/RNA)疫苗和亚单位疫苗等。其中减毒或灭活疫苗含有已经减弱毒力或失去活性的病原体以模拟疾病感染从而获得免疫力;核酸疫苗递送病原体遗传物质进入人体,激活免疫系统引起免疫应答;亚单位疫苗的抗原成分为病原体的选定片段,包括抗原多肽、蛋白、多糖以及可形成病毒样颗粒(virus-like particles,VLPs)的病毒结构蛋白等。与其他类型疫苗相比,亚单位疫苗具有明确的靶抗原成分,可以弥补其他疫苗因抗原变异、毒力返祖等引起相关的安全性问题,以及严格的储存要求和针对快速突变的病原体较低功效等功能性缺陷[2,3]。作为亚单位疫苗的一种,VLPs近些年来在生物医学与生物工程学领域扮演着重要的角色,成为疫苗开发领域极具潜力的研发方向[4]。
VLPs是一种能够自组装的纳米颗粒,其组成成分包括病毒衣壳蛋白、核心蛋白或包膜蛋白等能够刺激人体产生免疫力的特定病毒蛋白,分为有包膜和无包膜VLPs。VLPs同时也可以由非病毒或人工合成方式形成的具有一定对称结构的蛋白纳米颗粒[5]。由于其内部不具有病毒核酸成分,因而不具有感染性。VLPs可以自组装成二十面体、杆状或球状等结构,能够通过原核细胞系,酵母细胞系统,植物细胞,动物细胞等进行重组表达的方式人工获得。VLPs最早作为在原子水平上分析病毒结构的重要工具,随着深入的研究其逐渐被用于多个领域。VLPs作为能够加载各种药物产品将其递送至特定的细胞或组织的纳米载体正在被开发成为药物递送系统[4]。在疫苗研发领域,VLPs被用于抗病毒、抗菌以及肿瘤疫苗等方向的研发。VLPs可以组装成类似于天然病毒结构的空间立体构型,具有重复抗原表位,能够以高价态形式刺激机体免疫反应;纳米级别的尺寸使其能高效被免疫细胞摄取而进入淋巴系统;其表面可以展示不同来源的抗原结构,便于根据不同病原体而定制化设计疫苗;并且其具有免疫佐剂效应,能够模拟病毒感染并刺激人体的免疫系统从而诱导产生免疫保护反应。广泛的抗原来源为VLPs疫苗的开发提供了多种应用场景,能够使用不同重组表达体系进行大规模生产等优点使得VLPs疫苗的开发更具经济效益。与此同时,VLPs疫苗本身仍存在一些不足之处,如诱导CD8+T细胞免疫的效果可能不够理想,可以通过结合使用刺激细胞免疫的佐剂或抗原来改善其效果[6]。与其他类型的疫苗类似,VLPs疫苗可能会引起注射部位肿胀或疼痛,且部分接种人群可能预先感染过此类病毒,并阻碍机体对此类VLPs疫苗的免疫应答[7,8]。
本文综述了VLPs疫苗诱导产生免疫反应的机制,总结了VLPs疫苗的表达平台,列举和归纳了现阶段VLPs疫苗针对相关疾病的实际应用,对VLPs疫苗存在的优点与不足进行了概括总结,为VLPs抗病毒疫苗的设计和研发提供了参考。
一、VLPs疫苗诱导免疫反应的机制
作为亚单位疫苗的一种,VLPs疫苗可以很好地克服传统疫苗使用具有感染性或灭活病原体的局限性来实现其安全性和有效性[9]。不同于一般的亚单位疫苗,VLPs蛋白颗粒保留了天然病毒特征性的结构蛋白,包含具有免疫原性的抗原基序。VLPs可以自组装成蛋白颗粒,且在VLPs内部也不具有病毒核酸成分,因此可以模拟天然病毒类似的感染途径被免疫系统识别和加工而没有毒力返祖的风险。VLPs表面可以通过多价的形式呈现不同来源病原体的抗原表位。同源VLPs含有天然病毒蛋白质,异源VLPs由于含有不同来源的抗原成分能够获得针对多种不同病原体的免疫原性,这些特点使VLPs具有能够在体内诱导体液和细胞免疫反应的能力[9,10,11]。
VLPs疫苗进入体内后,细胞摄取VLPs的途径分为多种类型。除了非特异性的吞噬、巨吞饮作用外,还可以通过网格蛋白依赖和非依赖(受体介导)等内吞形式摄取VLPs[6]。VLPs自身含有的病原体相关分子模式(pathogen-associated molecular patterns,PAMP),能够与抗原递呈细胞(antigen presenting cell,APC)如树突状细胞(dendritic cell,DC)细胞表面或内部的模式识别受体(pattern recognition receptor,PRR)如Toll样受体(toll-like receptor,TLR)、Nod样受体(nod-like receptor,NLR)和RIG l样受体(RIG-I-like receptors,RLR)等发生结合并活化APC。相比其他APC,DC能够更有效地摄取VLPs[10,12]。VLPs进入APC胞内,在吞噬溶酶体中被消化,加工得到的抗原肽被加载到主要组织相容性复合物(MHC)Ⅱ类分子上并呈递给CD4+辅助性T细胞(helper t lymphocyte,Th)。Th细胞通过表面的TCR识别MHCⅡ分子提呈的抗原表位,在细胞因子信号和共刺激信号的共同作用下刺激B细胞的增殖与活化,在Th细胞相互作用下,促进抗体和记忆性B细胞的产生[13]。由于VLPs能够与B细胞表面BCR发生高度交联,还可以直接活化B细胞诱导T细胞非依赖性的体液免疫反应[13,14]。VLPs的高度重复表面可以促进与先天性体液免疫成分的相互作用,介导APC的调理和吞噬作用,APC被VLPs激活后能够促进基于T、B细胞的免疫反应[15]。除了刺激CD4+T细胞活化,VLPs还能够通过交叉递呈途径诱导CTL细胞免疫应答。VLPs的抗原呈递并不局限于MHC-Ⅱ,颗粒状VLPs可以被APC摄取并将抗原片段交叉呈递于MHC-Ⅰ类分子表面,促进CD8+T细胞活化。VLPs抗原片段加载于MHC-Ⅰ分子的过程可以通过与抗原转运蛋白(transporter-associated with antigen processing,TAP)非依赖性或TAP依赖性内体途径相关的转运蛋白来实现。活化的CTL细胞能够通过释放穿孔素和颗粒酶,或经死亡受体和死亡受体配体(Fas/FasL)途径有效杀伤靶细胞[9,16,17]。见图1。

图1病毒样颗粒疫苗的表达平台和诱导免疫反应的机制
在设计VLPs疫苗时,模式识别受体(如TLR7、8、9等)的活化对于适应性免疫应答的激活起到重要作用。可以将外源性佐剂如CpG、ssRNA等共价结合至VLPs表面或者包装于VLPs内部,从而对模式识别受体产生更好的活化作用。在设计诱导CTL的VLPs疫苗时,CpG是常用的佐剂之一。CpG能够活化TLR9,产生Th1偏向性免疫反应,引发强烈的T、B细胞反应,诱导生产更加长寿的浆细胞,长期维持高水平的抗体滴度[8]。通过将ssRNA封装于VLPs内部,被免疫细胞摄取后ssRNA能够结合并激活Toll样受体如TLR7和TLR8,引发下游信号转导,诱导细胞因子(TNFα、IFNα、IFNγ和IL-6等)的表达,在较低剂量下诱导机体免疫应答[7]。基于诺如病毒(GII.P16-GII.2型)VLPs疫苗的研究中发现,和DC相比,VLPs能够更加有效地激活巨噬细胞表型的成熟,促使巨噬细胞进行M1型方向的活化并释放炎性细胞因子,活化CD4+T细胞引发Th1型免疫应答,诱导细胞和体液免疫应答[18]。
二、VLPs的重组表达技术
稳定且可靠的表达平台对于VLPs疫苗的生产至关重要。VLPs表达平台应具有高效率、高产量、便捷、快速、低成本、安全生产等特点[6,19]。VLPs表达系统还需确保蛋白质能够进行正确地折叠和翻译后修饰,这些条件与VLPs疫苗能否实现刺激免疫应答的功能直接相关[5]。目前能够用于VLPs的表达平台包括细菌、酵母、杆状病毒/昆虫细胞(B/IC)系统、哺乳动物细胞、植物、活动物和无细胞系统等[5,6,19]。
细菌表达系统是目前应用最广泛的重组蛋白表达系统之一。目前成功表达的174种不同类型的VLPs中,约28%是在细菌系统中表达的[20]。细菌本身存在翻译后修饰(posttranslational modification,PTM)能力有限、表达的蛋白可能存在溶解度低和二硫键错配等问题,此体系适用于包含一种或两种病毒结构蛋白的无包膜VLPs的重组表达。由于原核表达系统的安全性、成本效益以及能满足全球性的使用等优势,基于原核细胞的表达系统仍被视为生产VLPs的最佳平台[5,20,21,22]。其中大肠杆菌(Escherichia coli,E.coli)是最为常见的VLPs细菌表达平台,其生产成本低、表达水平高、易于放大且周转时间短,常被用于生产结构相对简单且PTM需求不高的VLPs疫苗[5,20]。Hecolin是第一个成功商业化的戊型肝炎病毒(hepatitis e virus,HEV)VLPs疫苗,其生产使用E.coli表达平台[20]。利用E.coli表达体系,通过与大肠杆菌中的噬菌体QβRNA进行抗原缀合开发了多种针对非感染性疾病(包括高血压、过敏、糖尿病、癌症和阿尔茨海默病等)的嵌合VLPs疫苗[5]。
酵母细胞是研究最深入的真核表达体系之一,是基因工程生物材料与重组蛋白药物制剂的优良表达宿主[23]。酵母作为重组表达体系具有成本低、产率高、纯化简单、支持高密度发酵和分泌表达等优势。此外,酵母避免了细菌和哺乳动物细胞等内毒素和病毒污染等相关的问题。不同于原核系统,酵母体系的PTM能够帮助重组蛋白形成正确构象并更好地发挥其生物学效应[22,23,24,25]。由于酵母表达体系在蛋白质糖基化方面与哺乳动物细胞存在差异,因此酵母常被用作生产无包膜VLPs[21]。首个酵母系统表达的HBV-VLPs疫苗于1986年获得美国FDA批准后,基于酵母体系表达的多种VLPs疫苗陆续获批上市或进入临床实验[21,26]。基于毕赤酵母系统的基孔肯雅病毒(chikungunya virus,CHIK)VLPs疫苗在小鼠模型中免疫效果评估与灭活病毒相当[26]。
相较于其他表达体系,哺乳动物细胞表达的目标蛋白质产量相对较低,但其在蛋白折叠、组装与形成完整的PTM方面具有优异的表现[5,27]。目前,市场上几乎50%以上的生物制药产品和临床开发中的候选产品都基于哺乳动物细胞表达体系,动物细胞表达体系能够被用来表达包膜和无包膜VLPs[28]。包括仓鼠卵巢细胞(CHO)、人胚肾293(HEK 293)细胞、幼仓鼠肾细胞(BHK-21)、CAP-T和Vero等多种动物细胞系被用于生产重组VLPs[5,28]。CHO细胞被用于表达HBsAg VLPs、登革热病毒和汉坦病毒VLPs,HEK296细胞和CAP-T细胞系能够用于HIV-VLPs的高效表达[29,30,31],Vero E6细胞系成功表达了SARS-CoV-2VLPs用于临床测试[32]。
杆状病毒/昆虫细胞表达系统(baculovirus/insect cell expression system,B/IC)同样常用于生产包膜和非包膜VLPs[5]。B/IC系统可以产生与细菌和酵母系统相当的VLPs表达量,但其由于具有相对于原核体系更强的PTM效果和作为基因治疗载体的能力在药物研发和生产方面更具优势[22]。杆状病毒表达载体系统(baculovirus expression vector system,BEVS)平台作为抗病毒疫苗成熟的生产平台,具有速度快、灵活设计和可扩展性等优势。杆状病毒具有自发感染昆虫细胞的倾向,利用B/IC平台生产VLPs能够达到商业化规模的需求[33]。杆状病毒表达体系设计快速且简便,有助于生产表面结构蛋白易发生变异的传染性疾病疫苗[22]。基于B/IC表达系统的HPV疫苗Cervarix是一种由HPV 16和HPV 18 L1 VLPs构成的二价HPV疫苗,于2009年获得FDA批准上市[5]。
植物表达系统是有效且可扩展的VLPs表达平台,生成的重组蛋白具有可溶性好、低成本、蛋白表达水平高和蛋白质正确折叠能力优良等优点[5]。在叶绿体中表达的生物制药产品和疫苗可以在合适温度下稳定保存多年,并且保留蛋白质正确折叠的构象和生物学效应[34]。叶绿体基因工程可以将基因整合到高度多倍体的叶绿体基因组中(每个细胞多达10 000个基因拷贝),因而可以产生高水平的外源蛋白质表达[35]。植物细胞还可以用植物病毒递送外源基因进行表达,如使用烟草花叶病毒(tobacco mosaic virus,TMV)进行重组表达产量大、效率高,是重组植物疫苗的里程碑[36,37];烟草植物、马铃薯块茎等植物重组表达体系已经成功表达了HBV、HPV和流感VLPs疫苗[5]。由于植物来源的VLPs有高度有序的重复堆积结构,比体内的可溶性蛋白质更能抵抗消化酶的作用,一些植物来源的VLP疫苗可以实现口服给药[36]。
无细胞蛋白合成系统(cell-free protein synthesis,CFPS)也可以用于VLPs的生产,通过保留蛋白质合成能力的细胞提取物,为蛋白质的体外生产提供了更多的选择[5,38]。作为合成生物学的关键平台,CFPS系统节省时间,蛋白产量大,可以避免蛋白质对活细胞的毒性,并且能够将人工合成的非天然氨基酸引入VLPs疫苗结构中,是VLPs疫苗生产一种有广阔前景的工具[6,39,40]。活体动物如寄生虫表达系统也可以用于VLPs的表达,此系统不仅具有形成蛋白质天然构象和完整的PTM的优势,而且更加安全高效。利用非致病性利什曼原虫L.tarentolae表达VLPs可以为VLPs疫苗的生产提供替代方案[41]。
VLPs在重组表达和生产过程中,蛋白质的正确折叠和PTM的程度是选择适合表达系统的关键性因素。对于有包膜的VLPs的大规模生产可以选择哺乳动物、昆虫细胞或无细胞系统进行表达;而对于无包膜VLPs可以选择经济快捷的细菌或酵母体系;针对快速变异的病毒如流感病毒等同样可以选择原核细菌体系,便于快速应对病毒突变株带来的威胁。总体来说,细菌体系和酵母体系经济快捷,易于生产,但细菌体系缺乏PTM体系,酵母则不具有形成复杂PTM的体系,常用于无包膜VLPs的生产。B/IC系统和植物细胞表达系统表达量高,成本经济,但B/IC系统其N-糖基化相对简单,可能会是其潜在缺点。哺乳动物细胞PTM程度高,有利于复杂结构VLPs疫苗的生产;但其主要劣势在于生产成本高,且产量较低。无细胞系统进行VLPs的表达其产量近些年来得到了提升,但其商业化应用受限于生产成本,一般作为额外的选择方案[5]。
三、VLPs抗病毒疫苗的主要研究进展
VLPs由于保留了天然病毒的有效抗原表位,并且不含病毒遗传物质,不具有感染性,因此在抗病毒疫苗的研发方面具有天然优势。本文归纳了VLPs疫苗在乙型肝炎病毒、肠道病毒、寨卡病毒、人乳头瘤病毒、流感病毒和新型冠状病毒等方面的主要研究进展(表1)。
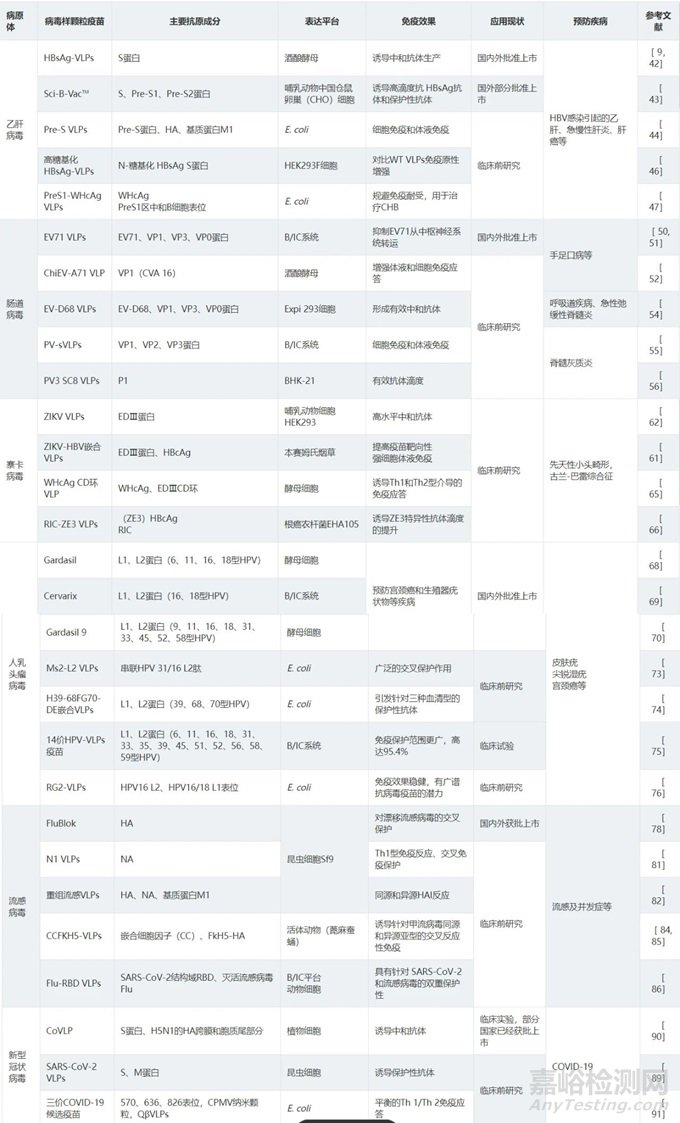
表1 病毒样颗粒抗病毒疫苗的应用进展
注:HBV为乙型肝炎病毒;HPV为人乳头瘤病毒;EV为肠道病毒;CPMV为豇豆花叶病毒;WHcAg为土拨鼠肝炎核心抗原;HBcAg 为乙肝病毒核心抗原;HA为血凝素;NA为神经氨酸酶
(一)乙型肝炎病毒疫苗
乙肝病毒(hepatitis b virus,HBV)感染是全球所面临的一个重大公共安全问题,接种乙肝疫苗是目前最有效的预防策略。第一代乙肝疫苗属于血浆衍生疫苗,在当时针主要对于高危人群使用。第二代基因工程疫苗使用乙肝表面抗原(hepatitis b surface antigen,HBsAg)作为主要抗原,使用酵母细胞进行表达且能够自组装为病毒样颗粒。二代HBV疫苗是第一个获批上市的VLPs疫苗,其显著降低了HBV的全球流行率,在疫苗学领域具有里程碑式的意义[9,42]。基于HBsAg-VLPs的第三代HBV疫苗Sci-B-Vac™在第二代疫苗的基础上进行优化,含有S蛋白、Pre-S1蛋白和Pre-S2蛋白3种抗原组分,使用哺乳动物CHO细胞进行表达,能够在低剂量(2.5~10μg)诱导下获得高滴度的抗HBsAg和针对Pre-S蛋白的保护性抗体[43]。第三代HBV疫苗目前已经获批在东亚的14个国家等使用,安全使用人数达到30多万人。其在老年人或免疫功能低下以及肾脏移植等患者中仍然收获了良好的免疫效果,并有望成为慢性HBV感染的治疗性疫苗[9]。Pre-S抗原可以提供T细胞和B细胞表位,诱导细胞免疫与体液免疫,有望作为新型HBV疫苗的潜在抗原成为HBsAg的替代和补充[44]。使用流感病毒M1蛋白和流感病毒血凝素(hemagglutinin,HA)的跨膜结构域和胞质尾部结构域作为支架组成的Pre-S VLPs,在动物实验中诱导了高水平的体液与细胞免疫反应。该疫苗在保护小鼠免受HBV DNA的流体动力学转染方面也表现出明确的效果,表明了其在新型HBV预防和治疗性疫苗方向具有潜力[44]。通过生物和免疫信息学评估和设计的一种基于乙肝核心抗原(hepatitis b core antigen,HBcAg)且含有HBsAg免疫原性结构域的VLPs疫苗,将HBsAg的抗体结合片段置于HBcAg的主要免疫优势区(major immunodominant region,MIR)表位来刺激多边免疫反应,以获得针对HBV的广泛和特异性的B和T细胞应答[45]。与在酵母中表达的HBsAg相比,无论有无佐剂,在HEK293F细胞中表达的高度N糖基化的HBsAg VLPs在BALB/c小鼠模型中均显示出增强的免疫原性[46]。为了应对免疫耐受造成的预防性疫苗对慢性肝炎无效的问题,可以将包膜PreS1区域的8个B细胞中和表位结合到土拨鼠肝炎核心抗原(woodchuck hepatitis virus core antigen,WHcAg)上形成PreS1-WHcAg VLPs治疗性疫苗,由于WHcAg和HBcAg无B细胞表位交叉反应性,且CD4+T细胞和CD8+T细胞表位部分同源,该疫苗可以诱导CD4+T细胞依赖的B细胞活化产生抗体,从而产生特异性抗体以克服免疫耐受。WHcAg VLPs疫苗在HBV免疫耐受的转基因小鼠模型中引起了相当于野生型小鼠的高滴度PreS1中和抗体水平,有望应用于CHB的治疗[47]。
(二)肠道病毒疫苗
肠道病毒属于小RNA病毒科,其中肠道病毒71型(enterovirus 71,EV71)和柯萨奇病毒A16(coxsackie virus A16,CV-A16)多引起手足口病,脊髓灰质炎病毒(Poliovirus,PV)同样属于肠道病毒家族[48,49]。目前我国已经有3种针对EV71的灭活疫苗获批[50]。灭活疫苗因相对活疫苗较为安全,但其免疫原性不持久,仅能启动体液免疫而缺乏细胞免疫,且存在抗原表位受损的风险。重组VP1疫苗产生中和抗体水平不高,有抗体依赖性增强(antibody-dependent enhancement,ADE)的风险[50]。EV71包含P1、P2和P3的单链阳性RNA基因组,通过蛋白酶3CD可以将P1蛋白加工成为VP1、VP3以及VP0,这三者可以自发组装成为正二十面体VLPs[50]。重组表达的EV71 VLPs在小鼠模型中诱导的IgG水平与灭活EV 71相似,虽然中和滴度方面低于灭活疫苗,但VLPs疫苗能够抑制EV71从中枢神经系统到肌肉组织的转运[51]。随着肠道病毒嵌合抗原研究的深入,用于手足口病(hand foot mouth disease,HFMD)防治的多价VLPs疫苗的可行性不断提高。通过将EV71的衣壳蛋白VP1的SP70表位替换为CV-A16形成的二价嵌合体疫苗EV-A71 VLPs(ChiEV-A71 VLPs),在小鼠模型中能够有效诱导针对EV71和CV-A16的细胞和体液免疫应答[52]。提高重组表达EV71 VLPs疫苗产量,是EV71疫苗开发和市场化的关键。通过基于密码子优化的P1和3C基因,在毕赤酵母表达体系中表达EV71-VLPs,其表达量可达270 mg/L,远高于Vero细胞中1.5 mg/L的表达量。此外,使用昆虫细胞/杆状病毒系统构建双启动子表达P1和3CD的EV71 VLPs疫苗能够提高疫苗产量,这表明并入不同启动子具有优化VLPs产量的潜力[53]。肠道病毒EV-D68能够引起儿童呼吸道疾病,少数还会造成急性弛缓性脊髓炎(acute flaccid myelitis,AFM)等疾病。利用EV-D68 VP蛋白(VP0、VP1、VP3)形成的VLPs疫苗对同源或异源EV-D68亚型均有保护性中和抗体产生,在体内能够防止病毒的全身性传播[54]。VLPs疫苗同样可以用于肠道病毒PV引起的脊髓灰质炎的预防,重组表达的PV的结构蛋白能够自发形成VLPs结构刺激机体产生保护性抗体。PV的P1衣壳蛋白与3CD蛋白酶共表达并且经3CD酶切后能够形成VLPs结构并刺激机体产生保护性抗体。通过B/IC平台表达的VP1、VP2和VP3结构蛋白具有热稳定性,自组装形成的PV1、PV2和PV3 PV-sVLPs在动物实验中能够在小鼠脾脏中诱导产生大量的白介素(interleukin,IL)如IL-2、IL-5和干扰素γ(interferonγ,IFN-γ)等细胞因子,刺激机体产生强大的体液与细胞免疫[55]。在BHK-21哺乳动物细胞系统表达中以改良的痘苗病毒为载体,通过P1和3CD共表达形成的PV3 SC8 VLPs,实验动物模型中产生了有效的保护性抗体滴度[56]。
(三)寨卡病毒疫苗
寨卡病毒(zika virus,ZIKV)是一种属于黄病毒科黄病毒属的虫媒病毒[57,58]。2015年由美洲开始蔓延至亚非等多个地区,其感染可能引发先天性小头畸形和自身免疫性神经系统疾病格林-巴利综合征等症状[59]。目前尚无获批的ZIKV疫苗,但已有候选疫苗进入临床试验[60]。E蛋白是黄病毒的主要表面蛋白,参与病毒与细胞表面的结合以及膜融合,ZIKV病毒表面E蛋白拷贝数多达180个。E蛋白单体包含EDⅠ、EDⅡ和EDⅢ三个结构域,其中EDⅢ结构域是生成特异性中和抗体的主要靶标抗原,因此成为疫苗研发的重点[60,61]。通过结构蛋白(C-PrM-E)和非结构蛋白(NS2B-NS3)自组装形成ZIKV-VLPs疫苗,在小鼠模型中产生的中和抗体滴度显著高于ln-ZIKV(灭活疫苗)对照组[62]。将编码ZIKV结构蛋白PrM-E基因的质粒DNA引入HEK293哺乳动物细胞中表达的VLPs能够在小鼠和非人灵长类动物中诱导产生中和抗体,并使宿主免受感染[63]。使用ZIKV EDⅢ和HBV核心抗原设计的嵌合VLPs,可以提高VLPs疫苗的靶向性,防止交叉反应性黄病毒抗体的产生,并且能够引发强烈的体液和细胞免疫反应,具有预防抗体依赖性增强(antibody-dependent enhancement,ADE)效应和提高免疫效率方面的潜力[61]。使用腺病毒载体表达C蛋白、PrM蛋白和E蛋白组装生成的ZIKV-VLPs颗粒,使用氢氧化铝、AddaVaxTM和MF 59®作为佐剂,在动物实验中均显示接种后2~6个月能够检测到中和抗体的产生,表明其可以作为寨卡病毒疫苗单剂量疫苗候选物[64]。使用土拨鼠WHcAg作为支架嵌合EDⅢCD环亚结构域形成的VLPs疫苗,在小鼠模型中显示出了Th1和Th2型介导的免疫反应,并能刺激产生与抗体依赖性细胞毒性(antibody dependent cellular cytotoxicity,ADCC)和补体依赖性细胞毒性(complement dependent cytotoxicity,CDC)相关的保护性抗体[65]。将ZIKV EDⅢ嵌合在HBcAg VLPs表面与植物制备的由IgG重链和ZIKV EDⅢ融合蛋白组成的重组免疫复合物(recombinant immune complex,RIC)进行共同递送能够产生增强的免疫效果[66]。EDⅢ和IgG重链N或C末端融合形成的N-RIC和C-RIC与EDⅢ-HBcAg VLPs共同进行递送在动物实验中能够产生协同效应,产生中和抗体的水平均强于单独使用RIC或EDⅢ-HBcAg VLPs进行诱导。
(四)人乳头瘤病毒疫苗
人乳头瘤病毒(human papilloma virus,HPV)基因组由双链环状DNA组成,其晚期区(late region,LR)编码HPV主要衣壳蛋白L1和次要衣壳蛋白L2,前者是目前HPV疫苗设计的主要靶点[67]。主要衣壳蛋白L1可以自组装成具有免疫原性的VLPs,目前已有多款基于L1的VLPs疫苗获批上市,其在预防同型HPV感染的有效性和安全性方面得到了临床验证[68]。Merck公司在2006年获批的四价HPV疫苗Gardasil用于预防6、11、16、18型HPV引起的宫颈癌和生殖器疣状物,随后开发的二价疫苗Cervarix针对预防HPV的16、18高危型引起的宫颈癌也于2009年被美国食品药品监督管理局(food and drug administration,FDA)批准使用[69]。2014年Gardasil 9被美国FDA批准使用于9~26岁的女性和9~15岁的男性,相比于二价和四价HPV疫苗,Gardasil 9不仅含有HPV 9、11、16、18 L1 VLPs,还包括了31、33、45、52和58 L1 VLPs[67,69,70]。HPV52 L1 VLPs疫苗将HPV 52的L1基因进行了基于毕赤酵母表达系统的密码子优化,经重组表达的HPV52 L1能够成功组装成VLPs颗粒。酵母系统表达的HPV52 L1成本较低,具有作为在亚洲等地流行的HPV52低成本疫苗的潜力[71]。使用VLPs作为模板与二氧化硅佐剂通过自组装能够形成树莓样VLP@Silica纳米疫苗,当使用HBsAg或HPV 18 L1 VLPs作为抗原时,能够增强特异性抗体的产生和T细胞介导的细胞免疫应答[72]。不同于L1抗原表位,L2表位可以针对不同类型的HPV产生交叉保护作用,针对HPV L2保守表位的候选疫苗有望成为Gardasil 9的替代和补充。通过在噬菌体MS2表面展示串联的HPV31/16 L2抗原表位形成的MS2-L2 VLPs疫苗,在小鼠模型中产生了针对不同类型HPV L2表位的高滴度抗体[73]。基于生物信息学分析和免疫原性优化构建的包含了39、68、70三种基因型L1免疫显性区域的H39-68FG70-DE嵌合体VLPs,在动物实验中不仅能够引发针对三种血清型的中和抗体,而且在较低剂量下实现了相当于多价疫苗或更好的交叉中和水平[74]。包含HPV 6、11、16、18、31、33、35、39、45、51、52、56、58和59在内的14种型别的重组多价L1 VLPs疫苗,具有比Gardasil 9更高的免疫保护范围,并且已经进入Ⅱ期试验[75]。将源自L2保守表位的αHPV和一致性序列βHPV序列展示在HPV16/18 L1的DE环内形成的RG2-VLPs,使用明矾作为佐剂能够有效的诱导L2特异性抗体,避免β型HPV 5的感染。在兔模型中可以避免17种αHPV的感染,具有预防肛门、生殖器癌和乳头瘤的潜力[76]。
(五)流感疫苗
除了当前引起大流行的SARS-CoV-2病毒,流感病毒也是具有季节性和周期性流行的病原体之一。人流感病毒分为甲(A)、乙(B)、丙(C)三型,其中甲型流感病毒抗原性易发生变异,曾经引起世界范围的大流行[77]。HA是流感疫苗开发的主要靶标,以HA作为主要抗原的首个重组流感疫苗FluBlok在2013年获得美国FDA批准[78]。重组VLPs疫苗可以实现流感疫苗的快速制备,应对大威胁流感病毒。植物表达体系可以用于生产基于HA的VLP疫苗[79],昆虫细胞Sf9产生的甲型流感VLPs,其产量比HEK293细胞高大约35倍,并且高产率的同时VLPs引起的抗体滴度也更高,优于其他表达系统,有利于商业化生产[77]。由于HA容易产生抗原漂移,因此需要每年进行流感疫苗的更新[80]。神经氨酸酶(neuraminidase,NA)同样属于流感病毒的表面蛋白,与HA相比其抗原发生漂移较慢,是流感疫苗重要的抗原表位。由HA和NA构成的N1 VLPs疫苗可以提供对不同抗原HA的流感病毒提供交叉免疫保护,诱导Th1型免疫应答和中和抗体的产生[81]。使用来自A/Anhui/1/2013(H7N9)的HA和NA和来自A/Indonesia/05/2005(H5N1)的基质蛋白M1组装形成的H7N9 VLPs疫苗,动物实验显示H7N9 VLP可以产生对同源H7N9的血凝抑制反应和对异源H7N9的交叉性血凝抑制反应,并且在加入皂苷类佐剂后,其反应会提高3~4倍[82]。HA与唾液酸(sialic acid,SA)受体的结合在流感病毒感染过程中扮演着重要的作用。通过测试对比野生型H1-VLPs和无法结合SA的流感病毒H1(H1N1 A/California/07/09)VLPs疫苗(H1Y98F-VLP),接种H1Y98F-VLP疫苗的小鼠由于改善了淋巴细胞生发中心的生成,能产生更强烈持久的体液免疫反应。该结果表明消除HA-SA的结合有望增强流感疫苗免疫反应的质量和持久性[83]。由于流感疫苗容易发生抗原漂移的特点,开发流感病毒通用疫苗具有重要意义。这类疫苗的设计中可以包含更多的保守序列作为抗原表位,如M2蛋白的胞外区、HA的茎区和核蛋白等[78]。将M2蛋白、甲流病毒NA茎部和IL-12构成的嵌合体细胞因子(chimeric cytokines,CC)连接在流感病毒血凝素HA表面形成的融合蛋白CCFKH5-VLPs,在小鼠模型中显示出了针对多种同源和甲型流病毒亚型的广泛交叉保护作用,表明流感病毒保守区域和细胞因子序列的使用在流感通用疫苗的开发设计方面极具潜力[84,85]。将SARS-CoV-2刺突蛋白受体结合结构域(receptor binding domain,RBD)通过化学修饰结合在灭活的流感病毒表面形成的Flu-RBD VLPs疫苗,不仅能够诱导针对SARS-CoV-2 RBD特异性IgG抗体的产生,还能产生流感病毒HA特异性免疫应答,该疫苗在小鼠模型中表现出对SARS-CoV-2 Delta变异体和野生型H1N1灭活病毒的中和能力[86]。相比于游离型RBD和单纯RBD和Flu混合物,这种疫苗具有增强的诱导细胞免疫与体液免疫的能力。
(六)新型冠状病毒疫苗
自WHO自2020年3月将SARS-CoV-2确定为大流行以来,其在全球引起了较高的发病率与死亡率[87]。SARS-CoV-2具有E、M、N和S四种主要结构蛋白,目前大多数疫苗的设计仅通过靶标S蛋白以引发针对RBD的中和抗体来预防感染和降低重症率,大多数基于VLPs的疫苗仍需要通过临床实验的验证[87,88]。使用重组杆状病毒系统对SARS-CoV-2 M和S蛋白进行共表达形成的VLPs疫苗,在仓鼠体内能够诱导中和抗体的产生并且减轻实验动物肺部感染的症状[89]。由Medicago Inc.和葛兰素史克开发的CoVLP使用流感病毒H5N1(A/Indonesia/5/2005)的HA跨膜和胞质区尾部对S蛋白同类区域进行替换,生成的VLPs疫苗其有效性在临床实验中得到了验证,目前加拿大政府已经批准此疫苗在其国内的临床使用[90]。SARS-CoV-2多种值得关注的突变株(variants of concern,VOC)的出现是疫苗设计中面临的挑战之一,可以通过寻找VOC中保守的抗原序列进行疫苗设计。通过对SARS-CoV-2抗原表位进行筛选得到的三个中和性表位(570、636和826)在VOC中高度保守,将这三种多肽表位结合至豇豆花叶病毒(cowpea mosaic virus,CPMV)和噬菌体QβVLPs表面形成的三价疫苗制备成微针贴片进行皮下给药,在动物实验中产生了针对靶表位和S蛋白的高滴度抗体[91]。
四、结语与展望
VLPs纳米颗粒由于其自身独特的空间结构、良好的安全稳定性、具有重复性抗原表位以及与免疫细胞之间的相互作用使其在疫苗研发、药物靶向运输和生物工程材料方面具有重要的临床应用价值。VLPs自身结构的复杂程度,尤其是含有包膜的VLPs纳米颗粒其蛋白表达和工业化生产具有一定挑战。可以通过设计稳定的真核或无细胞表达体系,人工引入能够提高表达体系PTMs能力的蛋白酶类,降低有包膜VLPs的表达难度以提高其产量。传统的方法进行VLPs疫苗的设计和研发测试周期长、过程复杂、结果不确定性较大,很难及时应对病原体快速变异和感染性疾病的快速流行的现状。随着生物信息学和免疫信息学的飞速发展,蛋白质结构功能以及抗原与免疫细胞之间相互作用的预测准确性也得到了极大的提高。这将有利于加快VLPs疫苗的设计研发周期,提高VLPs疫苗的临床有效性,减少或避免VLPs疫苗副作用的产生,进一步降低研发成本,加快VLPs疫苗的临床转化和应用,以期为突发性公共卫生事件的应对和相关疾病的防控提供有效解决手段。
参考文献
[1]Shukla VV,Shah RC.Vaccinations in Primary Care[J].Indian J Pediatr,2018,85(12):1118-1127.DOI:10.1007/s12098-017-2555-2.
[2]Vetter V,Denizer G,Friedland LR,et al.Understanding modern-day vaccines:what you need to know[J].Ann Med,2018,50(2):110-120.DOI:10.1080/07853890.2017.1407035.
[3]Van Herck S,Feng B,Tang L.Delivery of STING agonists for adjuvanting subunit vaccines[J].Adv Drug Deliv Rev,2021,179:114020.DOI:10.1016/j.addr.2021.114020.
[4]Mohsen MO,Bachmann MF.Virus-like particle vaccinology,from bench to bedside[J].Cell Mol Immunol,2022,19(9):993-1011.DOI:10.1038/s41423-022-00897-8.
[5]Nooraei S,Bahrulolum H,Hoseini ZS,et al.Virus-like particles:preparation,immunogenicity and their roles as nanovaccines and drug nanocarriers[J].J Nanobiotechnology,2021,19(1):59.DOI:10.1186/s12951-021-00806-7.
[6]Zhang L,Xu W,Ma X,et al.Virus-like Particles as Antiviral Vaccine:Mechanism,Design,and Application[J].Biotechnol Bioprocess Eng,2023,28(1):1-16.DOI:10.1007/s12257-022-0107-8.
[7]Kheirvari M,Liu H,Tumban E.Virus-like Particle Vaccines and Platforms for Vaccine Development[J].Viruses,2023,15(5):1109.DOI:10.3390/v15051109.
[8]McFall-Boegeman H,Huang X.Mechanisms of cellular and humoral immunity through the lens of VLP-based vaccines[J].Expert Rev Vaccines,2022,21(4):453-469.DOI:10.1080/14760584.2022.2029415.
[9]Mohsen MO,Zha L,Cabral-Miranda G,et al.Major findings and recent advances in virus-like particle(VLP)-based vaccines[J].Semin Immunol,2017,34:123-132.DOI:10.1016/j.smim.2017.08.014.
[10]Al-Barwani F,Donaldson B,Pelham SJ,et al.Antigen delivery by virus-like particles for immunotherapeutic vaccination[J].Ther Deliv,2014,5(11):1223-1240.DOI:10.4155/tde.14.74.
[11]Liu J,Dai S,Wang M,et al.Virus like particle-based vaccines against emerging infectious disease viruses[J].Virol Sin,2016,31(4):279-287.DOI:10.1007/s12250-016-3756-y.
[12]Win SJ,Ward VK,Dunbar PR,et al.Cross-presentation of epitopes on virus-like particles via the MHC I receptor recycling pathway[J].Immunol Cell Biol,2011,89(6):681-688.DOI:10.1038/icb.2010.161.
[13]Donaldson B,Lateef Z,Walker GF,et al.Virus-like particle vaccines:immunology and formulation for clinical translation[J].Expert Rev Vaccines,2018,17(9):833-849.DOI:10.1080/14760584.2018.1516552.
[14]Zepeda-Cervantes J,Ramírez-Jarquín JO,Vaca L.Interaction Between Virus-Like Particles(VLPs)and Pattern Recognition Receptors(PRRs)From Dendritic Cells(DCs):Toward Better Engineering of VLPs[J].Front Immunol,2020,11:1100.DOI:10.3389/fimmu.2020.01100.
[15]Mohsen MO,Gomes AC,Vogel M,et al.Interaction of Viral Capsid-Derived Virus-Like Particles(VLPs)with the Innate Immune System[J].Vaccines(Basel),2018,6(3):37.DOI:10.3390/vaccines6030037.
[16]Roy P,Noad R.Virus-like particles as a vaccine delivery system:myths and facts[J].Adv Exp Med Biol,2009,655:145-158.DOI:10.1007/978-1-4419-1132-2_11.
[17]Ungaro F,Conte C,Quaglia F,et al.VLPs and particle strategies for cancer vaccines[J].Expert Rev Vaccines,2013,12(10):1173-1193.DOI:10.1586/14760584.2013.836909.
[18]Han JC,Li QX,Fang JB,et al.GII.P16-GII.2 Recombinant Norovirus VLPs Polarize Macrophages Into the M1 Phenotype for Th1 Immune Responses[J].Front Immunol,2021,12:781718.DOI:10.3389/fimmu.2021.781718.
[19]Jeong H,Seong BL.Exploiting virus-like particles as innovative vaccines against emerging viral infections[J].J Microbiol,2017,55(3):220-230.DOI:10.1007/s12275-017-7058-3.
[20]Huang X,Wang X,Zhang J,et al.Escherichia coli-derived virus-like particles in vaccine development[J].NPJ Vaccines,2017,2:3.DOI:10.1038/s41541-017-0006-8.
[21]Naskalska A,PyrćK.Virus Like Particles as Immunogens and Universal Nanocarriers[J].Pol J Microbiol,2015,64(1):3-13.
[22]Fuenmayor J,Gòdia F,Cervera L.Production of virus-like particles for vaccines[J].N Biotechnol,2017,39(Pt B):174-180.DOI:10.1016/j.nbt.2017.07.010.
[23]Vogl T,Hartner FS,Glieder A.New opportunities by synthetic biology for biopharmaceutical production in Pichia pastoris[J].Curr Opin Biotechnol,2013,24(6):1094-1101.DOI:10.1016/j.copbio.2013.02.024.
[24]Gupta R,Arora K,Roy SS,et al.Platforms,advances,and technical challenges in virus-like particles-based vaccines[J].Front Immunol,2023,14:1123805.DOI:10.3389/fimmu.2023.1123805.
[25]Liu W,Jiang H,Zhou J,et al.Recombinant dengue virus-like particles from Pichia pastoris:efficient production and immunological properties[J].Virus Genes,2010,40(1):53-59.DOI:10.1007/s11262-009-0418-2.
[26]Saraswat S,Athmaram TN,Parida M,et al.Expression and Characterization of Yeast Derived Chikungunya Virus Like Particles(CHIK-VLPs)and Its Evaluation as a Potential Vaccine Candidate[J].PLoS Negl Trop Dis,2016,10(7):e0004782.DOI:10.1371/journal.pntd.0004782.
[27]Wurm FM.Production of recombinant protein therapeutics in cultivated mammalian cells[J].Nat Biotechnol,2004,22(11):1393-1398.DOI:10.1038/nbt1026.
[28]Zhu J.Mammalian cell protein expression for biopharmaceutical production[J].Biotechnol Adv,2012,30(5):1158-1170.DOI:10.1016/j.biotechadv.2011.08.022.
[29]Li C,Liu F,Liang M,et al.Hantavirus-like particles generated in CHO cells induce specific immune responses in C57BL/6 mice[J].Vaccine,2010,28(26):4294-4300.DOI:10.1016/j.vaccine.2010.04.025.
[30]Fontana D,Kratje R,Etcheverrigaray M,et al.Immunogenic virus-like particles continuously expressed in mammalian cells as a veterinary rabies vaccine candidate[J].Vaccine,2015,33(35):4238-4246.DOI:10.1016/j.vaccine.2015.03.088.
[31]Schwarz H,Zhang Y,Zhan C,et al.Small-scale bioreactor supports high density HEK293 cell perfusion culture for the production of recombinant Erythropoietin[J].J Biotechnol,2020,309:44-52.DOI:10.1016/j.jbiotec.2019.12.017.
[32]Kim C,Kim JD,Seo SU.Nanoparticle and virus-like particle vaccine approaches against SARS-CoV-2[J].J Microbiol,2022,60(3):335-346.DOI:10.1007/s12275-022-1608-z.
[33]Felberbaum RS.The baculovirus expression vector system:A commercial manufacturing platform for viral vaccines and gene therapy vectors[J].Biotechnol J,2015,10(5):702-714.DOI:10.1002/biot.201400438.
[34]Daniell H,Rai V,Xiao Y.Cold chain and virus-free oral polio booster vaccine made in lettuce chloroplasts confers protection against all three poliovirus serotypes[J].Plant Biotechnol J,2019,17(7):1357-1368.DOI:10.1111/pbi.13060.
[35]Nakahira Y,Mizuno K,Yamashita H,et al.Mass Production of Virus-Like Particles Using Chloroplast Genetic Engineering for Highly Immunogenic Oral Vaccine Against Fish Disease[J].Front Plant Sci,2021,12:717952.DOI:10.3389/fpls.2021.717952.
[36]Shirbaghaee Z,Bolhassani A.Different applications of virus-like particles in biology and medicine:Vaccination and delivery systems[J].Biopolymers,2016,105(3):113-132.DOI:10.1002/bip.22759.
[37]Harrison BD,Wilson TM.Milestones in the research on tobacco mosaic virus[J].Philos Trans R Soc Lond B Biol Sci,1999,354(1383):521-529.DOI:10.1098/rstb.1999.0403.
[38]Rasor BJ,Vögeli B,Landwehr GM,et al.Toward sustainable,cell-free biomanufacturing[J].Curr Opin Biotechnol,2021,69:136-144.DOI:10.1016/j.copbio.2020.12.012.
[39]Hu VT,Kamat NP.Cell-free protein synthesis systems for vaccine design and production[J].Curr Opin Biotechnol,2023,79:102888.DOI:10.1016/j.copbio.2022.102888.
[40]Tinafar A,Jaenes K,Pardee K.Synthetic Biology Goes Cell-Free[J].BMC Biol,2019,17(1):64.DOI:10.1186/s12915-019-0685-x.
[41]Taheri T,Seyed N,Mizbani A,et al.Leishmania-based expression systems[J].Appl Microbiol Biotechnol,2016,100(17):7377-7385.DOI:10.1007/s00253-016-7712-4.
[42]Pattyn J,Hendrickx G,Vorsters A,et al.Hepatitis B Vaccines[J].J Infect Dis,2021,224(12Suppl 2):S343-S351.DOI:10.1093/infdis/jiaa668.
[43]Zuckerman JN,Zuckerman AJ,Symington I,et al.Evaluation of a new hepatitis B triple-antigen vaccine in inadequate responders to current vaccines[J].Hepatology,2001,34(4Pt 1):798-802.DOI:10.1053/jhep.2001.27564.
[44]Cai X,Zheng W,Pan S,et al.A virus-like particle of the hepatitis B virus preS antigen elicits robust neutralizing antibodies and T cell responses in mice[J].Antiviral Res,2018,149:48-57.DOI:10.1016/j.antiviral.2017.11.007.
[45]Mobini S,Chizari M,Mafakher L,et al.Computational Design of a Novel VLP-Based Vaccine for Hepatitis B Virus[J].Front Immunol,2020,11:2074.DOI:10.3389/fimmu.2020.02074.
[46]Joe C,Chatterjee S,Lovrecz G,et al.Glycoengineered hepatitis B virus-like particles with enhanced immunogenicity[J].Vaccine,2020,38(22):3892-3901.DOI:10.1016/j.vaccine.2020.03.007.
[47]Whitacre DC,Peters CJ,Sureau C,et al.Designing a therapeutic hepatitis B vaccine to circumvent immune tolerance[J].Hum Vaccin Immunother,2020,16(2):251-268.DOI:10.1080/21645515.2019.1689745.
[48]Huang J,Liao Q,Ooi MH,et al.Epidemiology of Recurrent Hand,Foot and Mouth Disease,China,2008-2015[J].Emerg Infect Dis,2018,24(3):432-442.DOI:10.3201/eid2403.171303.
[49]Zhu P,Ji W,Li D,et al.Current status of hand-foot-and-mouth disease[J].J Biomed Sci,2023,30(1):15.DOI:10.1186/s12929-023-00908-4.
[50]Wang Z,Zhou C,Gao F,et al.Preclinical evaluation of recombinant HFMD vaccine based on enterovirus 71(EV71)virus-like particles(VLP):Immunogenicity,efficacy and toxicology[J].Vaccine,2021,39(31):4296-4305.DOI:10.1016/j.vaccine.2021.06.031.
[51]Cao L,Mao F,Pang Z,et al.Protective effect of enterovirus-71(EV71)virus-like particle vaccine against lethal EV71 infection in a neonatal mouse model[J].Mol Med Rep,2015,12(2):2473-2480.DOI:10.3892/mmr.2015.3680.
[52]Zhao H,Li HY,Han JF,et al.Novel recombinant chimeric virus-like particle is immunogenic and protective against both enterovirus 71 and coxsackievirus A16 in mice[J].Sci Rep,2015,5:7878.DOI:10.1038/srep07878.
[53]Kim HJ,Son HS,Lee SW,et al.Efficient expression of enterovirus 71 based on virus-like particles vaccine[J].PLoS One,2019,14(3):e0210477.DOI:10.1371/journal.pone.0210477.
[54]Krug PW,Wang L,Shi W,et al.EV-D68 virus-like particle vaccines elicit cross-clade neutralizing antibodies that inhibit infection and block dissemination[J].Sci Adv,2023,9(20):eadg6076.DOI:10.1126/sciadv.adg6076.
[55]Xu Y,Ma S,Huang Y,et al.Virus-like particle vaccines for poliovirus types 1,2,and 3 with enhanced thermostability expressed in insect cells[J].Vaccine,2019,37(17):2340-2347.DOI:10.1016/j.vaccine.2019.03.031.
[56]Bahar MW,Porta C,Fox H,et al.Mammalian expression of virus-like particles as a proof of principle for next generation polio vaccines[J].NPJ Vaccines,2021,6(1):5.DOI:10.1038/s41541-020-00267-3.
[57]Pielnaa P,Al-Saadawe M,Saro A,et al.Zika virus-spread,epidemiology,genome,transmission cycle,clinical manifestation,associated challenges,vaccine and antiviral drug development[J].Virology,2020,543:34-42.DOI:10.1016/j.virol.2020.01.015.
[58]Mittal S,Federman HG,Sievert D,et al.The Neurobiology of Modern Viral Scourges:ZIKV and COVID-19[J].Neuroscientist,2022,28(5):438-452.DOI:10.1177/10738584211009149.
[59]Liu Y,Liu J,Du S,et al.Evolutionary enhancement of Zika virus infectivity in Aedes aegypti mosquitoes[J].Nature,2017,545(7655):482-486.DOI:10.1038/nature22365.
[60]Garg H,Mehmetoglu-Gurbuz T,Joshi A.Recent Advances in Zika Virus Vaccines[J].Viruses,2018,10(11):631.DOI:10.3390/v10110631.
[61]Cimica V,Galarza JM,Rashid S,et al.Current development of Zika virus vaccines with special emphasis on virus-like particle technology[J].Expert Rev Vaccines,2021,20(11):1483-1498.DOI:10.1080/14760584.2021.1945447.
[62]Boigard H,Alimova A,Martin GR,et al.Zika virus-like particle(VLP)based vaccine[J].PLoS Negl Trop Dis,2017,11(5):e0005608.DOI:10.1371/journal.pntd.0005608.
[63]Vang L,Morello CS,Mendy J,et al.Zika virus-like particle vaccine protects AG129 mice and rhesus macaques against Zika virus[J].PLoS Negl Trop Dis,2021,15(3):e0009195.DOI:10.1371/journal.pntd.0009195.
[64]Carrera J,Aktepe TE,Earnest L,et al.Adenovirus vector produced Zika virus-like particles induce a long-lived neutralising antibody response in mice[J].Vaccine,2023,41(33):4888-4898.DOI:10.1016/j.vaccine.2023.06.068.
[65]Cimica V,Williams S,Adams-Fish D,et al.Zika Virus-Like Particle(VLP)vaccine displaying Envelope(E)protein CD loop antigen elicits protective and specific immune response in a murine model[J].Biochem Biophys Res Commun,2020,529(3):805-811.DOI:10.1016/j.bbrc.2020.05.161.
[66]Diamos AG,Pardhe MD,Sun H,et al.Codelivery of improved immune complex and virus-like particle vaccines containing Zika virus envelope domainⅢsynergistically enhances immunogenicity[J].Vaccine,2020,38(18):3455-3463.DOI:10.1016/j.vaccine.2020.02.089.
[67]Soliman M,Oredein O,Dass CR.Update on Safety and Efficacy of HPV Vaccines:Focus on Gardasil[J].Int J Mol Cell Med,2021,10(2):101-113.DOI:10.22088/IJMCM.BUMS.10.2.101.
[68]Roden R,Stern PL.Opportunities and challenges for human papillomavirus vaccination in cancer[J].Nat Rev Cancer,2018,18(4):240-254.DOI:10.1038/nrc.2018.13.
[69]Kuter BJ,Garland SM,Giuliano AR,et al.Current and future vaccine clinical research with the licensed 2-,4-,and 9-valent VLP HPV vaccines:What′s ongoing,what′s needed?[J].Prev Med,2021,144:106321.DOI:10.1016/j.ypmed.2020.106321.
[70]Petrosky E,Bocchini JA Jr,Hariri S,et al.Use of 9-valent human papillomavirus(HPV)vaccine:updated HPV vaccination recommendations of the advisory committee on immunization practices[J].MMWR Morb Mortal Wkly Rep,2015,64(11):300-304.
[71]Dewi KS,Chairunnisa S,Swasthikawati S,et al.Production of codon-optimized Human papillomavirus type 52 L1 virus-like particles in Pichia pastoris BG10 expression system[J].Prep Biochem Biotechnol,2023,53(2):148-156.DOI:10.1080/10826068.2022.2048262.
[72]Li M,Liang Z,Chen C,et al.Virus-Like Particle-Templated Silica-Adjuvanted Nanovaccines with Enhanced Humoral and Cellular Immunity[J].ACS Nano,2022,16(7):10482-10495.DOI:10.1021/acsnano.2c01283.
[73]Zhai L,Peabody J,Pang YS,et al.A novel candidate HPV vaccine:MS2 phage VLP displaying a tandem HPV L2 peptide offers similar protection in mice to Gardasil-9[J].Antiviral Res,2017,147:116-123.DOI:10.1016/j.antiviral.2017.09.012.
[74]Qian C,Yang Y,Xu Q,et al.Characterization of an Escherichia coli-derived triple-type chimeric vaccine against human papillomavirus types 39,68 and 70[J].NPJ Vaccines,2022,7(1):134.DOI:10.1038/s41541-022-00557-y.
[75]Zhang X,Meng D,Li H,et al.Validation of Luminex immunological and competitive Luminex immunological assays for clinical immunogenicity assessment of a 14-valent recombinant human papillomavirus vaccine[J].J Med Virol,2023,95(8):e29050.DOI:10.1002/jmv.29050.
[76]Olczak P,Matsui K,Wong M,et al.RG2-VLP:a Vaccine Designed to Broadly Protect against Anogenital and Skin Human Papillomaviruses Causing Human Cancer[J].J Virol,2022,96(13):e0056622.DOI:10.1128/jvi.00566-22.
[77]Pushko P,Tretyakova I.Influenza Virus Like Particles(VLPs):Opportunities for H7N9 Vaccine Development[J].Viruses,2020,12(5):518.DOI:10.3390/v12050518.
[78]Quan FS,Lee YT,Kim KH,et al.Progress in developing virus-like particle influenza vaccines[J].Expert Rev Vaccines,2016,15(10):1281-1293.DOI:10.1080/14760584.2016.1175942.
[79]Smith T,O′Kennedy MM,Wandrag D,et al.Efficacy of a plant-produced virus-like particle vaccine in chickens challenged with Influenza A H6N2 virus[J].Plant Biotechnol J,2020,18(2):502-512.DOI:10.1111/pbi.13219.
[80]Li M,Guo P,Chen C,et al.Bacteriophage T4 Vaccine Platform for Next-Generation Influenza Vaccine Development[J].Front Immunol,2021,12:745625.DOI:10.3389/fimmu.2021.745625.
[81]Kim KH,Lee YT,Park S,et al.Neuraminidase expressing virus-like particle vaccine provides effective cross protection against influenza virus[J].Virology,2019,535:179-188.DOI:10.1016/j.virol.2019.07.008.
[82]Smith GE,Flyer DC,Raghunandan R,et al.Development of influenza H7N9 virus like particle(VLP)vaccine:homologous A/Anhui/1/2013(H7N9)protection and heterologous A/chicken/Jalisco/CPA1/2012(H7N3)cross-protection in vaccinated mice challenged with H7N9 virus[J].Vaccine,2013,31(40):4305-4313.DOI:10.1016/j.vaccine.2013.07.043.
[83]Hendin HE,Lavoie PO,Gravett JM,et al.Elimination of receptor binding by influenza hemagglutinin improves vaccine-induced immunity[J].NPJ Vaccines,2022,7(1):42.DOI:10.1038/s41541-022-00463-3.
[84]Nerome K,Imagawa T,Sugita S,et al.The potential of a universal influenza virus-like particle vaccine expressing a chimeric cytokine[J].Life Sci Alliance,2023,6(1):e202201548.DOI:10.26508/lsa.202201548.
[85]Imagawa T,Arasaki Y,Maegawa K,et al.Advancing usability of an influenza hemagglutinin virus-like particle vaccine expressing a chimeric cytokine[J].Virol J,2023,20(1):102.DOI:10.1186/s12985-023-02076-1.
[86]Wang Z,Li Z,Shi W,et al.A SARS-CoV-2 and influenza double hit vaccine based on RBD-conjugated inactivated influenza A virus[J].Sci Adv,2023,9(25):eabo4100.DOI:10.1126/sciadv.abo4100.
[87]Yadav T,Kumar S,Mishra G,et al.Tracking the COVID-19 vaccines:The global landscape[J].Hum Vaccin Immunother,2023,19(1):2191577.DOI:10.1080/21645515.2023.2191577.
[88]Yilmaz IC,Ipekoglu EM,Bulbul A,et al.Development and preclinical evaluation of virus-like particle vaccine against COVID-19 infection[J].Allergy,2022,77(1):258-270.DOI:10.1111/all.15091.
[89]Volkmann A,Koopman G,Mooij P,et al.A Capsid Virus-Like Particle-Based SARS-CoV-2 Vaccine Induces High Levels of Antibodies and Protects Rhesus Macaques[J].Front Immunol,2022,13:857440.DOI:10.3389/fimmu.2022.857440.
[90]Ward BJ,Gobeil P,Séguin A,et al.Phase 1 randomized trial of a plant-derived virus-like particle vaccine for COVID-19[J].Nat Med,2021,27(6):1071-1078.DOI:10.1038/s41591-021-01370-1.

来源:中华预防医学杂志


