您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-10-25 09:21
肿瘤治疗性mRNA疫苗是一种利用mRNA技术开发的疫苗,其核心原理是将编码肿瘤相关或肿瘤特异性抗原的mRNA引入人体,利用人体自身的细胞机制来生产这些抗原蛋白,从而激活机体的免疫系统,产生针对肿瘤的特异性免疫反应。目前,多个抗肿瘤的mRNA癌症疫苗临床试验正在进行中,例如Moderna的mRNA-4157/V940是一款靶向34种肿瘤新生抗原的疫苗,与PD-1抗体Keytruda联用,在临床2b期试验中显示,与Keytruda单药治疗相比,可以显著降低III、IV期黑色素瘤患者在肿瘤完全切除后的复发或死亡风险达44%。预防性mRNA疫苗是通过表达特定抗原,激活机体免疫系统,达到预防某些疾病如感染的目的,如新冠mRNA疫苗。
二者的区别主要体现在前者主要用于肿瘤患者,后者则多用于健康人群,通过模拟病原体特征来激活免疫系统。所以免疫原也是不同的,前者主要是肿瘤特异性抗原(TSA)或肿瘤相关抗原(TAA),这些抗原在肿瘤细胞中表达,但正常细胞中不表达或表达量较低。后者则编码病原体的特定抗原,这些抗原诱导机体产生免疫记忆,当真正遇到病原体时,免疫系统能够迅速响应。另外,二者激发的免疫反应也不太一样。肿瘤治疗性疫苗多为细胞免疫,需要诱导强烈的效应免疫反应,特别是细胞毒性T细胞的活性,以直接杀死肿瘤细胞。而预防性疫苗多以体液免疫为主,伴随细胞免疫,不一定需要强烈的效应免疫反应。
那么都是疫苗类产品,二者在非临床研究过程中有哪些相同和异同之处呢?结合CDE 2024年10月最新发表的《肿瘤治疗性mRNA疫苗非临床评价的考虑》一文和CDE 2024年8月发布的《预防用mRNA疫苗非临床研究技术指导原则》征求意见稿,及其它相关指导原则和文献,略作分析。
受试物
原则上非临床受试物均需要代表临床拟用样品。
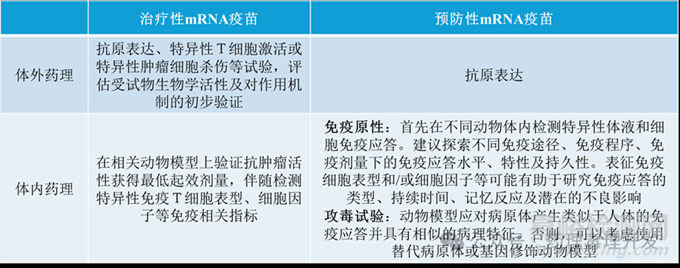
药理学
体外部分侧重点有些区别,预防性mRNA疫苗重在目的抗原的表达,毕竟体外环境很难模拟体液免疫情况,如抗体的产生。治疗性mRNA疫苗除了研究抗原表达,还建议评估T细胞的激活及对肿瘤的杀伤作用。
体内部分研究内容与适应症和作用机制有关。治疗性疫苗通过荷瘤鼠可以评估药效,伴随考察细胞免疫即可。预防性疫苗主要通过体液免疫发挥作用,则需要重点考察免疫原性情况。而且预防性疫苗的目的不只是产生抗体,还需要发挥抗病原体的药效作用,需要开展通常所说的活毒的攻毒试验,也叫保护力试验。如果没有合适的病原体,可以考虑动物源的替代病原体。或者基因修饰动物,如hACE2转基因小鼠(表达SARS-CoV2病毒受体)用于新冠疫苗的保护力试验。
另外,对于预防性疫苗,由于本身目的基因序列就来自外源性病原体,不涉及动物源基因样品。不过,治疗性疫苗多来自人体肿瘤成分抗原,如果无相关动物种属,可以考虑动物源基因样品。
药代动力学
药代动力学方面,两类疫苗均需要开展组织分布试验。治疗性疫苗组织分布要求具体可参考ICH S12《基因治疗产品非临床生物分布考虑》。不过,该指南不适用于预防性疫苗。CDE对于预防性mRNA疫苗的组织分布要求描述较为简单,至少要达到考察mRNA和LNP(或脂质成分)在注射部位及全身组织器官的分布,以及在这些组织中的存续时间的目的。

毒理学
具体如下表所示。

新辅料
两种疫苗常用递送系统是LNP。如果使用新脂质成分或工艺重大变更的LNP,需要对LNP开展非临床安全性评价。如含新阳离子脂质的LNP,应对其新阳离子脂质成分或LNP进行遗传毒性研究。可伴随疫苗或单独开展必要的安全药理及一般毒理试验。
当然,预防性mRNA疫苗还有些特殊考虑如炎症反应、修饰核苷的非预期及严重毒性反应、多价及联合mRNA疫苗考虑、平台技术加速研发的考虑,适用于一些特殊案例和场景,不再赘述。

来源:药理毒理开发


