您当前的位置:检测资讯 > 实验管理
嘉峪检测网 2024-11-06 08:14
实时荧光定量PCR(简称RT-qPCR),通常将提取细胞或者组织的总RNA逆转录成cDNA。之后以cDNA为模板,以dNTP 为底物,对扩增出的DNA进行定量分析。
在这里以下是对miR-A的qPCR数据(来自Bio-Rad仪器)进行统计分析的详细步骤:
(1)以miR-A为目的基因,内参为U6:检测相对于对照组,实验组miR-A的相对mRNA表达水平,以下为Bio-Rad仪器导出的数据:
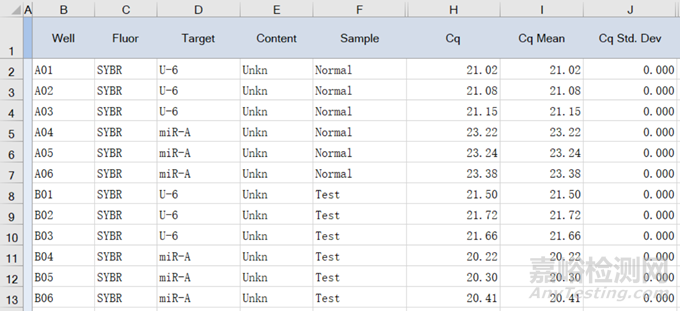
图1原始数据
(2)拿到原始数据我们一般只需看图1中标红的①②③列数据,并将数据复制粘贴值新的工作表中,对数据进一步处理。对目的基因进行相对定量分析,则使用ΔΔCt法,Bio-Rad仪器中的Cq即为基因的“CT值”,计算公式如下:
实验组目标基因相对于对照组的相对表达量=2-ΔΔCt
1)A:计算Ct值:分别测定目的基因和内参基因在实验组和对照组中的Ct值,即原始数据中的Cq值。
B:计算ΔCt值:对于每个样本,计算目的基因与内参基因的Ct值之差(ΔCt = Ct目的基因-Ct内参基因)。
C:计算ΔΔCt值:实验组ΔCt值与对照组ΔCt值之差(ΔΔCt = ΔCt实验组 - ΔCt对照组)。
(3)计算原始数据,我们在新的Excel工作表中制作以下表头:
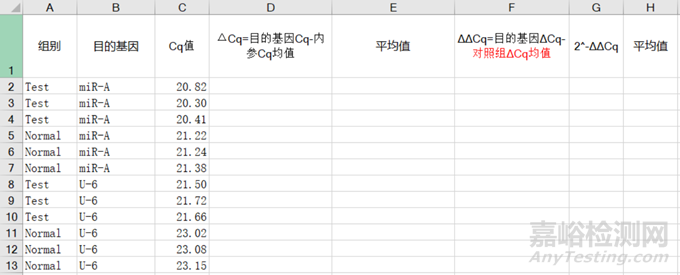
图2 表头以及数据统计
(4)具体计算步骤:
1)用【average】函数分别求出对照组和实验组中U6内参Cq值的平均值 ;
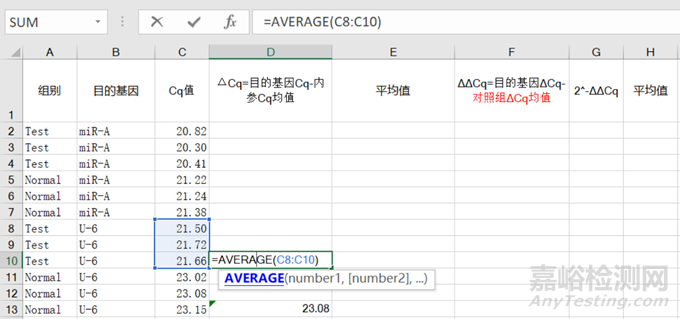
图3 内参Cq值的平均值
注意:目的基因的Cq值减去内参基因的Cq值的平均值,是用于归一化目的基因和内参基因的反应量,从而消除实验操作和RNA提取效率等因素的影响,得到更准确的相对定量结果。
2)随后,再用①对照组和实验组目的基因的各个Cq分别减去②内参Cq值的均值即为③ΔCq;之后求出④对照组(目的基因Cq-内参Cq均值)的均值;
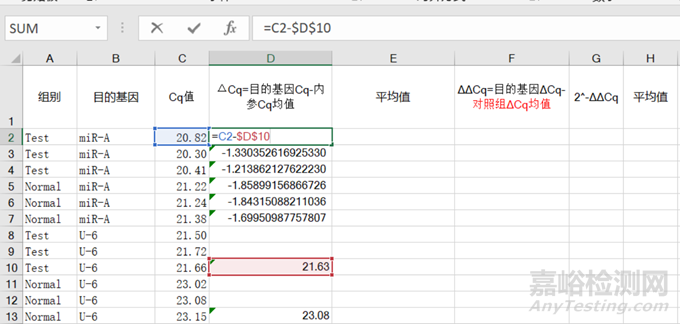
图4 实验组ΔCq
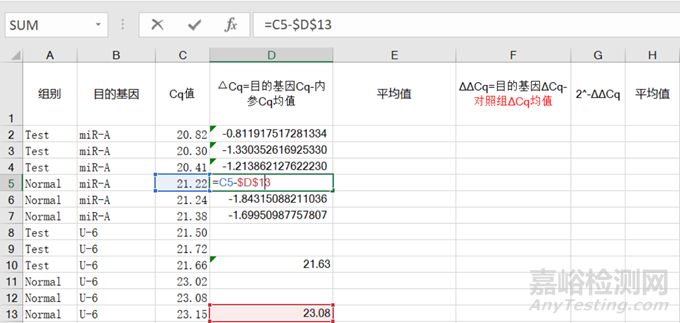
图5 对照组ΔCq
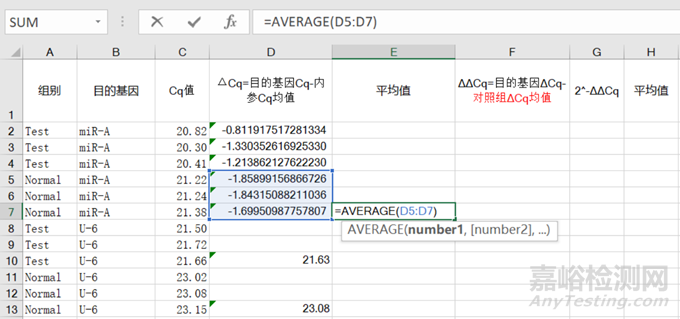
图6 对照组(目的基因Cq-内参Cq均值)的均值
3)③目的基因的各组ΔCq值再减去④对照组(目的基因Cq-内参Cq均值)的均值即为⑤ΔΔCq,最后用【Power】函数计算2-ΔΔCq值,:
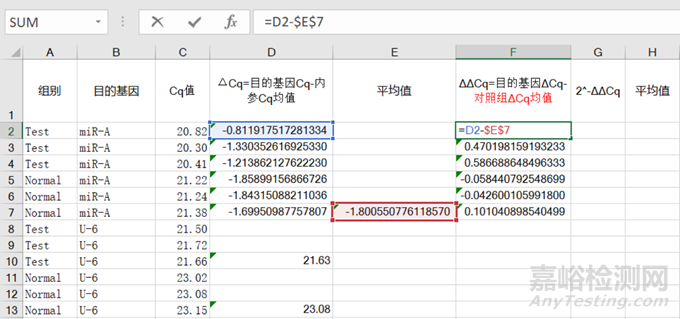
图7 ΔΔCq计算
4)最后用⑥【Power】函数计算2-ΔΔCq值,excel选择下拉得到所有值,具体计算如下:如图3:
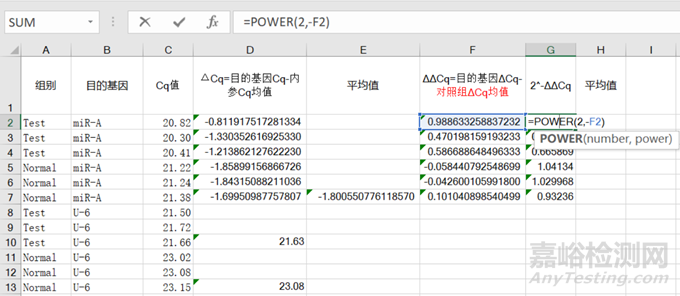
图8 【Power】函数计算2-ΔΔCq值
5)整体计算数据如下,我们最后求出三次技术重复的平均值⑦,即为我们一次生物学重复的值:
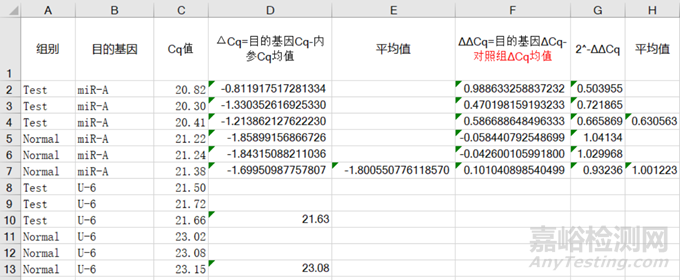
图 9 整体数据计算
(5)因此,步骤(4)中计算得出了一组数据即为一次生物学重复,将对照组的目的基因表达标准化。相对于对照组,实验组的miR-A的相对表达量降低了;但实际上我们需要三次生物学重复才能得到这样的结论。
注意 :技术重复是指相同的样品同时做3-4个平行,用于消除人为的系统误差,筛选测出比较准确的值;而生物学重复是指我们需要消除样品的差异,避免结论的偶然性,即不能用一次生物学重复便得出结论。例如一些临床样本可能就需要一般患者和健康者的样本数要n>15。图3中Test/Normal的3个数据分别为一次技术重复,一组为一次生物学重复。
(6)统计分析:使用适当的统计检验方法(如T检验、ANOVA等)来评估不同组之间基因表达差异的显著性。图中我们以三个技术重复为例用graphpad prism作为分析miR-A的相对表达量。结果用Graphpad软件作图如下:
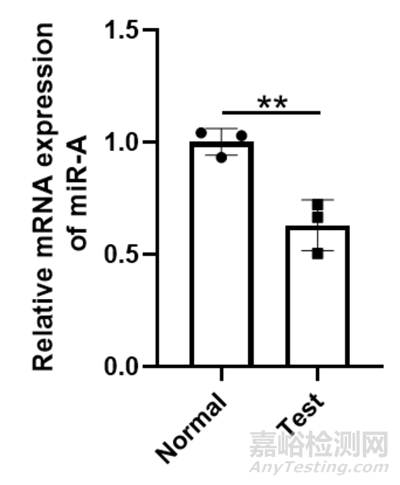
图 10 miR-A的相对mRNA表达水平
注意事项:
(1)对于原始数据,我们要去除潜在的干扰物质、识别和处理异常值(如由于实验误差或仪器故障导致的极端值)。
(2)确保每个样本至少有三次生物学重复,以提高数据的可靠性。
(3)得到数据后,我们可以在Bio-RadPCR仪上查看数据的有效性,例如查看数据溶解曲线是否为双峰,引物特异性是否有问题;查看扩增曲线、扩增效率是否正常等。
(4)另外还需要注意的是一组数据之间正常的数据重复需要可靠,因此一个基因的实验组或者对照组我们通常会设置3-4个复孔减少加样误差,通常的技术重复孔之间数据相差±0.5个Cq值均不能使用。

来源:实验老司机


