您当前的位置:检测资讯 > 实验管理
嘉峪检测网 2024-11-12 08:26
1、石蜡切片的质量直接关系到免疫荧光的染色效果。因此,石蜡切片最好交由技术熟练的人员操作,新手可能会存在即便将切片机调整至3 μm但实际厚度远大于3 μm的情况,从而导致切片太厚,细胞层叠,影响观察。亦有可能因技术不熟练而破坏组织结构,影响实验效果;
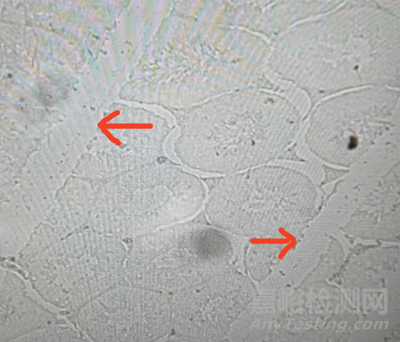
(刀片变钝,明场下明显的刀痕)

(切片太厚,细胞堆叠)
2、在进行抗原修复时,要尽量使抗原修复液没过载玻片,以防加热过程中过度挥发导致干片,同样,在其他操作时也因避免干片现象出现,否则可能会造成高背景及非特异性标记;
3、使用组化笔画圈时,最好离组织稍微远一点,否则组化笔中的物质也有可能附着在组织上,影响染色效果。该操作主要是起到一个阻隔的作用,主要目的是防止液体外溢。在画圈时需要注意稍微等组化圈干一会儿再进行滴加所需物质,且最好多画几次以防液体外溢,孵育过程中也要时不时进行观察,以防干片;
4、荧光二抗的保存以及孵育荧光二抗之后的所有操作均需避光操作,以防荧光猝灭;
5、进行图片采集时,荧光物质受到激发光激发后会立马猝灭,因此最好先在明场下找好准备采集的视野后再切换到暗场。对于显微镜的选择荧光显微镜和共聚焦显微镜均可,通常共聚焦显微镜拍得会更清楚,但在参数调整合适的情况下,荧光显微镜拍摄足以满足日常的拍摄需要,故而无需非要采用共聚焦显微镜进行拍摄;
6、关于石蜡切片的保存:短期保存可放置于室温,如若需要较长期保存,可将其置于密封袋中,在4℃冰箱保存,但最好在短期内使用,放置时间较长会破坏其抗原性,进而影响染色效果;
7、关于定位出错或无标记:比如原本定位在核的染到了质上,或者核质均有等情况。从以下几点考虑:抗体是否得到了妥善保存,DAPI染液是否过期,抗原修复是否到位,抗体是否适用于石蜡切片免疫荧光,一抗与二抗的种属选择是否正确等;

(DAPI过期,染色模糊)
8、关于高背景:考虑洗涤是否彻底,所用封闭血清的质量,脱蜡是否彻底,是否有干片现象,是否滴加了过多DAPI等;
9、关于自发荧光:石蜡切片免疫荧光不可避免会产生自发荧光。因此,脱蜡必须彻底,封闭、洗涤等过程也需充分;抗体在使用前最好先离心处理并尽量从上方吸取,抗体的浓度过高也会产生自发荧光,所以可以预实验摸清最合适的抗体浓度再进行正式实验;如若自发荧光很强,严重影响染色效果,亦可采用自发荧光去除剂进行去除;
10、关于透膜:透膜通常采用曲拉通(Triton X-100),且一般采用0.1%的浓度。但对于石蜡切片需不需要透膜也是存在不同观点,有的观点认为需要透膜,有的观点则认为切片过程中已经将核暴露了出来,所以石蜡切片免疫荧光没有必要用,做细胞的才用;另有观点认为与蛋白有关,若目的蛋白为核蛋白,则需要用;若目的蛋白在胞质,则不需要用。此外,对于透膜的时间也是各有不同,有的会将其与封闭液混合进而处理1h,有的则与一抗混合,过夜处理。个人认为具体情况按自己的实验结果来定,一次性设置多个对照组摸清条件进行实验,比如我们课题组之前实验发现,透不透膜对我们所做的目的蛋白定位毫无影响,但透膜处理反而影响与其共染的另一个蛋白的着色效果,所以后期就没进行透膜处理;
11、关于DAPI染色:过多的DAPI染液会带来高背景,影响观察,所以只需要薄薄一层,覆盖组织即可,当然目前市面上有的抗荧光衰减封片剂里已经包含了DAPI染液,无需单独染色;
12、关于封片:一般情况下染色完毕后会立即进行拍摄采图,而拍摄后荧光很快猝灭,中性树胶也会带来自发荧光,所以封片的意义不太大。一般滴加抗荧光衰减封片剂后盖上盖玻片进行观察即可,如若担心盖玻片移动,可在盖玻片四周用中性树胶进行固定。

(脱片导致组织堆叠)
13、关于半定量分析:免疫荧光的半定量分析一直以来争议都比较大,有的专家认为太多的主观因素混杂其中导致这一分析结果过于主观而无分析意义,而有的专家也认为只是大致进行分析,所以还是有必要分析的,所以大家视情况而定即可。

来源:实验老司机


