您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-12-06 08:16
摘 要: 建立高效液相色谱法同时测定平喘合剂中芍药苷、黄芩苷含量。以Agilent ZORBAX-C18色谱柱(250 mm×4.6 mm,5 μm)为分析柱,以乙腈-0.1%磷酸溶液为流动相,梯度洗脱,流速为1.0 mL/min,柱温为25 ℃,芍药苷、黄芩苷的检测波长分别为232、278 nm。芍药苷、黄芩苷的质量浓度分别在1.180~5.900、9.450~47.250 μg/mL范围内与其色谱峰面积线性关系良好,相关系数均大于0.999。样品平均回收率分别为99.83%、102.31%,测定结果的相对标准偏差分别为2.07%、1.29%(n=6)。该方法简便、准确度高、专属性好,可用于平喘合剂的质量控制。
关键词: 平喘合剂; 高效液相色谱; 芍药苷; 黄芩苷
平喘合剂为山东省中医院儿科常用中药院内制剂,是多年临床实践经验的总结和积累,具有独特的疗效和临床应用价值,由麻黄、苦杏仁、白芍、黄芩等14味药组成,具有温肺化痰,定喘,清里热的功效,临床上常用于外感风寒,内有里热,咳喘哮鸣,痰壅气促,无汗烦躁等症。儿童体质特殊,病情变化迅速,临床上安全有效可控的儿童治疗药物较少[1‒3],2022年,为更好满足儿童用药需求,山东省药品监督管理局、山东省卫生健康委员会确定平喘合剂为全省可用于治疗儿童季节性流感的中药制剂,临床实践证实其在流感高发期间发挥了重要的作用,深受广大患者的信赖。
2021年平喘合剂被收载入《山东省医疗机构制剂规范》(第一版第四册),但平喘合剂中药味较多且为儿科常用药,现行标准中只收录单一化学成分的含量测定,未能全面有效的控制复方制剂的质量情况。相关研究表明[4],建立多指标成分的含量测定方法能更全面的反映制剂的质量,而相同成分在不同的分析环境下其最大吸收波长不尽相同。在中成药复方制剂的质量标准控制中,很多文献报道了运用高效液相色谱法同时测定芍药苷和黄芩苷的含量,但大都是选择单一波长或《中华人民共和国药典》中记载的波长,而相同成分在不同的分析条件、制剂环境中其最大吸收波长是不同的[5‒8]。笔者以芍药苷、黄芩苷为指标,对待测成分进行全波长扫描以获得待测成分的最大吸收波长,同时首次采用高效液相色谱双波长法对平喘合剂进行方法学考察并建立完整的含量测定体系,以确保临床用药的安全、有效和质量可控。
1、 实验部分
1.1 主要仪器与试剂
高效液相色谱仪:Agilent 1260Ⅱ型,二极管阵列检测器(DAD),美国安捷伦科技有限公司。
数控超声波清洗器:KQ-250B型,昆山市超声仪器有限公司。
电子天平:XPE205,感量为0.01 mg,瑞士梅特勒-托利多仪器公司。
乙腈:色谱纯,安徽天地高纯溶剂有限公司。
实验用水:纯净水。
芍药苷对照品:质量分数为97.2%,批号为110736-202246,中国食品药品检定研究院。
黄芩苷对照品:质量分数为97.2%,批号为110715-202223,中国食品药品检定研究院。
实验用其他试剂均为分析纯。
平喘合剂:批号分别为24022302、24022401、24022501,山东中医药大学附属医院。
1.2 色谱条件
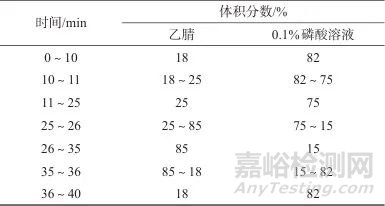
色谱柱:Agilent ZORBAX-C18柱(250 mm×4.6 mm,5 μm,美国安捷伦科技有限公司);流动相:A相为乙腈,B相为0.1%(体积分数)磷酸溶液;洗脱方式:梯度洗脱,流量为1.0 mL/min,洗脱程序见表1;检测波长:232 nm (芍药苷)、278 nm (黄芩苷);柱温:25 ℃;进样体积:10 μL。
表1 流动相梯度洗脱程序
Tab. 1 Gradient elution program of the mobile phase
1.3 溶液配制
混合对照品溶液:精密称取芍药苷对照品4.00 mg,置于50 mL容量瓶中,加甲醇溶解并稀释至标线,摇匀,制得芍药苷对照品储备液。精密称取黄芩苷对照品5.40 mg,置于10 mL容量瓶中,加甲醇溶解并稀释至标线,摇匀,制得黄芩苷对照品储备液。分别精密量取上述两种对照品储液各1 mL,置于同一25 mL容量瓶中,加甲醇稀释至标线,摇匀,即得混合对照品溶液,其中芍药苷、黄芩苷质量浓度分别为3.11、21.00 μg/mL。
平喘合剂样品溶液:精密量取平喘合剂1 mL,置于25 mL容量瓶中,加70%乙醇溶解并稀释至标线,混匀,过滤,精密量取续滤液1 mL,置于10 mL容量瓶中,加70%乙醇溶解并稀释至标线,取续滤液,即得平喘合剂样品溶液。
阴性样品溶液:按平喘合剂处方中药材比例及制备工艺,制备缺白芍及黄芩的阴性样品,按平喘合剂样品溶液方法配制。
1.4 定量方法
取混合对照品溶液、平喘合剂样品溶液、阴性样品溶液,按照1.2仪器工作条件测定,以色谱峰面积外标法计算芍药苷及黄芩苷的含量。
2、 结果和讨论
2.1 样品提取条件的考察
取平喘合剂(批号24022302)为待测对象,进行了提取溶剂及提取方法的考察。
提取溶剂分别选择甲醇、70%乙醇(体积比,下同)、50%甲醇对平喘合剂进行提取试验[9‒10],结果表明,以70%乙醇为提取溶剂时,芍药苷及黄芩苷的色谱峰峰面积较大,峰形及分离度较好,故采用70%乙醇为提取溶剂。
提取方法分别选择直接定容法、超声法、回流法进行提取试验[11‒12],结果显示,直接定容法与超声法和回流法所得目标物质的色谱峰峰面积差别不大,直接定容法操作简便快速,故选择提取方法为直接定容法。
2.2 色谱条件的选择
2.2.1 流动相的选择
试验参考《中华人民共和国药典》2020版一部“白芍”及“黄芩”项下的含量测定方法进行流动相的优选[13],分别选用甲醇-0.4%磷酸溶液、乙腈-0.1%磷酸溶液、甲醇-0.1%磷酸溶液为流动相对平喘合剂中芍药苷、黄芩苷进行含量测定试验考察[14‒15],结果发现,以甲醇-0.4%磷酸溶液和甲醇-0.1%磷酸溶液为流动相时,虽调节比例及梯度能最终实现较好分离度,但重复进样时对下一个样品的分析有影响,有杂峰出现使得芍药苷和黄芩苷的分离度达不到1.5,而乙腈-0.1%磷酸溶液为流动相时芍药苷、黄芩苷峰形和分离效果在重复进样时都较好,因此选择流动相为乙腈-0.1%磷酸溶液。
2.2.2 检测波长的选择
采用DAD检测器在220~400 nm波长下对芍药苷、黄岑苷对照品溶液进行全波长扫描,结果见图1。由图1可见,芍药苷、黄芩苷分别在232、278 nm处有最大吸收,因此选择芍药苷、黄芩苷的检测波长分别为232、278 nm。
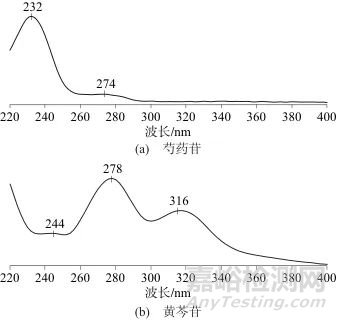
图1 芍药苷、黄芩苷光谱图
Fig. 1 Spectrographs of Paeoniflorin and Baicalin
2.2.3 柱温的选择
将柱温分别设置为25、30、35 ℃进行试验。结果表明,当温度在35 ℃时,色谱峰基线上漂不稳;当温度为30 ℃时,目标峰的分离度不佳;当温度为25 ℃时,色谱峰基线平稳且芍药苷、黄芩苷的色谱峰峰形及分离度良好。
2.3 分析方法验证
2.3.1 专属性试验
取芍药苷、黄芩苷混合对照品溶液、平喘合剂样品溶液、阴性样品溶液,在1.2色谱条件下分别进样检测,芍药苷、黄芩苷混合对照品溶液、平喘合剂样品溶液分别在其相同的保留时间处有同一色谱峰,阴性样品溶液中无相应的色谱峰,表明该方法专属性良好。上述溶液色谱图如图2所示。
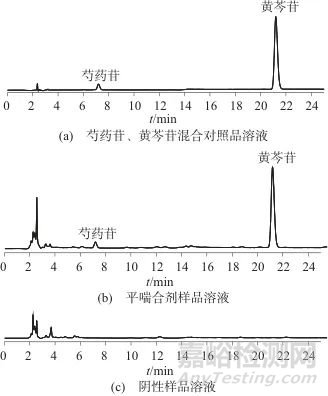
图2 芍药苷、黄芩苷混合对照品溶液、平喘合剂样品溶液、阴性样品溶液色谱图
Fig. 2 Chromatograms of paeoniflorin and baicalein mixed standard solution, Pingchuan sample solution, and blank sample solution
2.3.2 线性关系考察
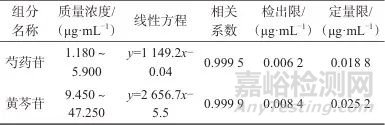
用自动进样器依次吸取混合对照品溶液1、2、3、4、5、6 μL注入高效液相色谱仪,分别测定峰面积。以对照品的质量浓度x为横坐标,峰面积y为纵坐标,分别绘制芍药苷及黄芩苷的标准曲线,计算线性方程和相关系数。
取芍药苷对照品溶液、黄芩苷对照品溶液,用甲醇逐级稀释,以信噪比(S/N)为3∶1时对应的溶液中目标物的质量浓度为方法检出限,以10∶1时对应的溶液中目标物的质量浓度为定量限,结果见表2。
表2 质量浓度线性范围、线性方程、相关系数、检出限及定量限
Tab. 2 Linear range of mass concentration,linear equation,correlation coefficient,detection limit and quantification limit
2.3.3 精密度试验
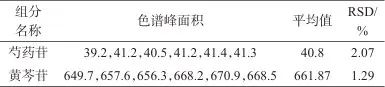
取平喘合剂(批号24022302)样品6份,制备平喘合剂样品溶液,按1.2色谱条件进行分析,记录色谱峰面积并计算芍药苷及黄芩苷的含量,结果见表3。由表3可见,测定结果的相对标准偏差(RSD)分别为2.07%和1.29%,说明该方法精密度良好,满足测定要求。
表3 精密度试验结果
Tab. 3 Results of precision test
2.3.4 稳定性试验
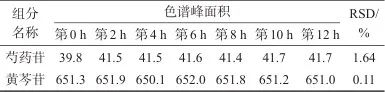
取平喘合剂(批号24022302),制备平喘合剂样品溶液,分别于第0、2、4、6、8、12、24 h进样测定,记录色谱峰峰面积并计算相对标准偏差,具体结果见表4。由表4可见,样品溶液在24 h内稳定性良好。
表4 稳定性试验结果 (n=6)
Tab. 4 Results of stability test (n=6)
2.3.5 样品加标回收试验
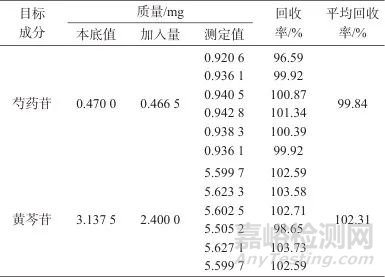
精密量取平喘合剂(批号24022302) 0.5 mL,共6份,分别置25 mL容量瓶中,各精密加入混合对照品溶液(其中芍药苷质量浓度为3.11 μg/mL,黄芩苷质量浓度为16.0 μg/mL) 15 mL,再加入70%乙醇定容至标线,摇匀,滤过,取续滤液1 mL,分别置于10 mL容量瓶中,加70%乙醇至标线,摇匀,取续滤液。依法测定并计算回收率,结果见表5。结果表明,该方法回收率良好,满足分析要求。
表5 样品加标回收试验结果
Tab. 5 Results of recovery test
3、 结语
建立了HPLC法同时测定平喘合剂中芍药苷和黄芩苷含量测定的方法,该方法具有较高的准确度和较好的精密度,简便易行,可用于平喘合剂的质量控制,为该制剂临床用药安全、有效提供了试验数据。
参考文献:
1 陈洁,薛凤池.中医药分期论治小儿病毒性肺炎的研究进展[J].中医学,2023,12(9):2 481.
CHEN Jie,XUE Fengchi. Progress of research on staged treatment of pediatric viral pneumonia in Chinese medicine[J]. Traditional Chinese Medicine,2023,12(9):2 481.
2 刘斯妤,郭凯,沈湘晴,等.中医药治疗儿童咳嗽变异性哮喘用药规律研究[J].天津中医药大学学报,2024,43(4):307.
LIU Siyu,GUO Kai,SHEN Xiangqing,et al. Study on medication rule of traditional Chinese medicine for children with cough variant asthma[J]. Journal of Tianjin University of Traditional Chinese Medicine,2024,43(4):307.
3 杜丽娜,林丽丽,韩姗姗,等.清宣止咳颗粒治疗儿童感冒、支气管炎临床应用专家共识[J].药物评价研究,2024,47(1):153.
DU Lina,LIN Lili,HAN Shanshan,et al. Expert consensus on clinical application of Qingxuan Zhike Granule in treating children's colds and bronchitis[J]. Drug Evaluation Research,2024,47(1):153.
4 齐红,于姗姗,李敏,等.高效液相色谱法同时测定白花蛇舌草中对香豆酸和芦丁[J].化学分析计量,2021,30(6):57.
QI Hong,YU Shanshan,LI Min,et al. Simultaneous determination of p-Coumaric acid and Rutin in Oldenlandia Diffusa(Willd.) Roxb. by high performance liquid chromatography [J]. Chemical Analysis and Meterage,2021,30(6):57.
5 朱冠华,顾圣莹,康雷,等. HPLC法同时测定参芍胃安颗粒中芍药苷和黄芩苷的含量[J].中国药房,2014,25(27):2 533.
ZHU Guanhua,GU Shengying,KANG Lei,et al. Simultaneous determination of peoniflorin and baicalin in Shenshao Weian Granules by HPLC[J]. China Pharmacy,2014,25(27):2 533.
6 祝磊,郑佳,黄浩洲,等. HPLC法同时测定双辛鼻窦炎颗粒中4种有效成分的含量[J].广东化工,2023,50(12):210.
ZHU Lei,ZHENG Jia,HUANG Haozhou,et al. Simultaneous determination of four active components in Shuangxin Bidouyan Granules by HPLC [J]. Guangdong Chemical Industry,2023,50(12):210.
7 崔小丽,孙宁,赵瑞,等.高效液相色谱法同时测定桂芍镇痫片中13种成分的含量[J].中南药学,2023,21(11):3 024.
CUI Xiaoli,SUN Ning,ZHAO Rui,et al. Simultaneous determination of 13 components in Guishao Zhenxian tablets by HPLC[J]. Central South Pharmacy,2023,21(11):3 024.
8 梁小敏,王乾蕾,郑文燕,等.咽炎片中5个成分的含量测定及质量分析[J].海峡药学,2024,36(2):39.
LIANG Xiaomin,WANG Qianlei,ZHENG Wenyan,et al. Content determination and quality analysis of five components in Yanyan Tablets[J]. Strait Pharmaceutical Journal,2024,36(2):39.
9 霍甜甜,李宜鲜,徐金玲,等.高效液相色谱多波长切换法同时测定更年宁中7种有效成分的含量[J].安徽医药,2023,27(6):1 116.
HUO Tiantian,LI Yixian,XU Jinling,et al. Simultaneous determination of 7 effective components in Gengnianning by HPLC-multiwavelength switching technology[J]. Anhui Medical and Pharmaceutical Journal,2023,27(6):1 116.
10 王莉. HPLC-DAD法测定参桂鹿茸丸中7个成分的含量和转移率研究[J].海峡药学,2022,34(11):68.
WANG Li. Determination of seven components in Shengui Lurong Pilule and study on transfer rate[J]. Strait Pharmaceutical Journal,2022,34 (11):68.
11 郝乘仪,于蕾,昌盛,等. HPLC-DAD法同时测定栀芩清热合剂中多指标成分含量[J].药物分析杂志,2018,38(9):1 601.
HAO Chengyi,YU Lei,CHANG sheng,et al. Simultaneous determination of index compounds in Zhiqin Qingre mixture by HPLC-DAD[J]. Chinese Journal of Pharmaceutical Analysis,2018,38(9):1 601.
12 李俊强,靳美娜,李冰洁,等. HPLC-DAD法同时测定SHF抗抑郁皂苷部位中5个指标成分含量[J].天津医科大学学报,2017,23(5):464.
LI Junqiang,JIN Meina,LI Bingjie,et al. HPLC-DAD simultaneous determination of contents of 5 constituents in SHF saponin[J]. Journal of Tianjin Medical University,2017,23(5):464.
13 国家药典委员会.中华人民共和国药典(2020年版):一部[M].北京:中国科技医药出版社,2020.
National Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China(2020 Edition):Part Ⅰ[M]. Beijing:China Medical Science and Technology Press,2020.
14 张玲艳,雷勇胜,葛强. HPLC-DAD法同时测定精制冠心片中7种指标成分[J].中草药,2015,46(14):2 092.
ZHANG Lingyan,LEI Yongsheng,GE Qiang. Simultaneous determination of seven index components in Refined Coronary Tablet by HPLC[J]. Chinese Traditional and Herbal Drugs,2015,46(14):2 092.
15 郝乘仪,于蕾,昌盛,等. HPLC-DAD法同时测定小儿退热合剂中多指标成分含量[J].药物分析杂志,2019,39(5):930.
HAO Chengyi,YU Lei,CHANG Sheng,et al. Simultaneous determination the contents of index components in Xiaoer Tuire mixture by HPLC-DAD[J]. Chinese Journal of Pharmaceutical Analysis,2019,39(5):930.
引用本文: 聂金娥,曲远均,钱芳芳,等 . 高效液相色谱法测定平喘合剂中芍药苷和黄芩苷[J]. 化学分析计量,2024,33(10):11. (NIE Jin'e, QU Yuanjun, QIAN Fangfang, et al. Determination of paeoniflorin and baicalin in Pingchuan Heji by high performance liquid chromatography[J]. Chemical Analysis and Meterage, 2024, 33(10): 11.)

来源:Internet


