您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-02-25 21:21
摘 要: 建立了高效液相色谱法同时测定除痰止嗽丸中白花前胡甲素、白花前胡乙素和橙皮苷的含量。采用Agilent ZORBAX SB-C18色谱柱(250 mm×4.6 mm,5 μm)分离,以乙腈-0.2%(体积分数)磷酸溶液作为流动相进行梯度洗脱,流量为1.0 mL/min,检测波长分别为321 nm(白花前胡甲素、白花前胡乙素)、284 nm(橙皮苷),柱温为30 ℃,进样体积为5 μL。白花前胡甲素、白花前胡乙素和橙皮苷3种成分的质量在各自范围内与色谱峰面积线性关系良好,相关系数均不小于0.999 5。样品的平均回收率为96.90%~102.98%,测定结果的相对标准偏差为0.44%~0.90%(n=6)。该方法稳定性强、准确度高,可用于除痰止嗽丸的质量控制。
关键词: 高效液相色谱法; 除痰止嗽丸; 白花前胡甲素; 白花前胡乙素; 橙皮苷
除痰止嗽丸是由前胡、陈皮、白术、法半夏、桔梗、黄芩、六神曲等18味药物组成,具有清肺降火,除痰止嗽的功效[1]。成方制剂中前胡、陈皮均为君药,前胡具有降气止咳、疏散肺热的作用,白花前胡甲素和白花前胡乙素为其香豆素类有效成分[2-5];陈皮理气化痰,橙皮苷为其黄酮类有效成分,具有抗炎、抗菌抗病毒等功效[6-9]。该药的现行标准为《中华人民共和国卫生部药品标准》中药成方制剂第2册(WS3-B-0365-90),该质量标准仅对除痰止嗽丸进行性状和显微鉴别,未对方中任何药物进行定性鉴别或者定量测定,不利于对药材及制剂质量进行监测和控制。现有文献对除痰止嗽丸质量标准提升研究甚少,只涉及了除痰止嗽丸测定一种或者两种指标性成分(桔梗、前胡)的方法[10],尚未查询到除痰止嗽丸中3种指标成分同时进行含量测定的文献。
笔者参考测定白花前胡甲素、白花前胡乙素和橙皮苷的方法[11-16],建立高效液相色谱法同时测定除痰止嗽丸中白花前胡甲素、白花前胡乙素、橙皮苷三种指标性成分的含量,为进一步提高除痰止嗽丸的质量标准提供参考。
1. 实验部分
1.1 主要仪器与试剂
高效液相色谱仪:1260 Infinity II型,二极管阵列检测器,美国安捷伦科技有限公司。
电子天平:(1)BSA224S型,感量为0.1 mg,德国赛多利斯仪器有限公司;(2)XPR105DR型,感量为0.01 mg,瑞士梅特勒-托利多仪器有限公司。
超声波清洗器:KQ-500DE型,昆山市超声仪器有限公司。
超纯水制备系统:Milli-Q IQ7000型,美国密理博仪器有限公司。
白花前胡甲素对照品:质量分数为99.4%,批号为111711-201904,中国食品药品检定研究院。
白花前胡乙素对照品:质量分数为99.7%,批号为111904-202105,中国食品药品检定研究院。
橙皮苷对照品:质量分数为97.2%,批号为110721-202220,中国食品药品检定研究院;
甲醇、乙腈:均为色谱纯,美国西格玛化学公司。
磷酸:色谱纯,天津科密欧化学试剂有限公司。
除痰止嗽丸样品:批号分别为20010706、20010566、20010110,北京同仁堂股份有限公司同仁堂制药厂。
除痰止嗽丸阴性样品:北京同仁堂股份有限公司同仁堂制药厂。
实验用水均为超纯水。
1.2 色谱条件
色谱柱:ZORBAX SB-C18柱(250 mm×4.6 mm,5 μm,美国安捷伦科技有限公司);柱温:30℃;检测波长:白花前胡甲素、白花前胡乙素为321 nm、橙皮苷为284 nm;进样体积:5 μL;流动相:A相为乙腈,B相为0.2%(体积分数)的磷酸水溶液,流量为1.0 mL/min;洗脱方式:梯度洗脱,梯度洗脱程序见表1。
表1 梯度洗脱程序
Tab. 1 Gradient elution program

1.3 溶液配制
1.3.1 混合对照品溶液
白花前胡甲素、白花前胡乙素对照品储备溶液:取白花前胡甲素、白花前胡乙素对照品适量,精密称定,分别置于10 mL容量瓶中,用甲醇稀释至标线,摇匀。
白花前胡甲素、白花前胡乙素、橙皮苷混合对照品溶液:取橙皮苷对照品适量,精密称定,置于50 mL容量瓶中,再分别取白花前胡甲素、白花前胡乙素对照品储备液1 mL加入容量瓶中,加入甲醇稀释定容至标线,制成白花前胡甲素、白花前胡乙素、橙皮苷的质量浓度分别为63.02、32.52、282.27 μg/mL的混合对照品溶液。
1.3.2 样品溶液
取除痰止嗽丸样品适量,剪成小块,精密称取3 g左右,加适量硅藻土研细,置于具塞锥形瓶中,精密加入甲醇25 mL,密塞后称定质量,超声处理(功率500 W,频率40 kHz) 20 min,放冷,再称定质量,用甲醇补足减少质量,摇匀,滤过,作为样品溶液。同法制备不含前胡和陈皮的阴性样品溶液。
1.4 实验方法
分别取混合对照品溶液、样品溶液和阴性样品溶液,在1.2仪器工作条件下进样测定,记录各溶液色谱峰面积,绘制标准工作曲线,以外标法计算样品中白花前胡甲素、白花前胡乙素、橙皮苷成分的含量。
2. 结果与讨论
2.1 色谱柱的选择
以乙腈-0.2%磷酸水溶液作为流动相,分别考察了Waters Symmentry-C18柱(250 mm×4.6 mm,5 μm)和ZORBAX SB-C18柱(250 mm×4.6 mm,5 μm)对3种指标成分的分离效果和色谱峰形。结果表明,当使用ZORBAXSB-C18柱时,基线平稳、分离度好,色谱峰形对称,保留时间合适,因此选择ZORBAXSB-C18柱(250 mm×4.6 mm,5 μm)作为分析柱。
2.2 检测波长的选择
采用二极管阵列检测器,在200~400 nm范围内扫描混合对照品溶液,结果表明,白花前胡甲素和白花前胡乙素两种成分在321 nm处吸收最大,橙皮苷在284 nm处吸收最大,结合分离度、色谱峰形、杂峰干扰等因素,将白花前胡甲素和白花前胡乙素的检测波长定为321 nm,橙皮苷的检测波长定为284 nm。
2.3 流动相的选择
考察了甲醇-水、甲醇-0.1%甲酸水溶液、乙腈-0.1%磷酸水溶液3种流动相体系,采用等度或梯度洗脱的方式,测定样品中3种指标性成分的含量。结果表明,使用上述3种流动相,色谱峰的峰形和分离度较差,保留时间较长;根据3种指标性成分的分子极性,通过梯度洗脱程序的优化,最终确定以乙腈-0.2%磷酸水溶液作为流动相进行梯度洗脱,色谱图基线平稳,3种成分分离度良好,且保留时间适中。
2.4 样品处理条件的优化
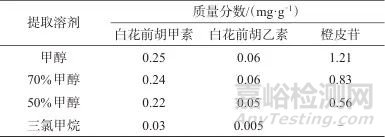
分别考察了甲醇、50%甲醇水溶液、70%甲醇水溶液、三氯甲烷作为提取溶剂,超声处理30 min对白花前胡甲素、白花前胡乙素、橙皮苷提取结果的影响,测定结果见表2。由表2可知,甲醇作为提取溶剂时提取效率最高,70%甲醇提取效率次之,而三氯甲烷不能有效提取3种成分,故选择甲醇作为提取溶剂。
表2 不同提取溶剂时3种成分的测定结果
Tab. 2 Results of determination of 3 components in different extraction solvents
以甲醇为提取溶剂,考察超声提取、加热回流两种方式对白花前胡甲素、白花前胡乙素、橙皮苷3种成分的提取效果。结果表明,2种提取方式对除痰止嗽丸中3种成分测定结果无明显影响,综合考虑操作简单,杂质峰较少等因素,选择超声提取作为样品处理的方法。
以甲醇为提取溶剂,分别考察白花前胡甲素、白花前胡乙素、橙皮苷3种成分在不同超声时间(20、30、45、60 min)的提取效果,结果见表3。由表3可知,超声20 min即可实现3种成分的有效提取,考虑到时间成本和提取效率,选择超声(500 W,40 kHz)时间为20 min。
表3 不同超声时间3种成分的测定结果
Tab. 3 Determination results of 3 components at different ultrasonic time
2.5 方法专属性
分别精密吸取5 μL对照品溶液、样品溶液、阴性样品溶液,在1.2色谱条件下进样测定。样品溶液、混合对照品溶液和阴性样品溶液色谱图如图1所示。
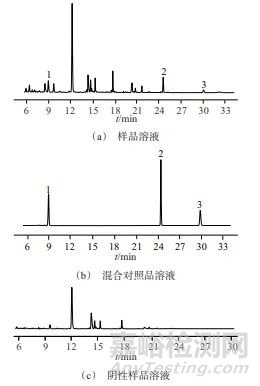
图1 样品溶液、混合对照品溶液和阴性样品溶液色谱图
Fig. 1 Chromatogram of sample solution,mixed control solution and negative sample solution
1—橙皮苷;2—白花前胡甲素;3—白花前胡乙素
从图1中可以看出,各色谱峰分离度良好,阴性样品溶液在白花前胡甲素、白花前胡乙素和橙皮苷对照品相应色谱峰位置未检出色谱峰。表明本方法系统适用性及专属性均良好。
2.6 线性关系及检出限
分别精密吸取混合对照品溶液1、2、3、5、8 μL,在1.2色谱条件下进行测定,以进样质量(x)为横坐标、色谱峰面积(y)为纵坐标,绘制标准工作曲线,得到线性方程。将混合对照品溶液进行适当稀释,以3倍信噪比对应的质量浓度作为检出限,10倍信噪比对应的质量浓度作为定量限。3种成分质量浓度的线性范围、线性方程、相关系数、检出限及定量限见表4。
表4 3种成分的线性范围、线性方程、相关系数、检出限及定量限
Tab. 4 Linear range,linear equation,correlation coefficient,detection limit and quantitation limit of the three components
由表4可知,白花前胡甲素、白花前胡乙素和橙皮苷3种成分的质量在各自范围内与色谱峰面积线性关系良好,相关系数均不小于0.999 5。
2.7 精密度试验
取同一批号除痰止嗽丸样品6份(批号为20010706),按1.3.2制备样品溶液,在1.2色谱条件下进样测定,计算6份样品中待测成分的色谱峰面积平均值和相对标准偏差(RSD),结果见表5。
表5 精密度试验结果
Tab. 5 Results of precision test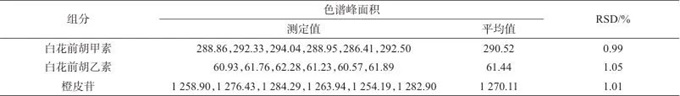
由表5可知,白花前胡甲素、白花前胡乙素、橙皮苷峰面积的RSD分别为0.99%,1.05%,1.01% (n=6),表明方法具有良好的精密度。
2.8 稳定性试验
取新制备的一批样品溶液(批号为20010706),于第0、2、4、6、8、10、12、24 h内在1.2色谱条件下进行稳定性试验,记录各组分色谱峰面积,稳定性试验结果见表6。
表6 稳定性试验结果
Tab. 6 Results of stability test

由表6可知,白花前胡甲素、白花前胡乙素和橙皮苷峰面积的RSD分别为0.33%、0.42%、0.52%,表明溶液稳定性在24 h内良好。
2.9 加标回收试验
精密称取各成分含量已知的同一批次样品(批号为20010706),加入混合对照品溶液10 mL,按1.3.2方法,平行处理6份样品溶液,在1.2色谱条件下分别进行测定,计算加标回收率,结果见表7。
表7 加标回收试验结果
Tab. 7 Results of addition recovery test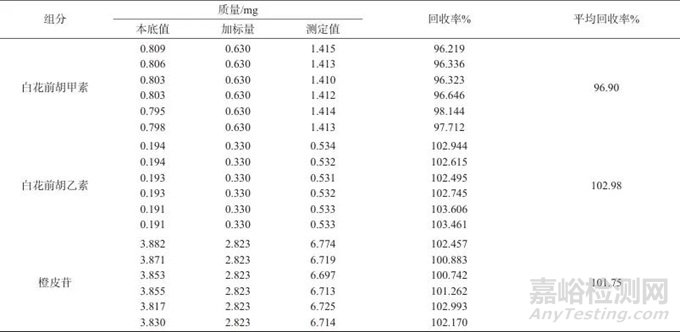
由表7可知,白花前胡甲素、白花前胡乙素、橙皮苷的平均回收率分别96.90%、102.98%、101.75%,表明该方法具有较高的准确度。
3. 结语
建立了高效液相法同时测定除痰止嗽丸中白花前胡甲素、白花前胡乙素、橙皮苷3种成分含量,对色谱条件、样品处理条件等进行了优化。该方法操作便捷,专属性良好,精密度、稳定性、准确度均较高,可适用于除痰止嗽丸中3种成分含量的同时测定,为除痰止嗽丸的质量控制提供方法学参考。
参考文献:
1 中华人民共和国卫生部药典委员会.中华人民共和国卫生部药品标准中药成方制剂:第二册[M].北京:中华人民共和国卫生部药典委员会,1990:195.
National Pharmacopoeia Commission. The drug standards of the ministry of health of the People's Republic of China for traditional Chinese medicine formulas :Volume 2[M]. Beijing:National Pharmacopoeia Commission,1990:195.
2 国家药典委员会.中华人民共和国药典2020版一部[M].北京:中国医药科技出版社,2020:277.
National Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China(2020 Edition):Part 1[M]. Beijing:China Medical Science and Technology Press,2020:277.
3 古炳明,余银冰,邬伟魁,等. HPLC法测定咳喘顺丸中迷迭香酸、白花前胡甲素、白花前胡乙素和橙皮苷的含量[J].广东化工,2021,23(48):180.
GU Bingming,YU Yinbing,WU Weikui,et al. HPLC determination of Rosmarinic Acid,Procuredin,Procuredin and Hesperidin in Kechuanshun Pills[J]. Guangdong Chemical Industry,2021,23(48):180.
4 徐锦娟,章娟娟,黄鸯鸯. HPLC法同时测定宝咳宁颗粒中8个成分的含量[J].中国药师,2021,24(7):402.
XU Jinjuan,ZHANG Juanjuan,HUANG Yangyang. Simultaneous determination of eight constituents in Baokening Granules by HPLC [J]. China Pharmacist,2021,24(7):402.
5 李运,白贺明,邱国玉,等. HPLC法同时测定杏苏止咳糖浆中5种成分[J].中成药,2021,43(8):2 002.
LI Yun,BAI Heming,QIU Guoyu,et al. Simultaneous determination of five consituents in Xingsu Zhike Syrup by HPLC [J]. Chinese Traditional Patent Medicine,2021,43(8):2 002.
6 王辉,张雁. UHPLC法同时测定苏子降气丸中10个成分含量的研究[J].药物分析杂志,2020,40(3):554.
WANG Hui,ZHANG Yan. Simultaneous determination of ten consituents in Suzi Jiangqi Pills by UHPLC [J]. Chin J Pharm Anal 2020,40(3):554.
7 徐静,任坤瑾,何胜利.一测多评法同时测定京制咳嗽痰喘丸中7种成分的含量[J].实用药物与临床,2020,23(7):622.
XU Jing,REN Kunjin,HE Shengli. Simutaneous determination of seven components in Jingzhi Kesou Tanchuan Pill by multi-components with single marker method[J]. Practical Pharmacy And Clinical Remedies,2020,23(7):622.
8 仲锡铜,耿晖,曹艳花.杏苏止咳颗粒HPLC指纹图谱及种成分含量的研究[J].中国药师,2020,23(10):1 935.
ZHONG Xitong,GENG Hui,CAO Yanhua. HPLC fingerprint and determination of 7 components in Xingsu Zhike Granules[J]. China Pharmacist,2020,23(10):1 935.
9 刘永昌,王雪梅,李喜香,等.高效液相色谱法同时测定益肺止嗽颗粒中7种成分含量[J].中国药业,2023,32(19):91.
LIU Yongchang,WANG Xuemei,LI Xixiang,et al. Simultaneous determination of seven components in Yifei Zhisou Granules by HPLC [J]. China Pharmaceuticals,2023,32(19):91.
10 李红燕,张蕊,冯晓川. HPLC测定除痰止嗽丸中的桔梗皂苷D、桔梗皂苷E、白花前胡甲素和白花前胡乙素.中国实验方剂学杂志[J]. 2014,20(2):78.
LI Hongyan,ZHANG Rui,FENG Xiaochuan. Determination of Platycodin D,Platycodin E,Praeruptorin A and Praeruptorin B in Chutan Zhisouwan by HPLC [J]. Chinese Journal of Experimental Traditional Medical Formulae,2014,20(2):78.
11 邱明鸣,朱育凤,倪昌荣.高效液相色谱法同时测定前胡药材中白花前胡甲素和白花前胡乙素含量[J]. 中国药业,2022,31(11):70.
QIU Mingming,ZHU Yufeng,NI Changrong. Simultaneous determination of praeruptorin A and praeruptorin B in Peucedani Radix by HPLC [J]. China Pharmaceuticals,2022,31(11):70.
12 高平,牛亚静.高效液相一测多评法同时测定参苏片中葛根素,迷迭香酸,白花前胡甲素,白花前胡乙素,白花前胡E素的含量[J].中国药师,2020,23(2):132.
GAO Ping,NIU Yajing. Simultaneous determination of puerarin,rosmarinic acid,praeruptorin A,praeruptorin B and praeruptorin E in Shensu Tablets by HPLC-QAMS [J]. China Pharmacist,2020,23(2):132.
13 赵万晴,戚继红.高效液相色谱法同时测定止咳片中白花前胡甲素和白花前胡乙素含量[J].中国药业,2016,25(21):60.
ZHAO Wanqing,QI Jihong. Simultaneous content determination of Praeruptorin A and Praeruptorin B in Zhike Tablets by HPLC[J]. China Pharmaceuticals,2016,25(21):60.
14 胡志军,陈建秋. HPLC测定不同基原陈皮药材中橙含量[J].中国实验方剂学杂志,2012,18(10):95.
HU Zhijun,CHEN Jianqiu. Content determination of hesperidin from different kinds of pericarpium citri reticulatae by HPLC [J]. Chinese Journal of Experimental Traditional Medical Formulae,2012,18(10):95.
15 于霞,吴娟,姜雪,等. HPLC法同时测定消乳散中甘草苷、橙皮苷和甘草酸铵的含量[J].沈阳药科大学学报,2017,34(5):369.
YU Xia,WU Juan,JIANG Xue,et al. Simultaneous determination of Liquiritin,Hesperidin and Ammonium Glycyrrhetate in Xiaorusan by HPLC [J]. Journal of Shenyang Pharmaceutical University,2017,34(5):369.
16 赵磊,孙艳涛,张晗,等.高效液相色谱法测定武力拔寒散中橙皮苷的含量[J].化学分析计量,2017,26(3):50.
ZHAO Lei,SUN Yantao,ZHANG Han,et al. Determination of Hesperidin in Wuli Bahan Powders by high performance liquid chromatography[J]. Chemical Analysis and Meterage,2017,26(3):50.
引用本文: 曹蓉蓉,张卫莲 . 高效液相色谱法同时测定除痰止嗽丸中白花前胡甲素、白花前胡乙素和橙皮苷[J]. 化学分析计量,2024,33(11):74. (CAO Rongrong, ZHANG Weilian. Simultaneous determination of Praeruptorin A, Praeruptorin B and Hesperidin in Chutan Zhisou Pills by high performance liquid chromatography[J]. Chemical Analysis and Meterage, 2024, 33(11): 74.)

来源:化学分析计量


