您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-02-13 20:19
摘 要: 建立超高效液相色谱-串联质谱法测定鹿骨胶中阿胶特征多肽含量。样品经酶解、过滤后,采用Agilent ZORBAX Eclipse Plus C18色谱柱分离,以体积分数为0.1%的甲酸溶液作为流动相A,乙腈作为流动相B进行梯度洗脱,在电喷雾离子源正离子模式及多反应监测模式下进行扫描检测,以色谱峰面积为标定量。结果表明,驴源多肽A1、驴源多肽A2的质量浓度分别在20.69~517.26、20.48~511.95 ng/mL范围内与色谱峰面积线性关系良好,相关系数均不小于0.999,样品的平均加标回收率分别为91.4%、99.3%,测定结果的相对标准偏差分别为1.7%、3.0%(n=6)。该方法准确度高、稳定性好、灵敏度高、专属性强,适用于胶类产品的质量控制。
关键词: 超高效液相色谱-串联质谱法; 鹿骨胶; 阿胶特征多肽
动物胶类药物在很多疾病的治疗和保健中具有重要作用。古籍《五十二病方》记载以胶治疗疾病的应用[1-2],《本草拾遗》[3]、《本草纲目》[4]、《本草求真》[5]等许多古籍中也均有以胶类入方治疗疾病的记载。近年来,关于胶类药物的相关研究逐渐增多,应用领域不断扩展。鹿骨胶是通过煎煮和浓缩鹿骨制成的固体胶。其制法为将鹿骨洗净,浸泡数日,除尽附着的筋肉,截断,经热碱水处理除去油脂,再洗净,加水煎煮共计3次,每次持续8 h,过滤,将滤液合并,加明矾适量,打循环搅拌,静沉,再过滤,将滤液浓缩提抹,加阿胶5%,搅匀,再浓缩成稠膏状,冷却后切块并阴干,即可得到成品。鹿骨胶的质量标准收载于《部颁标准中药成方制剂》十二册WS3-B-2424-97,检测项目包括水分、总灰分及重金属等指标。通过检验项目无法判定鹿骨胶中是否加入了5%的阿胶。由于不同物种蛋白质的氨基端序列存在差异,所以可通过鉴别胶原蛋白序列的差异来追溯物种的来源[6]。KUMAZAWA等[7]采用液相色谱-质谱联用技术,对皮革中的胶原蛋白特征多肽进行鉴别,结果显示只有羊的特征性多肽具有特异性。石峰等[8]利用胰蛋白酶对阿胶样品进行酶解后利用超高效液相色谱-三重四级杆质谱对阿胶专属性特征多肽进行检验,结果检测的10批阿胶样品均检出驴皮特征多肽,证明该方法可用于阿胶中驴皮源性成分的鉴别。《中华人民共和国药典》2020年版一部[9]中收载有阿胶,对阿胶的特征性指标-驴源性特征多肽进行鉴别。另文献有报道用超高效液相色谱-串联质谱[10-14]方法,将样品酶解处理后,检测胶类产品中的杂皮源成分及投料含量[15-19]。
笔者建立超高效液相色谱-串联质谱法测定鹿骨胶中阿胶特征多肽含量,根据测定数据计算出鹿骨胶中阿胶的添加量,适用于鹿骨胶产品及其他含有阿胶成分产品的质量控制。
1、 实验部分
1.1 主要仪器与试剂
超高效液相色谱-串联质谱仪:6460 Triple Quad型,安捷伦科技(中国)有限公司。
电子天平:Sartorius CPA225D型,感量为0.01 mg,赛多利斯科学仪器(北京)公司。
电热鼓风干燥箱:GZX-9140MBE型,上海博讯实业有限公司医疗设备厂。
超声波清洗器:KQ-500B型,昆山市超声仪器有限公司。
高速多功能粉碎机:SL-200型,浙江省永康市松青五金厂。
针式滤膜:PES型,0.22 µm,天津市津腾实验设备有限公司。
超纯水系统:SMART-N型,力康生物医疗科技控股有限公司。
驴源多肽A1对照品:质量分数为92.5%,批号为112040-202102,中国食品药品检定研究院。
驴源多肽A2对照品:质量分数为95.3%,批号为112041-202102,中国食品药品检定研究院。
胰蛋白酶:生化级,批号为SLCM5418,西格玛奥德里奇(上海)贸易有限公司。
乙腈:质谱纯,赛默飞世尔科技(中国)有限公司。
甲酸:色谱纯,国药化学试剂股份有限公司。
碳酸氢铵:优级纯,国药化学试剂股份有限公司。
鹿骨胶样品:山东宏济堂制药集团股份有限公司。
1.2 仪器工作条件
1.2.1 色谱仪
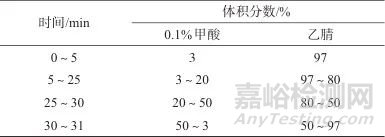
色谱柱:Agilent ZORBAX Eclipse Plus C18柱[50 mm ×2.1 mm,1.8 µm,安捷伦科技(中国)有限公司];柱温:30 ℃;进样体积:5 µL;流动相:A相为体积分数为0.1%的甲酸,B相为乙腈;洗脱方式:梯度洗脱,流量为0.3 mL/min,洗脱程序见表1。
表1 梯度洗脱程序
Tab. 1 Gradient elution program
1.2.2 质谱仪
离子源:电喷雾离子源(ESI);扫描模式:正离子模式;数据采集模式:多反应监测扫描(MRM);离子源温度:300 ℃;离子化电压:4 000 V;压力:207 kPa。目标物的选择反应监测质谱参数见表2,理论板数按驴源多肽A1计算应不小于4 000。
表2 选择反应监测质谱参数
Tab. 2 Parameters of selective reaction monitor

1.3 溶液制备
1.3.1 样品溶液的制备
将鹿骨胶样品使用高速多功能粉碎机粉碎,精密称取粉碎后的样品粉末0.1 g,置于50 mL容量瓶中,加入40 mL 1%(质量分数)的碳酸氢铵溶液,使用超声波清洗器(功率250 W,频率40 kHz)超声处理30 min,直至样品全部溶解,用1%的碳酸氢铵溶液定容,摇匀。精密量取摇匀后的溶液1 mL,置于5 mL容量瓶中,加入1 mL胰蛋白酶溶液(取生化级胰蛋白酶适量,加1%的碳酸氢铵溶液,制成浓度为1 mg/mL的溶液,临用新制),再加1%的碳酸氢铵溶液定容,摇匀。将该混合溶液置于设定温度为37 ℃的电热鼓风干燥箱中,恒温酶解12 h。酶解结束后,补加液体并摇匀,过0.22 µm聚醚砜滤膜,取续滤液,得样品溶液。同法制备空白溶液、阴性样品溶液。
1.3.2 混合对照储备液的制备
精密称取驴源多肽A1、驴源多肽A2对照品适量,加入1%的碳酸氢铵溶液,配制成质量浓度为1 µg/mL的混合对照储备液。
1.3.3 系列混合标准工作溶液的制备
用移液管精密量取混合对照储备液1、2、5、10、20、25 mL分别置于50 mL容量瓶中,加1%的碳酸氢铵溶液定容,配制成质量浓度为20、40、100、200、400、500 ng/mL的混合标准工作溶液。
1.3.4 混合对照溶液的制备
精密量取混合对照储备液10 mL置于50 mL容量瓶中,加入1%碳酸氢铵溶液定容至标线,制备得到混合对照溶液。
1.4 实验方法
分别精密吸取不同浓度的系列混合标准工作溶液与样品溶液各5 µL,在1.2仪器工作条件下,以目标物峰面积为纵坐标,目标物质量浓度为横坐标,拟合标准曲线,外标法定量。
2、 结果与讨论
2.1 色谱的优化
2.1.1 色谱柱的选择
分别考察了RSLC 120 C18 (100 mm ×2.1 mm,2.2 μm)、ZORBAX SB C18 (100 mm ×2.1 mm,1.8 μm)、ZORBAX Eclipse Plus C18 (50 mm ×2.1 mm,1.8 μm)3种不同色谱柱,并比较驴源多肽A1、驴源多肽A2在3种不同色谱柱上的色谱保留情况。结果表明,RSLC 120 C18柱色谱峰分离效果较差,ZORBAX SB C18和ZORBAX Eclipse Plus C18柱色谱峰对称性良好,色谱柱系统适用性均符合要求,但在2种色谱柱中驴源多肽A1、驴源多肽A2的色谱峰保留时间不同,最终选择保留时间较短的ZORBAX Eclipse Plus C18色谱柱。
2.1.2 流动相的选择
液相色谱-质谱联用体系中常采用甲酸溶液和乙腈作为流动相。甲酸有助于提高检测灵敏度,减少峰形变形和分裂,提高分离度;乙腈能够有效分离和洗脱各种化合物,具有优良的溶解性能和极性调节能力。选择0.1%甲酸和乙腈作为流动相,通过调整流动相比例实现流动相的优化。分别考察了两种流动相比例,分别为0.1%甲酸-乙腈(95∶5,体积比,下同)、0.1%甲酸-乙腈(97∶3),0.1%甲酸-乙腈(97∶3)理论板数和分离度明显高于甲酸-乙腈(95∶5),因此选择0.1%甲酸-乙腈(97∶3)作为流动相。
2.1.3 质谱条件的优化
驴源多肽A1、驴源多肽A2混合对照品进样检测,通过一级全扫描找到驴源多肽A1、驴源多肽A2的母离子,再分别以一级母离子通过二级全扫描找到二级碎片离子,通过不断优化碎裂电压、碰撞能量、驻留时间以及离子源参数,使碎片离子响应不断增大,最后确定最适合的质谱参数。
2.2 系统适用性
取对照品溶液,在1.2仪器工作条件下连续进样5次,计算对照品溶液连续进样5次的色谱峰面积。系统适用性试验结果见表3。由表3可知,驴源多肽A1、A2对照品峰面积的相对标准偏差(RSD)分别为0.3%、0.9%(n=5)。理论板数按驴源多肽A1计算均不小于4 000,分离度均大于1.5,信噪比大于10,表明系统适用性试验符合要求。
表3 系统适用性试验结果
Tab. 3 Results of system applicability test

2.3 专属性试验
在1.2仪器工作条件下,分别测定空白溶液、阴性样品溶液、鹿骨胶样品溶液、混合对照溶液,色谱图如图1所示。从图1中可以看出,空白溶液、阴性样品溶液无色谱峰,说明对鹿骨胶样品中驴源多肽A1、驴源多肽A2色谱峰无干扰。并且鹿骨胶样品溶液中驴源多肽A1、驴源多肽A2色谱峰及与其他杂峰之间分离度均大于1.5,表明该方法专属性强。
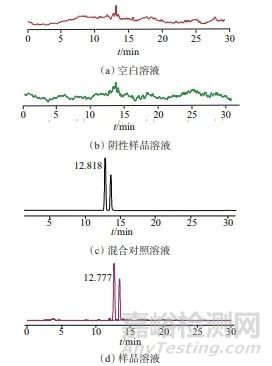
图1 空白溶液、阴性样品溶液、混合对照品溶液、样品溶液色谱图
Fig. 1 Chromatogram of blank solution,negative sample solution,mixed reference solution and sample solution
2.4 线性方程与检出限
按照1.3.3方法配制标准曲线溶液。分别精密吸取不同浓度的标准曲线溶液各5 µL,在1.2仪器工作条件下,以对照品峰面积为纵坐标,对照品浓度为横坐标制备标准曲线,从标准曲线读出样品溶液中相当于驴源多肽A1和驴源多肽A2的量。质量浓度的线性范围、线性方程、相关系数、检测限及定量限见表4。
表4 质量浓度线性范围、线性方程、相关系数、检测限及定量限
Tab. 4 Linear range of mass concentration,linear equation,correlation coefficient,detection limit and quantitation limit
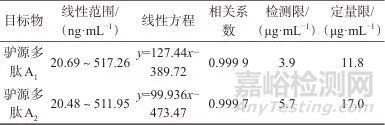
由表4可知,驴源多肽A1、驴源多肽A2的质量浓度分别在20.69~517.26、20.48~511.95 ng/mL范围内与色谱峰面积线性关系良好,相关系数均不小于0.999。
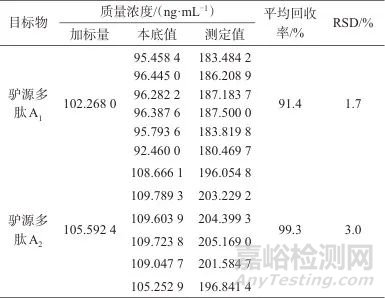
2.5 样品加标回收与精密度试验
精密称取6份同一浓度样品,分别加入25 µg/mL的驴源多肽A1、驴源多肽A2混合对照溶液1 mL,制成6份加标溶液,每份平行测定2次。分别精密吸取不同浓度的系列混合标准工作溶液与6份加标溶液各5 µL,在1.2仪器工作条件下进样测定,计算驴源多肽A1和驴源多肽A2的加标回收率及相对标准偏差,考察方法的准确度,加标回收与精密度试验结果见表5。由表5可知,驴源多肽A1、驴源多肽A2的平均回收率分别为91.4%、99.3%,测定结果的相对偏差(RSD)分别为1.7%、3.0%(n=6)。表明该方法准确度良好。
表5 加标回收与精密度试验结果
Tab. 5 Results of spiked recoveries and precision test
3、 结语
建立了超高效液相色谱-串联质谱法测定鹿骨胶中阿胶特征多肽含量。优化了色谱、质谱条件,并分别从系统适用性、专属性、精密度、准确度等方面进行方法学研究。该方法准确度高、专属性强、检测灵敏度高,对企业鹿骨胶产品生产过程的质量控制具有重要作用,同时也为含有阿胶成分产品的质量控制和质量评价提供参考。
参考文献:
1 马王堆汉墓帛书整理小组.五十二病方[M].北京:文物出版社,1979.
Mawangdui Han tomb silk book sorting group,Fifty-two prescriptions for diseases[M]. Beijing:Cultural relics publishing House,1979.
2 朱玲. 《五十二病方》剂型考释[J].中药材,2007,30(12): 1 613.
ZHU Ling.<Fifty-two prescriptions for diseases> formulation interpretation[J]. Journal of Chinese Medicinal Materials,2007,30(12): 1 613.
3 (唐)陈藏器,尚志钧辑校.本草拾遗[M].芜湖:皖南医学院科研处,1983.
Tang) CHEN Cangqi,SHANG Zhijun collate. Collect the relics of materia medica[M]. Wuhu:Department of Scientific Research,Wannan Medical College,1983.
4 (明)李时珍.本草纲目:校点本[M].北京:人民卫生出版社,1975.
Ming) LI Shizhen. Compendium of Materia Medica:School point[M]. Beijin:People's Medical Publishing House,1975.
5 (清)黄宫绣著,王淑民校注.本草求真[M].北京:中国中医药出版社,1997.
Qing) HUANG Gongxiu,WANG Shumin Collation and annotation. Herbal medicine seeks truth[M]. Beijing:China Traditional Chinese Medicine Press,1997.
6 阳洪波,王韦达,李意. 基于特征肽段的液相色谱-质谱技术鉴定胶原蛋白的物种来源[J]. 分析测试学报,2018,37(11): 1 279.
YANG Hongbao,WANG Weida,LI Yi. Identification of species origin of collagen by liquid chromatography-mass spectrometry based on characteristic peptide segments[J]. Journal of Instrumental Analysis,2018,37(11): 1 279.
7 KUMAZAWA Y, TAGA Y, IWAI K,et al. A rapid and simple LC-MS method using collagen marker peptidesfor identification of the animal source of leather[J]. Journal of Agricultural and Food Chemistry,2016(64): 6 051.
8 石峰,,杭宝建,迟连利,等. 驴皮特征肽的发现及其在阿胶鉴别中的应用[J]. 药物分析杂志,2017,37(12): 2 272.
SHI Feng,HANG Baojian,CHI Lianli,et al. Discovery of donkey skin characteristic peptide and its application in identification of hide gelatin[J]. Chinese Journal of Pharmaceutical Analysis,2017,37(12):2272.
9 国家药典委员会.中华人民共和国药典[S]. 1部.北京:中国医药科技出版社,2020: 197.
10 李明华,龙国友,程显隆,等. 超高效液相色谱-三重四极杆质谱法用于中成药中胶类成分的检测研究[J]. 中国药学杂志,2015,50(24): 2 151.
LI Minghua,LONG Guoyou,CHENG Xianlong,et al. Ultrahigh performance liquid chromatography-triple quadrupole mass spectrometry for the detection of gum components in proprietary Chinese medicine[J]. Chinese Pharmaceutical Journal,2015,50(24): 2 151.
11 程显隆,陈佳,李明华,等. 特征肽段检测技术用于胶类药材专属性鉴别方法研究[J]. 中国药学杂志,2015,50(2): 104.
CHENG Xianlong,CHEN Jia,LI Minghua,et al. The characteristic peptide detection technique was used to study the specific identification method of colloidal medicinal materials[J]. Chinese Pharmaceutical Journal,2015,50(2): 104.
12 王珊珊,胡娜.超高效液相色谱-串联质谱法快速测定复方消痔栓中大黄素[J].化学分析计量,2024,33(3): 99.
WANG Shanshan,HU Na. Rapid determination of Emodin in Compound Xiaozhi Suppository by ultra performance liquid chromatography-tandem mass spectrometry[J]. Chemical Analysis and Meterage,2024,33(3): 99.
13 陈坡,宁霄,曹进,等.直接提取-超高效液相色谱-串联质谱法测定玉米酸汤子中米酵菌酸和异米酵菌酸[J].化学分析计量,2024,33(3): 6.
CHEN Po,NING Xiao,CAO Jin,et al. Determination of bongkrekic acid and isobongkrekic acid in corn sour soup by direct extraction-ultra-high performance liquid chromatography-tandem mass spectrometry[J]. Chemical Analysis and Meterage,2024,33(3): 6.
14 龙慧端,鲁毅翔,张科明.高效液相色谱-三重四极杆串联质谱法同时测定化妆品中24 种香豆素类化合物[J].化学分析计量,2024,33(3): 37.
LONG Huiduan,LU Yixiang,ZHANG Keming. Determination of 24 coumarin compounds in cosmetics by high performance liquid chromatography-tandem mass spectrometry[J]. Chemical Analysis and Meterage,2024,33(3): 37.
15 陈佳,程显隆,魏锋,等. 超高效液相色谱-三重四极杆质谱法检测复方阿胶浆中阿胶[J]. 药物分析杂志,2015,35(2): 328.
CHEN Jia,CHENG Xianlong,WEI Feng,et al. Determination of Asini Corii Colla in compound Asini Corii Colla paste by ultra-high performance liquid chromatography-triple quadrupole mass spectrometry[J]. Chinese Journal of Pharmaceutical Analysis,2015,35(2): 328.
16 焦阳,汪冰,周倩倩,等. 超高效液相色谱-质谱联用技术检测阿胶中马皮源成分[J]. 药物分析杂志,2019,39(5): 864.
JIAO Yang,WANG Bing,ZHOU Qianqian,et al. Determination of horsehide in Asini Corii Colla by ultra-high performance liquid chromatography-mass spectrometry[J]. Chinese Journal of Pharmaceutical Analysis,2019,39(5): 864.
17 王倩,刘宇文,张杭倩. UHPLC-MS/MS同时测定鳖甲煎丸中鳖甲胶和阿胶的特征肽含量[J].中国现代应用药学,2022,39(16): 2 120.
WANG Qian,LIU Yuwen,ZHANG Hangqian,Simultaneous determination of characteristic peptide contents of Biejia Jiao and Asini Corii Colla in Biejia decoction pills by UHPLC-MS/MS[J]. Chinese Journal of Modern Applied Pharmacy,2022,39(16): 2 120.
18 杜晓娟,王冰,谢耀轩,等. 超高效液相色谱-质谱联用技术评价当归养血丸中阿胶投料情况[J]. 中国药学杂志,2022,57(6): 413.
DU Xiaojuan,WANG Bing,XIE Yaoxuan,et al. Evaluation of donkey-hide jiao in Angelica Yangxue pills by ultra-high performance liquid chromatography-mass spectrometry[J]. Chinese Pharmaceutical Journal,2022,57(6): 413.
19 黎嘉茗,张万青,刘潇潇. UPLC-QQQ-MS法检测孕康口服液中驴皮源和牛皮源成分[J].中国民族民间医药,2024,33(6): 43.
LI Jiaming,ZHANG Wangqing,LIU Xiaoxiao,et al. UPLC-QQQ-MS method was used to determine the components of donkey skin and cow skin in Yunkang oral liquid[J]. Chinese Journal of Ethnomedicine and Ethnopharmacy,2024,33(6): 43.
引用本文: 余彩娟,刘册家,杨光霞,等 . 超高效液相色谱-串联质谱法测定鹿骨胶中阿胶特征多肽[J]. 化学分析计量,2024,33(11): 97. (Yu Caijuan, Liu Cejia, Yang Guangxia, et al. Determination of Asini Corii Colla characteristic polypeptides in Deer Bone Gelatin by ultra high performance liquid chromatography-tandem mass spectrometry[J]. Chemical Analysis and Meterage, 2024, 33(11): 97.)

来源:化学分析计量


