启明医疗宣布其自主研发的经导管人工肺动脉瓣膜置换(TPVR)系统VenusP-Valve获得FDA批准进行研究性器械豁免(Investigational Device Exemption,IDE)申请,此次批准为不带附加条件的完全批准(Full Approval)。VenusP-Valve成为首个获得美国FDA批准进行临床研究的中国产人工心脏瓣膜,创出中国瓣膜出海的新纪录。
本次临床研究将在美国的10个医疗中心与日本的5个医疗中心同步开展,预计共入组60例患者。根据计划,VenusP-Valve将于今年下半年在美国入组患者,2024年初开始在日本入组患者,预计可于2026年左右在美国及日本同步获批上市。
如果按照计划正常上市,也创造国产心血管介入产品新历史。在高风险的心血管介入产品,一般都认为外国月亮比较圆。在现实中我们可以在国内看到美敦力、强生、波科、雅培等公司先进且高风险产品横行无阻。但是很少有同类国产产品能够出现在美国市场上,对国产产品一句话概况“内战内行、外战外行”。国内市场极度内卷,却无法将内卷带到美利坚。这说明国产产品没有底气(没有知识产权和无法面对最严格监管),只能在国内横。
当然随着国内工业水平不断进步,医疗器械也将像其它工业产品领域一样,最终将国内内卷模式漂洋过海带到美利坚。但是这需要更多能够吃螃蟹的企业,在全球对知识产权、医疗法规监管最严地方立足,直面美敦力、爱德华等公司竞争。从而才能促使国内医疗企业成长并诞生像华为一样牛逼企业。除了美国政府,没有其它因素能够干扰国内高端医疗器械产品在美国横行无阻,赢得同行重遵。
VenusP-Valve
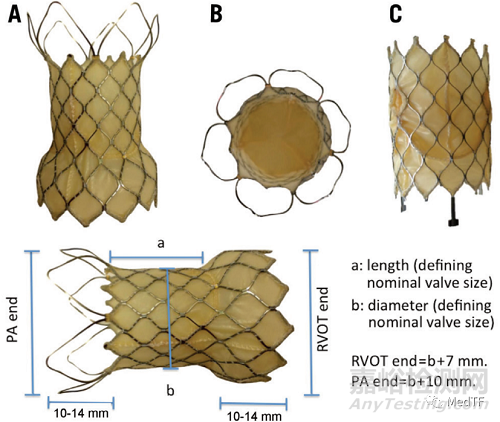
VenusP-Valve是由猪心包和镍钛合金支架资本的自膨胀式TPVR产品,其独特的双喇叭口设计,锚定稳定,释放简便,植入前无需预先放置固定支架。
VenusP-Valve支架具有近端和远端喇叭口,以将瓣膜锚定在 RVOT 和肺动脉分叉处。近端耀斑被心包组织覆盖,而远端耀斑是开放式细胞线框架,以避免阻塞肺动脉分支。中间部分也被心包和瓣膜完全覆盖。在近端耀斑处有三个不透射线的铂标记,用于识别瓣膜位置。中间部分的直径范围为 18 至 34 mm,增量为 2 mm,长度范围为 20 至 35 mm,增量为 5 mm。近端和远端扩口直径比中间段大 10 毫米。瓣膜近端有两个小钩子,用于连接输送系统,输送系统由一个 16 Fr、100 厘米长的轴导管、一个 20-22 Fr 的胶囊和一个用于控制瓣膜展开的手柄旋转机构组成,输送系统由一个 16 Fr、100 厘米长的轴导管、一个 20-22 Fr 的胶囊和一个用于控制瓣膜展开的手柄旋转机构组成。
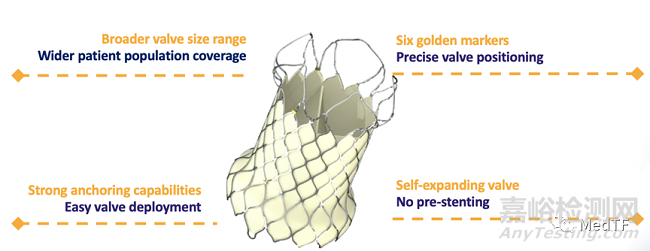
VenusP-Valve瓣膜尺寸规格多,适用范围广
6个黄金显影点,确保瓣膜精准释放
多位锚定设计,锚定稳固
自膨式瓣膜,无需预先放置固定支架
VenusP-Valve已经获得NMPA和CE批准上市,在国内和欧洲已经验证其安全性和有效性。根据启明医疗公布在欧洲三年期随访数据显示,64名接受TPVR手术的患者(尚有部分患者由于新冠疫情未能计入)手术成功率为100%,全因死亡率及手术再干预率均为0,所有患者均未出现中度或重度肺动脉瓣反流;96.87%受试者的瓣周漏及三尖瓣反流在轻度以内。
启明医疗
启明医疗是中国最领先的经导管心脏瓣膜治疗领域龙头企业,自2009年在杭州落户以来,公司在创新产品开发方面的亮眼记录为公司带来显著的先发优势,重点产品VenusA-Valve和VenusA-Plus为全球第一个获得NMPA批准并在中国上市的第一、第二代TAVR产品。目前,启明医疗已建立了一个全面的结构性心脏病整体解决方案,覆盖主动脉瓣、肺动脉瓣、二尖瓣、三尖瓣等心脏瓣膜疾病,肥厚性心肌病,高血压肾动脉去交感神经消融术以及手术配套产品等完整管线。