一、背景
2015年10月16日,LEO Pharma研发的卡泊三醇-丙酸倍他米松泡沫气雾剂(规格:0.05% / 0.064%,商品名:Enstilar®)经美国FDA批准上市,用于18岁及以上患者的斑块型银屑病局部治疗。在此之前,FDA曾于2006年01月09日批准了LEO Pharma研发的卡泊三醇-丙酸倍他米松软膏(规格:0.05% / 0.064%,商品名:Taclonex®)上市,用于12岁及以上患者的斑块型银屑病局部治疗。
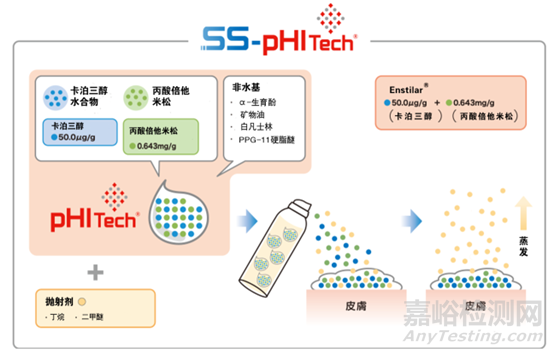
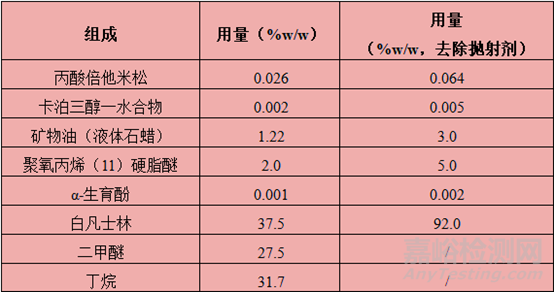
Enstilar®泡沫气雾剂的内容物一种白色或类白色的乳状液体,灌装于铝制加压气雾罐中,罐体带有阀门和促动器,抛射剂为二甲醚和丁烷。在给药时,抛射剂迅速汽化,内容物以泡沫状喷出。每克Enstilar®泡沫含有52.2微克卡泊三醇一水合物(相当于50微克卡泊三醇)和0.643毫克丙酸倍他米松(相当于0.5毫克倍他米松)。除抛射剂外,处方中其它辅料还包括白凡士林、聚氧丙烯(11)硬脂醚(PPG-11硬脂醚)、矿物油、α-生育酚、二丁基羟基甲苯(BHT)。
值得注意的是,Taclonex®软膏与Enstilar®泡沫气雾剂的活性成分及规格完全一致,处方成分的区别仅在于Enstilar®增加了抛射剂(二甲醚和丁烷),除此之外两者处方所用的辅料均相同。Taclonex®是基于LEO Pharma的pHITech®技术,所谓的pHITech®技术是英文“pH independent technology”的简称,即“非pH依赖技术”。Enstilar®泡沫气雾剂的成功上市则是基于LEO Pharma的SS-pHITech®技术,即“Supersaturation-pH independent technology”的简称,字面意思是“过饱和-非pH依赖技术”。
但就临床疗效而言,卡泊三醇-丙酸倍他米松泡沫气雾剂显著优于其软膏剂型,且同样安全性良好。一项双盲、多中心II期临床试验比较了这两种剂型的有效性和安全性。该项研究共纳入了376名患者,使用卡泊三醇-丙酸倍他米松泡沫气雾剂达到主要临床治疗终点的人数显著高于软膏组(54.6% vs 43.0%, p=0.025)。人体血管收缩试验表明,泡沫气雾剂组与软膏组的血管收缩程度分别为2.00和1.75,无统计学差异(p=0.30)。此外,一项针对卡泊三醇-丙酸倍他米松泡沫气雾和其软膏的成本效益分析结果显示,使用泡沫气雾剂可降低病人的门诊次数以及未来需要全身系统性治疗的概率。
二、处方开发难点
卡泊三醇是维生素D3的类似物,丙酸倍他米松是一种超强效糖皮质激素,两者具有不同的作用机制,合用时对银屑病的治疗效果比单药更好。然而,卡泊三醇与糖皮质激素存在不相容性,混合使用时药物易发生降解,因而患者需将卡泊三醇与糖皮质激素早晚分开使用。如果能将这两种药物开发为一种复方外用制剂,将有利于提高患者的用药依从性。
卡泊三醇易氧化,在酸性条件下不稳定,可以和醇发生反应,易发生差向异构化反应。丙酸倍他米松也易氧化,但是在酸性条件下稳定,而对碱不稳定。在水性环境中,卡泊三醇在pH>8时稳定性最好,而丙酸倍他米松则需要pH在4-6范围时最稳定。卡泊三醇和丙酸倍他米松的物理化学性质如下表所示。
三、处方开发过程
3.1 卡泊三醇-丙酸倍他米松软膏
根据相关制剂专利(US6753013B1),1 g的卡泊三醇-丙酸倍他米松软膏的处方组成及用量如下表所示。需要注意的是,该表未列出辅料BHT,与Taclonex®软膏的处方组成存在冲突,但笔者在查阅资料过程中注意到LEO Pharma在欧盟和上市的Daivobet®和日本上市ドボベット®软膏(Dovobet®Ointment)均不含BHT,其余成分与Taclonex®软膏完全相同。
软膏制备过程为:①将白凡士林于80℃加热融化,然后冷却至70℃并保持该温度;
②将卡泊三醇一水合物溶解于聚氧丙烯(11)硬脂醚中,形成溶液,搅拌加入至①中;
③将微粉化的丙酸倍他米松(粒径99%<15μm)分散于矿物油中;
④于搅拌状态下将α-生育酚和③加入到上述含卡泊三醇的白凡士林混合物中;
⑤将体系温度降至30℃以下,即得。
基于药物的理化性质,研发人员最终设计了非水基的卡泊三醇-丙酸倍他米松非水基软膏,避免了药物产生pH依赖的降解,同时处方避免使用了含醇、含酸碱残基(residues)以及具有氧化性质的辅料。
在产品开发过程中,研发人员利用体外透皮试验(IVPT)考察了以肉豆蔻酸异丙酯(IPM)、丙二醇(PG)、聚氧丙烯(11)硬脂醚为溶剂的软膏对药物透皮的影响(以卡泊三醇和丙酸倍他米松单药软膏市售产品作为参比制剂)。结果表明单用IPM时,药物的经皮渗透远低于参比制剂,只有IPM和PG合用时方可促进药物的经皮渗透,但PG的引入不利于卡泊三醇的稳定;卡泊三醇和丙酸倍他米松在聚氧丙烯(11)硬脂醚中均稳定,药物的经皮渗透与该溶剂用量呈负相关,当用量为5%时IVPT结果与参比制剂相当。
研发人员还尝试在处方中加入羊毛脂(lanolin)以提高处方润肤性(emollient),但是结果令人失望,可能是由于羊毛脂中存在羊毛甾醇,而该成分与丙酸倍他米松相似,故丙酸倍他米松对羊毛脂存在亲和性,导致其经皮渗透降低,故研发人员最终放弃了这一尝试。
3.2 卡泊三醇-丙酸倍他米松泡沫气雾剂
卡泊三醇-丙酸倍他米松泡沫气雾剂是在其软膏剂的基础上增加抛射剂改良而得。根据相关制剂专利(US9119781B2),其处方组成及用量如下表所示。同样需要注意的是,该表未列出辅料BHT,与Enstilar®泡沫气雾剂的处方组成存在冲突,LEO Pharma在日本上市的同类产品ドボベット®泡沫气雾剂(Dovobet®Foam)中不含BHT,其余成分与Enstilar®泡沫气雾剂完全相同。
该泡沫气雾剂的制备过程为:①将白凡士林于80℃加热融化,然后冷却至70℃并保持该温度;
②将卡泊三醇一水合物溶解于聚氧丙烯(11)硬脂醚中,形成溶液,搅拌加入至①中;
③将丙酸倍他米松分散于矿物油中;
④于搅拌状态下将③加入到上述含卡泊三醇的白凡士林混合物中;
⑤将体系温度降至30℃以下;
⑥将得到的混合物与抛射剂共同封装于特制阀门系统的铝制喷雾罐(内壁涂层HOBA8460)中,摇晃5分钟使药物完全溶解,即得。
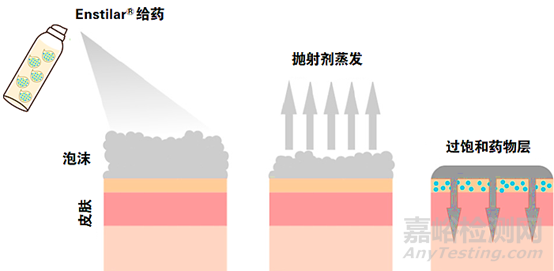
在耐压罐体中抛射剂呈液体状态,溶解度实验表明完全溶解处方量的卡泊三醇和丙酸倍他米松分别需要至少6%和11%的二甲醚,而最终泡沫气雾剂处方中的二甲醚用量为27%, 因此药物在处方中处于完全溶解状态。研发人员还考察了给药后泡沫中抛射剂含量随时间的变化关系,结果表明抛射剂蒸发迅速,2分钟内泡沫中的二甲醚和丁烷的含量仅为0.5%和4%。
为进一步探究抛射剂蒸发后药物的存在状态,研发人员采用了显微镜观察给药后药物的结晶情况,其结果令人惊叹,卡泊三醇-丙酸倍他米松泡沫气雾剂给药18小时后未观察到药物晶体,15天后才观察到药物结晶析出。拉曼成像和X射线粉末衍射结果进一步佐证了该处方能够在给药后的相当长时间内维持药物处于过饱和状态。体外透皮试验(IVPT)表明与卡泊三醇-丙酸倍他米松泡沫气雾剂的药物经皮渗透显著优于软膏剂。