您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-12-04 08:26
摘 要: 建立扩散-吸收提取/离子色谱法检验血中氰化物。取1.0 mL血样置于10 mL顶空瓶中,加入1.0 mL超纯水混匀,再加入0.5 mL浓磷酸,放入装有0.5 mL 0.25% NaOH溶液的2.0 mL进样瓶中,密封后于60 ℃加热40 min,放冷30 min,扩散-吸收完毕后抽取进样瓶内溶液进行分析,安培检测器进行检测,以CN-保留时间定性,以外标标准曲线法定量。氰化物(以CN-计)检出限为0.5 ng/mL,且质量浓度在1~500 ng/mL范围内与色谱峰面积线性关系良好,相关系数大于0.99,加标回收率为71.3%~84.8%,测定结果的相对标准偏差均小于5%(n=6)。该方法简便、准确、灵敏度高,可用于血中氰化物的定性定量检验。
关键词: 法医毒物学; 氰化物; 离子色谱; 安培检测器; 扩散-吸收
氰化物是广泛应用于工矿业的有毒化学物质,属于剧毒物,是危险化学品之一,包括氰化钾、氰化钠、氢氰酸等无机氰化物和双异氰酸盐、丙烯腈等有机氰化物,此外,桃、杏、枇杷、杨梅、樱桃等核仁及木薯等都含有氰苷,在体内分解也可产生氢氰酸,因此过量食用含氰苷的果仁可引起中毒,与氰化物相关的投毒、中毒案件也偶有发生。氰化物进入人体后,可与线粒体中细胞色素C氧化酶里的Fe3+形成配位键,阻止其还原为Fe2+,使其失去传递电子的能力,细胞无法吸收氧气而导致人体窒息死亡[1]。氰化物中毒血质量浓度约为0.5 μg/mL,致死血质量浓度约为1.0 μg/mL[2],在体内一般以氰根离子和硫氰酸盐的形式存在。
目前对于氰化物的检测主要有分光光度法[3‒5]、化学法[6‒7]、柱前衍生-气相色谱法/质谱法[8‒10]等检测方法,也有相应的GA/T 930—2011《生物样品中氰离子的气相色谱法和化学检验方法》行业标准,但都存在易被干扰或灵敏度低或操作繁琐等缺点,离子色谱法具有抗干扰力强、高灵敏等优点从而被广泛应用,但研究基质多为水[11‒13],杂质较少,而且即便有对血液开展的研究,所采用的样品处理方式也要么为乙醇沉淀蛋白[14],沉淀不完全导致基线不平整,要么采用类似的扩散法[16],但扩散装置设计复杂、采用导管导入的方式,并且处理过程中要求禁止摇匀,导致回收率不高,为此,笔者研究设计了结构简单、反应空间狭小的扩散-吸收装置,通过加酸后密封加热,使氰化物转化为氢氰酸(HCN)并逸出,再被NaOH溶液吸收,采用高灵敏度ED检测器检测吸收液中NaCN的处理过程,建立了对血液样本中氰化物高选择性、高抗干扰能力、高灵敏度的检验方法,为该类案件的侦破和诉讼提供技术导侦和理论支持。
1、实验部分
1.1 主要仪器与试剂
离子色谱仪:ICS5000型,配AS-AP自动进样器,美国赛默飞世尔科技公司。
恒温水浴锅:HH-S4型,常州市金坛国胜实验仪器制造有限公司。
涡旋震荡仪:MS3基本型,广州仪科科技有限公司。
超纯水机:Milli-QR型,美国密理博公司。
玻璃顶空瓶:20 mL,带聚四氟乙烯密封盖和铝帽,浙江赛恩斯科学仪器有限公司。
玻璃进样小瓶:2 mL,美国安捷伦科技有限公司。
CN-标准溶液:CN-质量浓度为100 μg/mL,溶剂为0.1 mol/L NaOH水溶液,美国CATO公司。
浓磷酸:质量分数为85%,色谱纯,天津大茂化学试剂公司。
NaOH溶液:质量分数为50%,美国赛默飞世尔科技公司。
乙酸钠:色谱纯,质量分数为99%,美国西格玛公司。
无水乙二胺:分析纯,国药化学试剂股份有限公司。
空白全血:青岛市中心血站。
1.2 标准储备液的配制
将100 μg/mLCN-标准溶液逐步稀释为1.0、0.1 μg/mL的标准工作液,于3 ℃保存,实验中根据需要添加以上两种溶液至测定所需的浓度;将质量分数为50%的NaOH溶液稀释为质量分数为0.25%的NaOH溶液,作为吸收液使用。
1.3 色谱条件
色谱柱:AS7阴离子分析柱(250 mm×4 mm,10 μm,美国赛默飞世尔科技公司),带AS7阴离子保护柱(50 mm×4 mm,10 μm,美国赛默飞世尔科技公司)、安培检测器;参比电极:Ag/AgCl;工作电极:Ag;柱温:30 ℃;流动相:0.5 mol/L乙酸钠-0.1 mol/L NaOH-0.5%(体积分数)乙二胺,流量为1 mL/min;进样体积:25 μL。
1.4 实验步骤
取0.5 mL吸收液于2 mL进样小瓶中,备用;取1.0 mL血液样品于10 mL顶空瓶中,加入1.0 mL水,再加入0.5 mL浓磷酸,以300 r/min涡旋震荡5 s;再用镊子将进样小瓶快速放入顶空瓶,紧接着用聚四氟乙烯密封盖和铝帽密封顶空瓶;顶空瓶于60 ℃水浴中加热40 min,取出室温放冷30 min;开盖后用针管吸取进样小瓶内液体进行离子色谱分析。注意操作过程中顶空瓶内液体与进样小瓶内液体不要混合。装置示意图见图1。
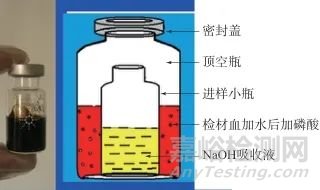
图1 样品处理装置示意图
Fig. 1 Sample processing device schematic diagram
2、 结果与讨论
2.1 样品处理条件的优化
采用扩散-吸收法进行提取,将血液样品置于实验室常用的10 mL顶空瓶(外瓶)中,加水进行稀释,便于HCN的逸出,同时使血液内氰化物与浓磷酸的反应更完全,加热时HCN扩散至外瓶上部空间,然后被装有吸收液的2 mL进样瓶(内瓶)吸收,变为不挥发的氰化钠,吸取内瓶氰化钠溶液进行离子色谱分析。这与传统的乙醇沉淀蛋白的方法[14]相比,无干扰杂峰、基线平滑、操作简单。方法使用的吸收液为0.25%(质量分数)的NaOH溶液,换算成物质的量浓度为0.1 mol/L,这与流动相中NaOH的浓度基本一致,可确保出峰更加稳定,且0.5 mL吸收液可完全吸收血液中含量为μg/mL级的氰化物。
试验优化了水浴加热温度、加热时间和放冷时间。取空白血分别加入CN-标准物质工作液适量,配制成10、50、200 ng/mL的添加样本,按1.4方法处理,考察加热时间分别为10、20、30、40、50 min,加热温度分别为40、50、60、70 ℃和冷却时间分别为10、20、30、40 min时的CN-色谱峰面积,以各优化参数下CN-的最大峰面积为100%基准计算其他条件的回收率,以回收率作为评价指标,结果见图2。
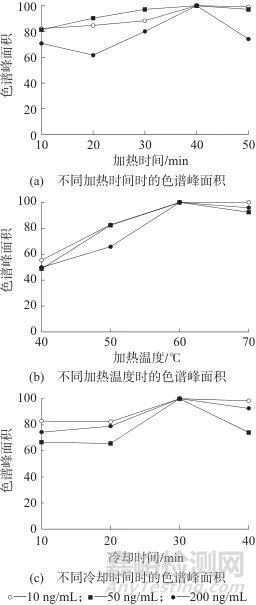
图2 不同加热时间、加热温度及冷却时间时的色谱峰面积
Fig. 2 The chromatographic peak area at different heating time, heating temperature and cooling time
由图2可见,(1) HCN沸点较低(只有25.7 ℃),析出量随着加热温度的升高而增加,60 ℃时析出量达到顶点,之后随着温度的进一步升高,由于部分发生聚合反应呈减小趋势[15],温度大于80 ℃时血液蛋白会变性凝固,因此未考察80 ℃以上的情况,最终将加热温度设置在60 ℃。(2) HCN析出量随着加热时间的延长而增加,40 min时析出量达到顶点,之后随着时间的延长,由于气密性等问题逐渐降低,综合考虑,将加热时间设为40 min。(3)理论上放冷时间越久,HCN与NaOH吸收液反应越彻底,通过试验发现,30 min时吸收已达饱和,之后基本无变化,故静置放冷时间以30 min为宜。
2.2 血液粘稠度的影响
在极浓、较浓、正常三种不同粘稠程度的血液中分别添加CN-标准工作液,配制成10、80 ng/mL的加标样品溶液,按1.4方法处理,考察了血液粘稠度对HCN逸出效率的影响,不同血液粘稠度是的色谱法面积如图3所示。由图3可见,较浓和正常粘稠度血液的逸出率相差不大,但极浓血液样品的逸出效率比较低,这是因为粘稠度越高,血中的脂肪、磷脂等含量越多,可使红细胞凝聚性增加,会阻碍HCN逸出,因此尽管方法中对血液样品进行了1倍的稀释,但对于极其粘稠的血液来说稀释倍数仍然不够。考虑极其粘稠的血液较为罕见,在满足方法要求的基础上,最终采取1倍稀释的方式。
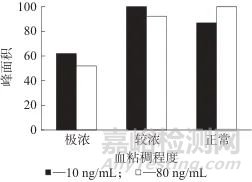
图3 不同血液粘稠度时的色谱峰面积
Fig. 3 Chromatographic peak area at different blood viscosity
2.3 顶空瓶体积的考察
配10、50、200 ng/mL的加标血液样品各两份,分别置于10、20 mL的顶空瓶中,按1.4方法操作,以最大色谱峰面积为100%基准计算回收率,不同顶空瓶体积时的色谱峰面积见图4。由图4可以看出,顶空瓶体积越大,瓶内HCN分散体积越大,相同的进样体积内HCN的含量越低,从而导致回收率降低。由于这两种规格的顶空瓶均为实验室常用,小于10 mL的顶空瓶比较少见,因此在满足实验要求的基础上未考察容量更小的顶空瓶,最终采用10 mL的顶空瓶。
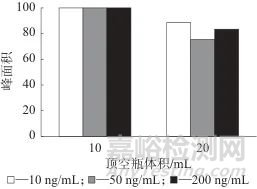
图4 不同顶空瓶体积时的色谱峰面积
Fig. 4 Chromatographic peak areas at different headspace bottle volumes
2.4 内源性氰化物的影响
将10份不同人的空白血、取其中1份正常粘稠度的空白血加CN-标准工作液适量,按1.4方法处理,和空白水、CN-标准工作液一起进样分析,考察色谱峰形、空白血中杂质和内源性氰化物对目标物的影响。图5为CN-的色谱图。
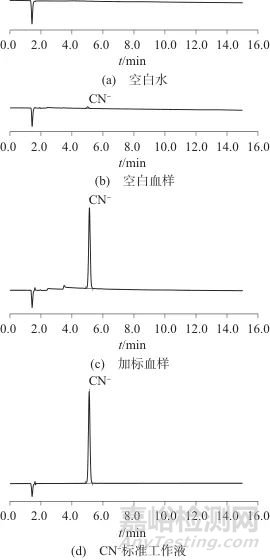
图5 CN-的色谱图
Fig. 5 Chromatograms of CN-
受饮食影响,氰化物作为人体中的内源性物质而普遍存在,据文献报道[16],203份普通人血中氰化物质量浓度最高值为42 ng/mL,平均值11 ng/mL,白酒中尽管含有微量氰化物(国家规定不大于8 ng/mL),但有研究发现,196份饮酒血液样本中平均质量浓度为10.2 ng/mL,68份不饮酒血液样本平均质量浓度为13.0 ng/mL,因此饮酒对人体血液中氰化物含量无影响;另外人体血液中氰化物质量浓度吸烟者约为41 ng/mL,不吸烟者约为16 ng/mL[17],且血液腐败也可产生氰化物[18]。通过图5可以看出,CN-峰形良好(Rt=5.117 min),不受血液杂质的干扰;空白水中未检出CN-,但空白血中检出了内源性的微量CN-,质量浓度最低约为0.5 ng/mL,最高达58.4 ng/mL,平均为15.9 ng/mL,与报道基本相符,因此在确定最终定量结果尤其是遇到较低质量浓度的样品时,要考虑内源性氰化物对数值的影响。
2.5 标准曲线、线性范围及检出限
取空白血,依次加入CN-标准工作液适量,配制成质量浓度分别为0.5、1.0、2.0、5.0、10、20、50、100、200、500 ng/mL的系列标准溶液,按1.4方法处理后进样。
分析系列标准溶液,以信噪比(S/N)为3的质量浓度作为检出限(LOD),信噪比(S/N)为10的质量浓度作为定量限(LOQ),测得CN-的检出限和定量限;以CN-色谱峰面积作为纵坐标,CN-质量浓度为横坐标绘图,绘制标准工作曲线,得到的回归方程为y=0.109 2x+0.239 8,r=0.995 75,LOD、LOQ分别为0.5、1.0 ng/mL。
2.6 加标回收与精密度试验
取空白血按1.4方法进行处理分析,记录空白血的色谱峰面积本底值(R0);配制质量浓度分别为10、50、200 μg/mL的加标血液样品,每种浓度配制6份,按1.4方法处理,分析CN-色谱峰面积(R1);直接稀释CN-标准工作液至以上浓度,按1.4方法同步操作,记录CN-色谱峰面积(R2),计算回收率,试验结果见表1。
表1 加标回收与精密度试验结果
Tab. 1 Results of the recovery and the precision test
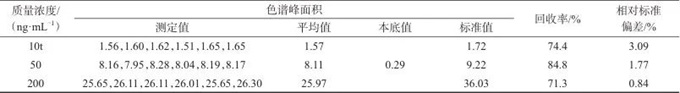
由表1可以看出,方法回收率为71.3%~84.8%,准确度较好;测试结果的相对标准偏差为0.84%~3.09%,精密度较好,符合法庭科学中毒物检测的要求。
3、 结语
建立了血液中氰化物的离子色谱检测方法,通过扩散-提取的样品处理方式,可准确定性定量,方法操作简便、抗干扰能力强、灵敏度高。经验证该方法的特异性、准确度、精密度、灵敏度、线性和回收率均满足法庭科学中毒物检验的要求,但未考察加大血液稀释倍数对极其粘稠血液回收率的改善,有待继续研究。尽管国家已加大对氰化物的管控力度,但与此相关的中毒也偶有发生,该方法的灵敏度优于行业标准,不仅可用于生物样品中氰化物的检验,在疾控、环境、化工等其他领域也有广泛的应用前景。
参考文献:
1 孙欣.氰化物中毒患者急诊急救护理中风险护理对患者预后的影响[J].首都食品与医药,2022(19):125.
SUN Xin. The impact of risk nursing on the prognosis of emergency care for patients with cyanide poisoning[J]. Capital Food and Medicine,2022(19):125.
2 贾娟,王超忍,尉志文,等.氰化物急性中毒大鼠的血浆代谢组学研究[J].中国法医学杂志,2023(5):525.
JIA Juan,WANG Chaoren,WEI Zhiwen,et al. A study on plasma metabolomics in rats with acute cyanide poisoning[J]. Journal of Forensic Medicine,2023(5):525.
3 何成媛.流动注射分光光度法测定水中总氰化物的实验研究[J].绿色科技,2023(14):141.
HE Chengyuan. Experimental study on the determination of total cyanide in water by flow injection spectrophotometry[J]. Green technology,2023(14):141.
4 马丹青.地表水中氰化物测定方法的比对研究[J].中国资源综合利用,2023(6):43.
MA Danqing. Comparative study on cyanide determination methods in surface water[J]. China Resources Comprehensive Utilization,2023(6):43.
5 代春玲,李楠,韩冬梨,等.氰根离子识别的研究[J].化学世界,2022(6):328.
DAI Chunling,LI Nan,HAN Dongli,et al. Research on cyanide ion recognition[J]. Chemical World,2022(6):328.
6 李腾,黄桂兰,袁铃,等.氰化物分析研究进展[J].化学分析计量,2017,26(2):115.
LI Teng,HUANG Guilan,YUAN Ling,et al. Research progress in cyanide analysis[J]. Chemical Analysis and Meterage,2017,26(2):115.
7 陈闯,肖宇.水中氰化物分析技术的研究进展[J].国际检验医学杂志,2022,43(S2):133.
CHEN Chuang,XIAO Yu. Research progress for cyanide analysis technology in water[J]. International Journal of Laboratory Medicine,2022,43(S2):133.
8 何海茵,李南,熊含鸿,等.顶空气相色谱-质谱法测定白酒中氰化物含量[J].食品安全质量检测学报,2019,(13):4 068.
HE Haiyin,LI Nan,XIONG Hanhong,et al. Determination of cyanide in Baijiu by HS-GC/MS[J]. Journal of Food Safety & Quality,2019,(13):4 068.
9 左家信,范翔,李欣,等.顶空-气相色谱法测定饮用水中的氰化物和氯化氰[J].分析仪器,2023(5):36.
ZUO Jiaxin,FAN Xiang,LI Xin,et al. Determination of cyanides and cyanide chloride in drinking water by HS-GC[J]. Analytical instruments,2023(5):36.
10 王潇,陈小丽,王辉,等.柱前衍生化顶空-气相色谱-质谱法测定坚果和梅类食品中氰化物的含量[J].理化检验(化学分册),2023(6):656.
WANG Xiao,CHEN Xiaoli,WANG Hui,et al. Determination of cyanide content in nuts and plum food by pre column derivatization headspace gas chromatography mass spectrometry[J]. Physical Testing and Chemical Analysis(Part B:Chemical Analysis),2023(6):656.
11 杨海毅,肖凯青,陈洁,等.高效离子色谱脉冲安培法同时测定饮用水中痕量硫化物及氰化物[J].环境化学,2023(8):2 856.
YANG Haiyi,XIAO Kaiqing,CHEN Jie,et al. Simultaneous determination of trace sulfides and cyanides in drinking water by high performance ion chromatography pulse amperometric method[J]. Environmental Chemistry,2023(8):2 856.
12 温维丽,张红,郭晶晶,等.离子色谱法测定水样中的氰化物[J].化学分析计量,2018(Z1):54.
WEN Weili,ZHANG Hong,GUO Jingjing,et al. Determination of cyanides in water samples by ion chromatography[J]. Chemical Analysis and Meterage,2018(Z1):54.
13 刘冰,刘金蓉,王莹,等.双系统离子色谱法同时检测水中硫化物、氰化物、总磷和总氮[J].中国无机分析化学,2023(4):349.
LIU Bing,LIU Jinrong,WANG Ying,et al. Simultaneous detection of sulfides,cyanide,total phosphorus,and total nitrogen in water using dual system ion chromatography[J]. Chinese Journal of Inorganic Analytical Chemistry,2023(4):349.
14 王勇,左跃先.离子色谱法检验血液中氰化物[J].现代科学仪器,2011(4):69.
WANG Yong,ZUO Yuexian. Detection of cyanides in blood by ion chromatography[J]. Modern Scientific Instruments,2011(4):69.
15 徐鹏程.浅议氰化氢的聚合与预防[J].内蒙古石油化工,2016(4):53.
XU Pengcheng. Discussion on the polymerization and prevention of hydrogen cyanide[J]. Inner Mongolia Petrochemical Industry,2016(4):53.
16 姚焕焕,唐磊.离子色谱法测定正常人血液中的氰化物含量[J].刑事技术,2017,42(2):144.
YAO Huanhuan,TANG Lei. Determination of cyanide content in normal human blood by ion chromatography[J]. Forensic Science and Technology,2017,42(2):144.
17 OGBUAGU E O , AIRAODION A I , OKOROUKWU V N ,et al. Cyanide toxicity:The good, the bad and the ugly[C]//Bio-Science and Bio-Technology.2019:157.
18 周航.保存血液中氰化物及其代谢物的死后产生研究[D].太原:山西医科大学,2020.
ZHOU Hang. Postmortem production of cyanide and its metabolites in preserved blood[D]. Taiyuan:Shanxi Medical University,2020.
引用本文: 吕惊晗,周晋升,宋丽娟,等 . 扩散-吸收提取/离子色谱法检验血中氰化物[J]. 化学分析计量,2024,33(10):23. (LYU Jinghan, ZHOU Jinsheng, SONG Lijuan, et al. Diffusion absorption extraction/Ion chromatography for the detection of cyanide in blood[J]. Chemical Analysis and Meterage, 2024, 33(10): 23.)

来源:化学分析计量


