您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-12-14 11:00
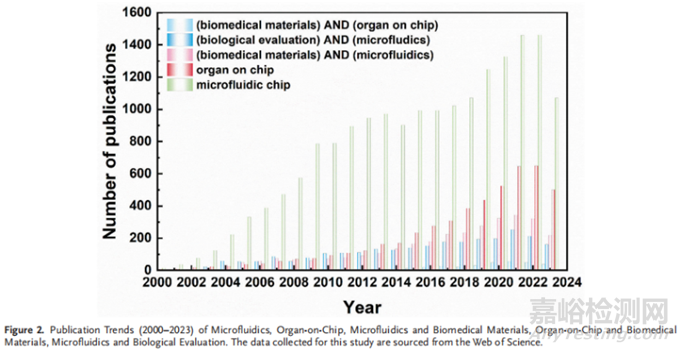
东南大学苏州医疗器械研究院顾忠泽、白晶、陈早早团队在《Advanced Healthcare Materials》期刊发表综述“Next-generation approaches for biomedical materials evaluation: microfluidics and organ-on-a-chip technologies”。该综述归纳总结了现有的生物学评价方法及优缺点,重点介绍了微流控技术用于生物医用材料评价的应用及器官芯片在材料评价方面的潜力,器官芯片有望成为评价生物医用材料的最仿生体外模型。最后,讨论了使用器官芯片评价生物医用材料在材料评价领域面临的挑战与机遇。
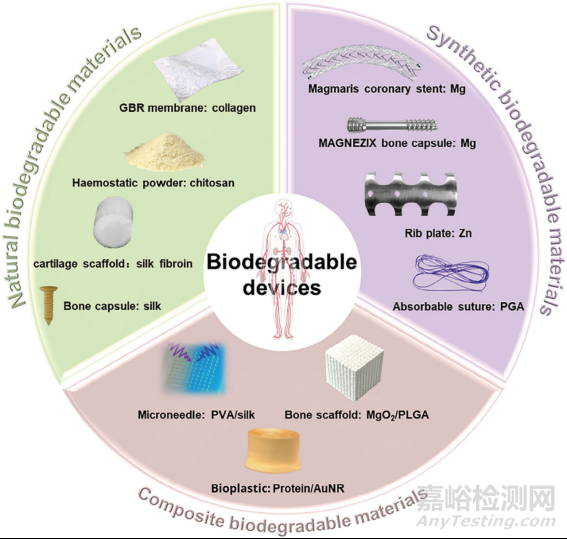
“生物医用材料”是指与活组织密切接触的生物医学设备的组件,经过设计可以替代丧失或患病的器官或组织,是植介入医疗器械的组成部分。为此ISO 10993规定了一系列强制标准来评价植介入器械的生物相容性以确保其安全性和有效性。目前,惰性生物材料如不锈钢、钛合金等由于需要二次手术移除植入物,增加了临床风险。而生物可降解材料能在人体安全降解并在周围组织愈合前提供临时支持,它解决了惰性材料需要二次手术移除的难题,受到了广泛关注。生物医用材料的发展也逐渐由不可降解材料发展为生物可降解材料。但材料的降解过程及降解产物对人体的影响使得生物可降解材料的生物学评价复杂化。
目前主要采用体外试验和动物试验评估生物医用材料的安全性和可行性。但体外试验和动物试验存在局限性,动物试验很难监测可降解材料在体内的降解行为,以及降解产物与组织的交互作用,此外,种属差异和伦理问题也使得动物模型具有逐渐被取代的趋势。体外试验缺乏血液流动和组织,无法真实地模拟体内环境。因此,寻求一种更真实全面的体外生物学评价方法至关重要。
总的来说,理想的体外模型应该具备以下几个特点:能够更好地模拟人体内的生理环境;在此基础上,便于研究材料界面和宿主反应;并且能够高通量地实时监测材料的降解行为和降解产物与细胞的动态反应。

什么是微流控技术?
微流控技术是一种以在微米尺度空间对流体进行操控为主要特征的科学技术。第一个微流控芯片实验是在1979年斯坦福大学的气相色谱研究中创建,1990年Manz和Widmer在微型芯片上实现了电泳分离,首次提出微全分析系统即微流控芯片,开启了微流控芯片发展道路。目前,微流控芯片可将化学和生物等领域中的基本操作单元集成到一块几平方厘米的芯片上,由微通道形成网络,以可控流体贯穿整个系统。微流控技术已经被广泛应用于分析化学、细胞分析、反应筛选和环境毒理学等研究领域。
微流控技术使细胞在几十到几百微米的通道中培养,并提供连续的营养交换、更好的氧灌注和生理剪切应力,可对体内微生理环境进行更好得模拟。基于此,微流控技术被认为是一种评估生物材料生物学特性的工具。目前,微流控技术已经被用于骨植入材料、血管支架材料等生物材料的筛选和生物学评价。
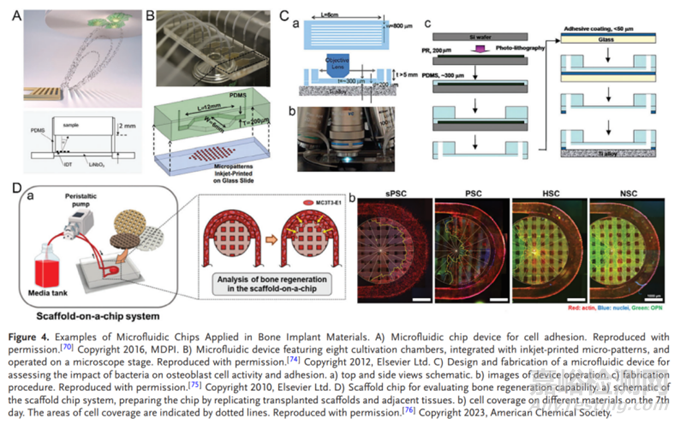
Andreas等设计了一个小型化(100 μL)的微流控芯片植入物系统,通过激发表面声波诱导微声流产生剪切应力,可在动态条件下定量测量植入物材料表面的细胞粘附,可对不同的植入材料进行动态筛选。进一步地,Sarah等开发了一种微流控平台研究Ti6Al4V作为骨修复生物材料对MC3T3-E1成骨细胞的细胞活力、增殖等细胞行为的影响,结果表明动态条件培养的细胞有更高的活力和更细长形态,但是芯片中的钛样品较难移出,使得评估细胞行为的标准生化检测需要改进。
生理流体动力学环境在细胞对可吸收支架降解行为的响应中有至关重要的作用。为了更好地模拟血管支架与内皮细胞和平滑肌细胞间的复杂动态相互作用, Ye等设计开发了一种微流控芯片用于模拟早期镁合金支架的血管微环境,研究镁基支架的降解行为以及支架与内皮细胞的相互作用。Shang等将植入血管支架的体内环境简化为微流控系统,研究了在接近生理流体条件下,剪切应力对镁基支架的降解的影响及支架的耐腐蚀性能。作者还将微流控系统与细胞培养芯片结合,评估了降解产物对血管细胞的影响。结果显示,微流控系统与传统浸泡试验和动物实验的结果趋势相同。

与现有的体外培养相比,单细胞微流控芯片构建了流动的共培养体系,提供了更具生理相关的微环境,例如生理流体流速以及剪切应力,但仍采用了平面细胞培养方式,无法再现三维组织结构。与真实人体内环境相比,微流控芯片在组织结构和微环境方面的构建有很大不足。此外,微米尺度下材料的放置与取出困难增加了材料生物学评价的难度。
什么是器官芯片?
器官芯片(OOC)是采用微流控技术在体外构建器官的核心组织结构的细胞培养装置,能够精准仿生包括器官周边细胞、周边分子和周边力学因素在内的微环境。在微流控芯片的基础上,器官芯片还具有不同的物理力,多细胞层结构,组织-组织界面以及人体的血管循环,可以重建器官的关键功能。21世纪前期,Michael Shuler等提出了用人体不同器官的细胞在芯片上构建人体组织,模拟人体环境的设想。直至2010年,Donald Ingber等开发了第一个肺器官芯片。目前,多种器官芯片模型已被构建,如肠芯片、肾芯片、皮肤芯片等。器官芯片的出现虽然较晚,但它可以存在整合多种细胞及模拟组织相关的生物力学的优势使得它已经被广泛应用于药物筛选、疾病建模和精准医疗等领域的研究。器官芯片技术被认为是最有希望代替动物试验的方法之一,在材料生物学评价领域的应用具有巨大的潜力。
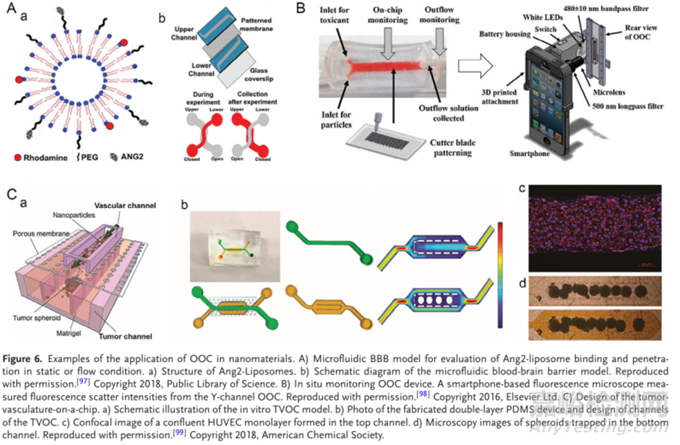
器官芯片技术在评价纳米材料的生物相容性方面增长显著。近年来,随着纳米材料应用于医疗领域的研究激增,关于纳米材料的生物学评价得到了人们的重视。不同于其他生物材料,纳米材料需要在具有适当扩散速率的动态流体中循环以避免快速沉降改变纳米材料与细胞的相互作用。器官芯片技术的微流体和3D细胞结构对纳米材料的生物学评价极具吸引力。
刺激试验是生物相容性评价中重要的一部分,针对3D皮肤等效物繁琐的操作程序和低通量,Zhang等构建了一种高保真度的表皮芯片,成功构建了集成屏障功能的器官型体外表皮模型。为了验证皮肤芯片的有效性,通过细胞毒性以及炎性细胞因子释放等测试了10种已知毒素和非毒素化学品的刺激,结果满足OECD标准,该模型可以进行可扩展的体外刺激性评估。可以预见的是器官芯片有望成为评价生物医用材料以及设计医疗器械的重要手段,可以用新方法从新角度分析生物材料的生物学问题。

挑战与展望
现有的生物医用材料评价方法主要针对生物惰性材料,而生物可降解材料植入体内后的反应受降解动力学和降解产物很大影响,宿主反应又会反过来影响材料的降解过程,这对材料的体外评价方法提出了系统、全面的新要求。这些不管是现有的体外试验还是动物试验都很难实现。
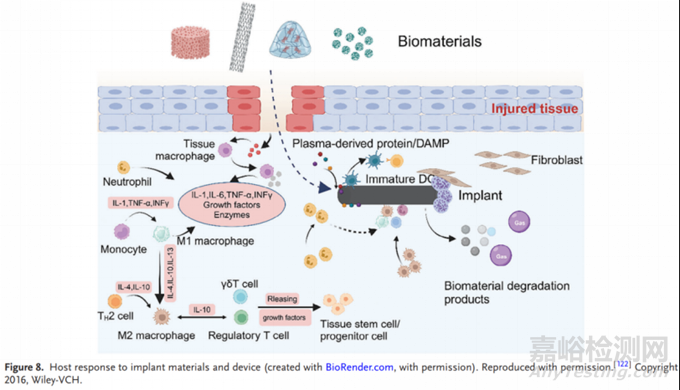
器官芯片已经可以部分实现理想体外模型的要求,但它作为新型生物学评价方法仍有需要改进的地方。器官芯片生物模拟手段的复杂性有限,原因之一是芯片内培养的细胞种类有限,如图8。此外,评估生物医学材料的一个关键挑战在于对材料本身的固有特性及其植入后对周围组织的影响探索不足。惰性材料由于长期磨损会逐渐向体内释放微粒。目前还没有足够的知识来控制降解动力学,以调节材料在体内的降解期。器官芯片的生物仿生系统为研究生物降解材料的降解性能提供了巨大的潜力。但生物可降解材料在体内引起的局部 pH 值和溶解氧水平的变化难以监测。虽然将生物传感器集成到器官芯片系统中可以解决这一问题,但提高生物传感器的长期稳定性和响应速度仍是未来研究的关键领域。有关降解产物在体内转化和代谢的研究很少。降解产物是否会积累并影响局部组织 pH 值和细胞分子水平,以及如何标记这些外来颗粒并明确其积累对组织的影响,都将是重要的研究方向。
现行的材料生物相容性评估标准以及 OOC 制作和测试规程仍需完善。在体外实验中观察到的生物降解材料的降解机制和副产物与人体环境中遇到的降解机制和副产物之间存在明显差异。器官芯片系统的标准化和统一化对于建立器官芯片结果、传统体外检测结果和临床结果之间的相关性至关重要。然而,在当前的标准化框架内,许多要素仍明显模糊不清。与术语相关的概念不够精确,交叉领域的界限也明显缺失。此外,在器官芯片上测量哪些指标、精确测量的方法等方面也缺乏共识。与此同时,欧盟委员会与各研究中心和欧洲标准化组织合作,制定了专门针对 OOC 技术的标准。时至 2023 年,欧盟已针对片上器官技术的发展实施了具体的监管措施,其中包括建立一个全球监管联盟,旨在为这些开创性方法确定验收标准,促进欧盟和全球监管机构之间观点和监管标准的统一。对器官芯片技术标准化的不懈追求仍是一项持续而重要的工作。
总之,要应对这些挑战,就必须整合多学科方法和技术。OOC 系统的不断完善为生物医学材料的评估和医疗设备的开发提供了令人兴奋的新途径。

来源:Internet


