您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2019-04-04 16:33
3月大事记Top1
关于发布化学仿制药参比制剂遴选与确定程序的公告(2019年第25号)
国家药品监督管理局组织制定了《化学仿制药参比制剂遴选与确定程序》现予发布。
(一)原研药品选择顺序依次为:国内上市的原研药品、经审核确定的国外原研企业在中国境内生产或经技术转移生产的药品、未进口原研药品。
(二)在原研药品停止生产或因质量等原因所致原研药品不适合作为参比制剂的情况下,可选择在美国、日本或欧盟等管理规范的国家获准上市的国际公认的同种药品、经审核确定的在中国境内生产或经技术转移生产的国际公认的同种药品。
(三)其他经国家药品监督管理局评估确定具有安全性、有效性和质量可控性的药品。
法规链接:http://www.nmpa.gov.cn/WS04/CL2138/335958.html
关于发布《化学仿制药参比制剂目录(第二十一批)》的公示
经国家药品监督管理局仿制药质量与疗效一致性评价专家委员会审核确定,现发布仿制药参比制剂目录(第二十一批)。
其中包括阿斯利康的注射用艾司奥美拉唑钠、诺华的盐酸昂丹司琼注射液等原研进口药。
法规链接:http://www.cde.org.cn/news.do?method=viewInfoCommon&id=314837
国家医疗保障局关于国家组织药品集中采购和使用试点医保配套措施的意见
针对北京市、天津市、辽宁省、上海市、福建省、广东省、重庆市、四川省、陕西省医疗保障局落实国家组织药品集中采购和使用试点工作,规范相关配套措施,提出以下指导意见:
一、落实医保基金预付政策
二、做好医保支付标准与采购价的协同
三、完善医保支付方式,鼓励使用集中采购药品
四、建立医院集中采购考核机制
法规链接:http://www.nhsa.gov.cn/art/2019/3/5/art_37_952.html
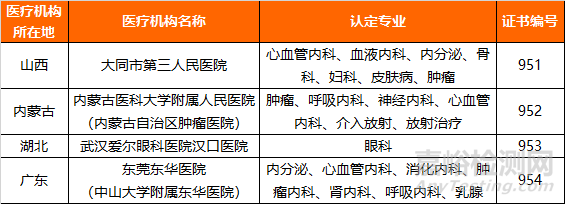
关于药物临床试验机构资格认定检查的公告(第3号)(2019年 第19号)
以下4家医疗机构被认定具有药物临床试验机构资格,发给《药物临床试验机构资格认定证书》
法规链接:http://www.nmpa.gov.cn/WS04/CL2111/335687.html
关于黄原胶、依地酸二钠国家药用辅料标准修订草案的公示(第二次)
国家药典委员会拟修订黄原胶、依地酸二钠国家药用辅料标准,现公示征求社会各界意见。公示期为三个月。
法规链接:http://www.chp.org.cn/view/ff80808169148bfc016979ac40a35c69?a=BZFULIAO
关于公开征求《非酒精性脂肪性肝炎治疗药物临床试验技术指导原则(试行)》意见的通知
指导原则由药品监督管理部门与临床研究者共同讨论制定,为非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)治疗药物的研发提供建议。指导原则只针对NASH伴有显著纤维化的成人患者,不涉及NASH相关失代偿期肝硬化和儿童患者。
法规链接:http://www.cde.org.cn/news.do?method=viewInfoCommon&id=314823
关于胃痛宁片等3种药品转换为处方药并修订药品说明书的公告 (2019年 第12号)
经国家药品监督管理局组织论证和审定,将胃痛宁片、化痔栓及消栓通络制剂(片剂、胶囊剂、颗粒剂)调出非处方药目录,按处方药管理,同时对上述药品说明书进行修订。皆应注明“请仔细阅读说明书并在医师指导下使用”,并增加相关警示语。
法规链接:http://www.nmpa.gov.cn/WS04/CL2115/335309.html
关于发布脑利钠肽/氨基末端脑利钠肽前体检测试剂等4项注册技术审查指导原则的通告(2019年 第11号)
国家药品监督管理局组织制定了《脑利钠肽/氨基末端脑利钠肽前体检测试剂注册技术审查指导原则》《总甲状腺素检测试剂注册技术审查指导原则》《孕酮检测试剂注册技术审查指导原则》《降钙素原检测试剂注册技术审查指导原则》,现予发布。
法规链接:http://www.nmpa.gov.cn/WS04/CL2138/335679.html
关于修订伤科接骨片、稳心制剂和牛黄解毒制剂说明书的公告(2019年第15号)
国家药品监督管理局决定对伤科接骨片和牛黄解毒制剂(片剂、丸剂、胶囊剂、软胶囊剂)增加警示语,并对其和稳心制剂(颗粒剂、胶囊剂、片剂)药品说明书【不良反应】、【禁忌】和【注意事项】等项进行修订。
法规链接:http://www.nmpa.gov.cn/WS04/CL2115/335425.html
关于修订骨刺胶囊和骨刺片说明书的公告(2019年第16号)
家药品监督管理局决定对骨刺胶囊和骨刺片药品说明书【警示语】、【不良反应】、【禁忌】和【注意事项】等项进行修订。
法规链接:http://www.nmpa.gov.cn/WS04/CL2115/335476.html
关于公开征求《eCTD技术规范》和《eCTD验证标准》意见的通知
为贯彻实施中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》的有关要求,加快药品审评审批信息化建设,推进药品按照电子通用技术文档要求进行申报和受理,CDE起草了《eCTD技术规范(征求意见稿)》和《eCTD验证标准(征求意见稿)》并向社会公开征求意见。
法规链接:http://www.cde.org.cn/news.do?method=viewInfoCommon&id=314816
关于修订蟾酥注射液说明书的公告(2019年第18号)
国家药品监督管理局决定对蟾酥注射液药品说明书【警示语】【不良反应】【禁忌】和【注意事项】等项进行修订。
法规链接:http://www.nmpa.gov.cn/WS04/CL2115/335751.html
关于修订通关藤注射液(消癌平注射液)说明书的公告(2019年第20号)
国家药品监督管理局决定对通关藤注射液(消癌平注射液)增加警示语,并对其药品说明书【不良反应】【禁忌】【注意事项】项进行修订。
法规链接:http://www.nmpa.gov.cn/WS04/CL2115/335799.html
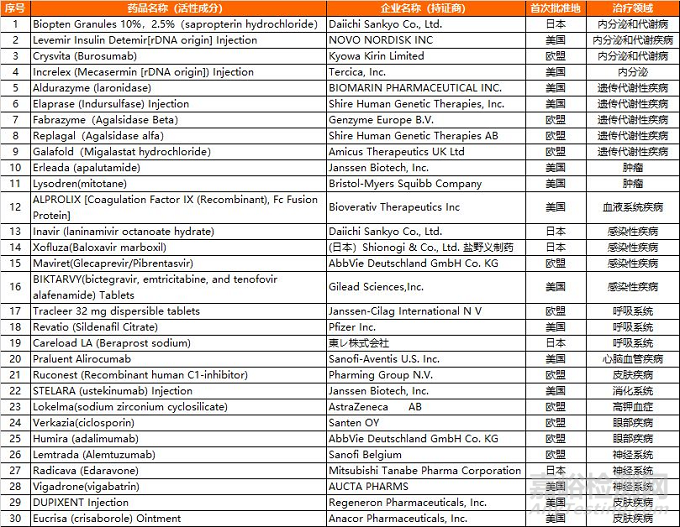
关于第二批临床急需境外新药的公示
国家药品监督管理局、国家卫生与健康委员会组织有关专家研究论证,遴选出了第二批临床急需境外新药。
<< 化学仿制药参比制剂目录(第二十一批 >>
法规链接:http://www.cde.org.cn/news.do?method=viewInfoCommon&id=314835


来源:SGS


