您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-05-05 21:46
来源:中国药学会中药临床评价专业委员会&全国中医药物临床试验机构(GCP)联盟
《中国中医·药物临床试验蓝皮书》
前言
中药新药临床研究在探索中前进,过去的36年中医GCP取得令人骄傲的成绩,完成了一大批中药新药临床研究、中药保护品种临床研究和中药上市后再评价工作,促进中医药产业的发展。同时培养了一支专业临床研究队伍,普及临床研究相关知识,推动中医临床研究伦理学建设,对提高我国中医临床研究水平发挥关键作用。
与此同时中医GCP还面临许多挑战,医院对临床研究重视不够,予以的资源和支持不多;不少医院项目较少,技术队伍和研究能力不足,临床医生积极性不高。临床试验数据核查以来,研发成本上升较大,而近年来中药产业由于各种原因面临较大困难,研发投入减少。基于“中医临床价值观”的中药新药技术评价体系有待完善,不少企业存在预期信心不足问题。
党和政府历来十分重视中医药事业发展,近年来中医药发展更是迎来很好的发展机遇。中医GCP工作虽然暂时遇到一些困难,但是前景是光明的!我们应该从更高的角度看待中医GCP工作,充分发挥中医GCP队伍在以下三方面的作用:
1. 中药产业升级主战场:由于历史原因,不少中成药存在临床定位不清、疗效与不良反应不明确问题,容易受到临床医生质疑,在医保支付方面处于劣势。中药产业要实现产业升级、发展壮大,必须加大中药新药研发和已上市中药再评价的力度。临床研究是其中最重要环节,因此,中医GCP是中药产业升级主战场!从掌握医学话语权的角度看,没有发达的中药产业就没有发达的中医事业;故此中医GCP队伍应积极、主动助力中药企业做大做强,而强大中药企业必将为中医事业发展提供有力支撑。
2. 中医循证医学主阵地:循证医学理念引入中医领域30年来,迄今为止具有较高级别证据的临床研究不多;坐而论道讲方法学的较多,起而行之开展临床研究的少。中医GCP队伍是我国开展高水平、高质量临床研究的先锋队和主力军,具有丰富的研究经验和技术积累;必然是中医高级别循证医学证据主产地!发挥好GCP队伍技术作用,对于实现“中医疗效有数据,中医优势有证据”目标具有重要的意义。
3. 高水平中医院重要标志:GCP实施有赖于临床专科综合能力与认真严谨的科学态度,是对研究者及其团队的考验;高水平临床研究是高水平医院的重要标志。目前许多著名的医院GCP工作开展得如火如荼,临床研究受到全面重视。医院通过开展临床研究锻炼队伍,培养临床研究人才,提高临床诊疗水平,密切学术交流;以GCP建设为抓手,是建设高水平中医院必由之路。
回顾过去的36年,老一辈专家筚路蓝缕;面对未来我们充满信心!为总结成绩,鼓舞士气,彰显中医GCP学术影响力,中国药学会中药临床评价专业委员会与全国中医药物临床试验机构联盟共同发起撰写《中国中医药物临床试验蓝皮书》,由于时间仓促、水平有限,蓝皮书中错误、遗漏不少,蓝皮书仅供参考,并欢迎批评指正!
中国药学会中药临床评价专业委员会 主任委员
全国中医药物临床试验机构(GCP)联盟主席
广州中医药大学第一附属医院 杨忠奇教授
2019年3月28日
一、我国中药新药临床研究概述
(一)机构建设
为开展新药临床评价工作,1983年原卫生部开始建立“国家临床药理基地”,原中国中医研究院和广州中医学院等率先成立“国家中药临床药理基地”,到1993年全国各地已经建立15家“国家中药临床药理基地”。1998国家药品监督管理局成立后,“国家临床药理基地”更名为“国家药品临床研究基地”,基地改设在医院;1999年国家药品监督管理局批准36家“中药新药国家药品临床研究基地”。2001年《中华人民共和国药品管理法》修订后,“国家药品临床研究基地”更名为“药物临床试验机构”。2004年国家食品药品监督管理局颁布《药物临床试验机构资格认定办法》,陆续进行药物临床试验机构认证和复核检查。截至2019年3月全国总共认定药物临床试验机构734家,其中中医院80家、中西结合医院10家、维吾尔医院2家、藏医院2家和蒙医院2家,认定的专业累计中医专业846个、中西医结合专业13个、维吾尔医专业11个、藏医专业14个和蒙医专业16个。
(二)能力建设
在长期的中药新药临床研究实践中,中医药物临床试验机构建设日渐完善,专职GCP技术队伍不断发展壮大,研究经验和技术力量得到显著提升。大批专家成为我国中医临床研究中坚力量,他们主持中药新药临床方案的设计与实施、承担国家重大科研项目、参与国家药监局有关技术指导原则制定、担任国家药监局中药新药审评专家和临床核查专家等。北京、上海、广州、天津、南京、成都等一批中医药物临床试验机构先后获得国家重大新药创制项目资助。2006年广州药中医药大学第一附属医院率先参加国际多中心新药Rivaroxaban临床试验,迄今已有11家中医院参与到国际多中心新药临床试验,将国际临床研究操作规范引入中医药临床研究领域。2016年中国中医科学院西苑医院被国家发改委批准为“中药临床疗效和安全性评价国家工程实验室”,充分发挥行业引领作用。2018年广州中医药大学第一附属医院完成我国自主研发PD--1卡瑞利珠单抗I期临床试验,研究结果发表于《Lancet Oncology》》(柳叶刀·肿瘤,共一);该院技术支持我国首个中药注射液——参芪扶正注射液于于2019年3月在美国顺利完成I期临床试验;充分说明了我国中医GCP队伍已经具备较强的技术服务能力。
(三)学术活动
中药新药临床试验没有现成的国内外研究方案可以参考,在临床研究实践过程中,如何实现即符合规范又体现中医药特点的临床研究,有许多学术问题需要讨论,形成行业共识。2013年杨忠奇教授、高蕊教授和胡思源教授等人联合全国中医GCP同行发起首届中药新药临床试验高峰论坛(Chinese Medicine Clinical Trials,CMCT)),会议以“交流实践经验,解决实际问题”为主旨。会议于2013年12月在广州白云国际会议中心举行,这是我国实施GCP以来中药新药临床试验规模最大的一次专业性会议
首届会议成功进行使CMCT成为中医GCP品牌会议;CMCT-2014在贵阳举行,贵阳中医药大学第一附属医院潘定举主任担任主席;CMCT-2015在南宁举行,广西中医药大学附属瑞康医院梁春才主任担任主席;CMCT--2016在天津举行,天津中医药大学第一附属医院胡思源教授担任主席;CMCT--2017在上海举行,上海中医药大学附属曙光医院元唯安主任担任主席;CMCT--2018在北京举行,中国中医科学院西苑医院高蕊研究员担任主席;CMCT--2019在武汉举行,湖北省中医院刘建忠教授担任主席。
(四)成立联盟
为更好团结广大中医GCP,技术人员,提高我国中药临床评价整体能力,为中药新药研发提供有力技术支撑。2013-2015年经同行专家广泛讨论决定以CTMCT为基本架构成立“全国中医药物临床试验机构”联盟”,以提高中医药临床研究能力、质量和效率。广州中医药大学第一附属医院杨忠奇教授为联盟主席;湖北省中医院刘建忠教授、成都中医药大学第一附属医院丁红教授、湖南中医药大学第一附属医院赵艳玲教授、黑龙江中医药大学第二附属医院张淼教授、山西省中医院郝旭亮教授和上海中医药大学附属龙华医院王菊勇教授推举为副主席,江苏省中医院邹冲主任为秘书长。
(五)成立专委会
随着中医GCP学术影响力扩大,成立专业委员会成为大家的共同愿望。经申请中国药学会理事会批准成立“中药临床评价专业委员会”,2018年9月3日在北京经全体委员候选人选举产生第一届委员会;第一届委员会由39名来自医疗机构、高校、企业、研发公司和相关部门专家组成。广州中医药大学第一附属医院杨忠奇教授当选为主任委员,国家药审中心唐健元研究员、天津中医药大学第一附属医院胡思源教授、中国中医科学院西苑医院高蕊研究员和上海中医药大学附属曙光医院元唯安主任等专家当选为副主任委员,首都医科大学附属北京中医医院李博主任担任学术秘书。
2018年9月19日在成都隆重举行“中药临床评价专业委员会”成立仪式,中国药学会孙咸泽理事长、监事长陈凯先院士、副理事长黄璐琦院士、丁丽霞秘书长、王爱国副秘书长、梁毅部长等领导亲自到会祝贺。会议同时举办“首届中药临床评价关键技术论坛”,陈凯先院士和黄璐琦院士为会议作了精彩的学术报告。
二、中药新药临床研究有关政策、法规与技术文件
(一)政策法规
1998年卫生部颁发《药品临床试验管理规范(试行)》;2003年国家食品药品监督管理局颁布《药物临床试验质量管理规范(GCP)》;2010年国家食品药品监督管理局颁布《药物临床试验伦理审查工作指导原则》;2010年国家中医药管理局颁布《中医药临床研究伦理审查管理规范》;2015年国务院印发《关于改革药品医疗器械审评审批制度的意见(国发〔2015〕444号)》。2016年国家卫生和计划生育委员会颁布《涉及人的生物医学研究伦理审查办法》;2017年国家食品药品监督总局加入国际人用药品注册技术协调会(ICH);2017年中共中央办公厅、国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,这些涉及新药临床研究法规政策,规范和鼓励GCP的实施。
(二)技术指导文件
1978年》卫生部发布《中药新药临床研究指导原则》,之后增补修订三辑。2002年国家药品监督管理局发布《中药新药临床研究指导原则》,之后陆续增补、修订和发布有关指导原则,初步形成中药新药临床评价技术体系。近年颁布的技术指导原则目录如下:
1.证候类中药新药临床研究技术指导原则(2018年)
2.中药新药用于痴呆的临床研究技术指导原则(2018年)
3.中药药源性肝损伤临床评价指导原则(2018年)
4.中药新药用于肠易激综合征临床研究技术指导原则(2017年)
5.中药新药用于功能性消化不良临床研究技术指导原则(2017年))
6.中药新药用于咳嗽变异性哮喘临床研究技术指导原则(2017年))
7.中药新药用于类风湿关节炎临床研究技术指导原则(2017年)
8.中药新药用于慢性心力衰竭临床研究技术指导原则(72017年)
9.中药新药治疗流行性感冒临床试验指导原则(2016年)
10.中药新药临床研究一般原则(2016年)
11.中药新药治疗原发性骨质疏松症临床研究(2015年)
12.中药新药治疗中风临床研究技术指导原则(2015年)
13.中药新药治疗恶性肿瘤临床研究技术指导原则(2015年)
14.中药、天然药物治疗女性更年期综合征临床研究技术指导原则(2011年)
15.中药、天然药物治疗冠心病心绞痛临床研究技术指导原则(2011年)
(三)其他有关的技术指导原则,具体目录如下:
1.中成药规格表述技术指导原则的通告(2018年)
2.发布中药资源评估技术指导原则的通告(2018年)
3.中成药通用名称命名技术指导原则(2017年)
4.中药、天然药物改变剂型研究技术指导原则(2015年)
5.已上市中药变更研究技术指导原则(2011年)
6.中药、天然药物药品说明书撰写原则(2007年)
7.中药、天然药物临床试验报告的撰写原则(2007年)
8.中药、天然药物申请临床研究的医学理论及文献资料撰写原则(2007年)
9.中药、天然药物综述资料撰写的格式和内容的技术指导原则--临床研究综述(2007年)
三、近五年(2014-2018)我国中药临床研究概况
(一)我国中医药物临床试验GCP机构数量及区域分布情况
北京、广东、江苏各9家,上海7家,山东5家,河北、河南、新疆、浙江各4家,福建、黑龙江、湖北、湖南、辽宁、内蒙古、天津各3家,广西、吉林、江西、陕西、四川、重庆各2家,安徽、甘肃、贵州、海南、青海、山西、西藏、云南各1家。
具体分析如下:
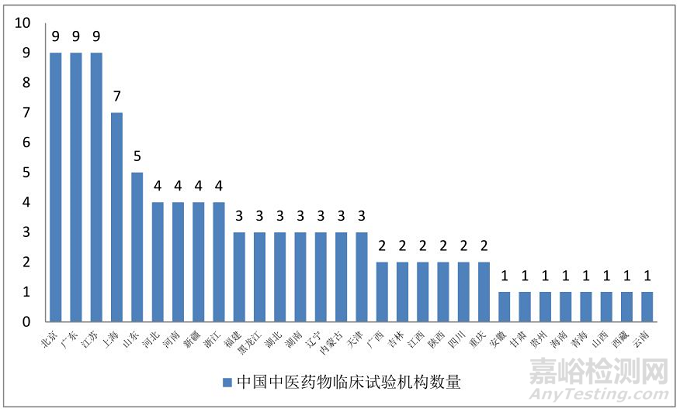
图1. 中医药物临床试验GCP机构区域分布
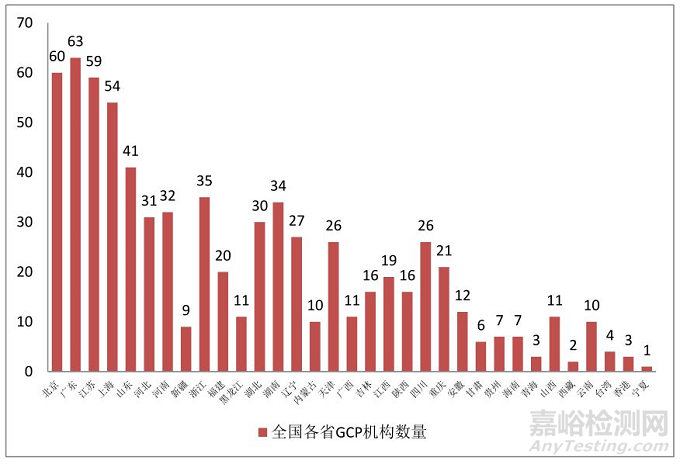
图2. 全国药物临床试验GCP机构区域分布
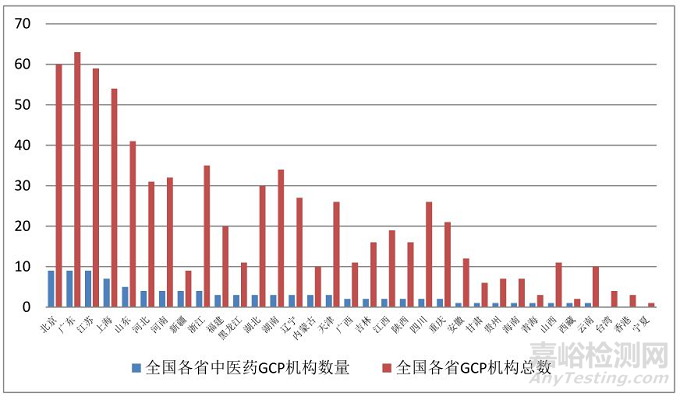
图3. 中医GCP机构/全国GCP机构对比
(二)全国中医GCP机构临床试验项目统计分析
1.近5年(2014-2018年)临床试验立项情况:近5年全国中医GCP机构临床试验总立项数为3280项,其中2014年910项,2015年699项目,2016年410项,2017年558项,2018年703项。
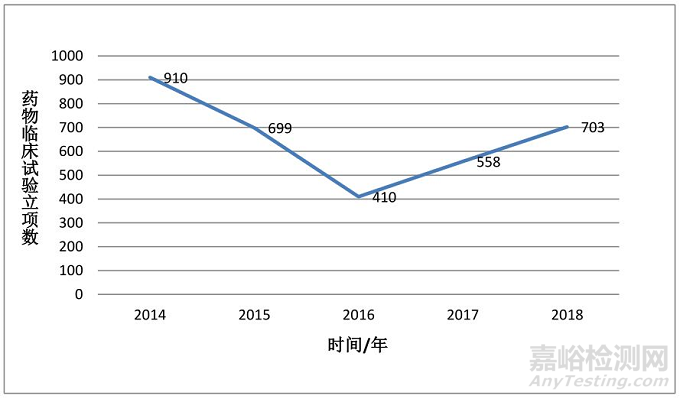
图4.2014 年-2018年全国中医GCP机构临床试验立项数趋势
2.立项数排名分析:近5年立项排名前十的机构单位立项数均在100项以上,前10名合计1404项,占总数的42.8%。
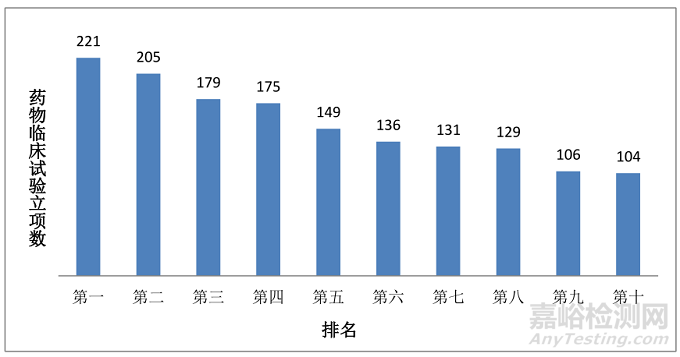
图5.2014年-2018年临床试验立项数前10名情况
(三)药物临床试验分期和注册分类情况
1.分期情况:在2828项药物临床试验中,I期122项(占4%),Ⅱ期927项(占33%),Ⅲ期768项(占27%),Ⅳ期720项(占26%),生物等效性试验291项(占10%)。
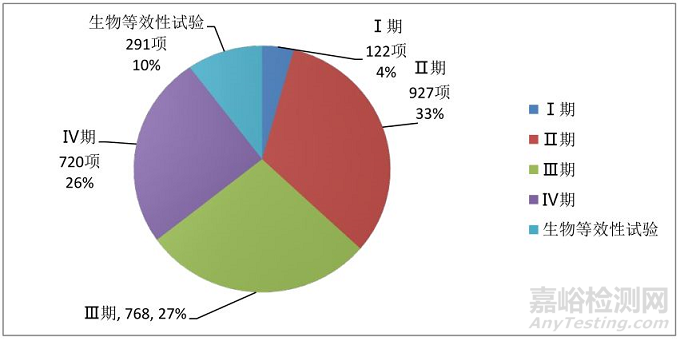
图6.2014年-2018年药物临床试验分期情况
2.药物注册分类:中药占据绝对优势,达2349项,占82%;化学药物481项,占17%;生物制品较少,只有46项,占1%。
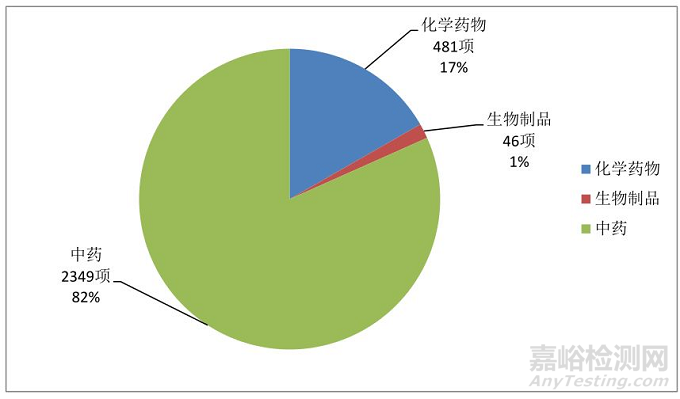
图7.2014年-2018年临床试验药物注册分类情况
3. 中药临床试验分类:中药新药高达1682项,占72%,中药上市后评价523项,占22%,中药保护品种144项,占6%。
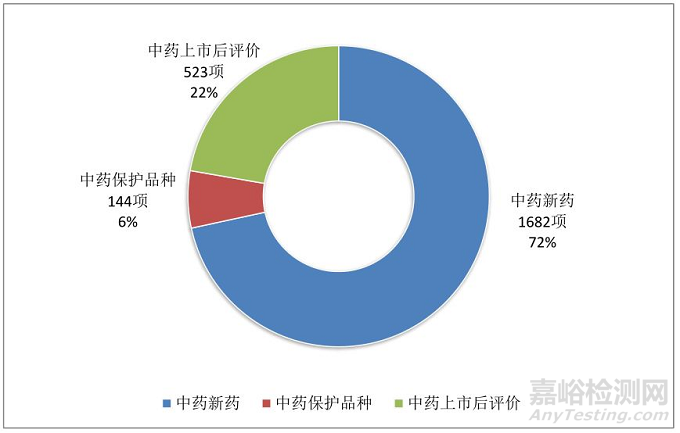
图8.2014年-2018年中药临床试验分类情况
(四)国际多中心项目情况:11家单位参加50项国际多中心试验。
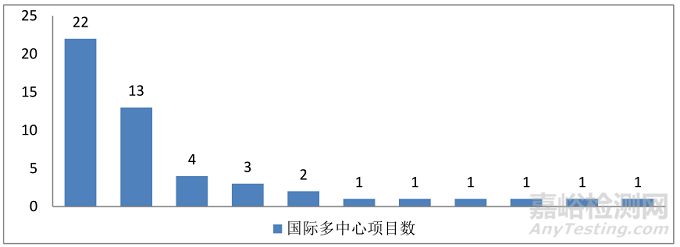
图9.2014年-2018年参加国际多中心临床试验项目情况
(五)组长单位项目情况:33家机构担任组长,总共576个项目。
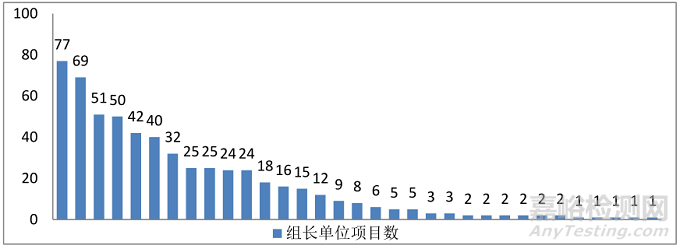
图10.2014年-2018年全国中医GCP机构担任组长单位项目情况
(六)I期临床研究中心:32家医院I期病房,共计床位1221张。
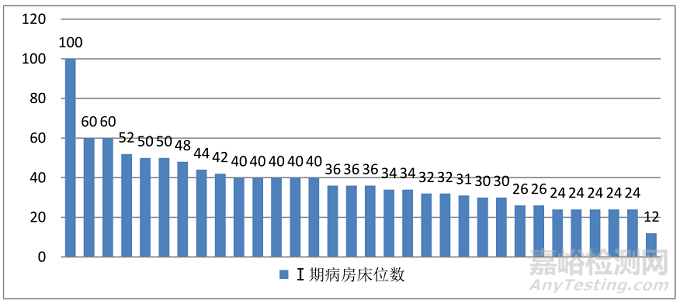
图11. 2018年全国中医GCP机构I期病房床位数量
四、近五年我国中药临床研究概况解读
全国中医GCP机构合计96家,中医院80家、中西结合医院10家、维吾尔医院2家、藏医院2家和蒙医院2家。。中医GCP机构较少,大约为全国GCP机构总数的13%,且存在区域分布不平衡情况,大部分省市只有1-3家,难以形成区域技术协同效益。但在96家中医GCP机构中,32家医院有I期病房,占1/3比例,共计床位1221张;供过于求,导致床位与资源浪费,许多机构承接试验项目困难。
近5年(2014-2018年)全国中医GCP机构临床试验总立项数为3280项,其中2014年910项,2015年699项目,2016年410项,2017年558项,2018年703项。从立项情况看目前中药临床试验虽然没有达到高峰期,但已经逐步走出低谷。与此同时存在项目分布不平衡情况,前10名机构立项合计1404项,占总数的42.8%;许多中医GCP机构项目较少,导致效益和效率都不高,技术提升较慢。
从临床试验分期情况看,在2828项药物临床试验中,I期期122项(占4%),Ⅱ期927项(占33%),Ⅲ期768项(占27%),Ⅳ期期720项(占26%),生物等效性试验291项(占10%)。其中新药I期项目少,中药新药的的I期项目更少,这是个不好的信号;说明中医药创新能力不足,科研成果转化缺乏来源。Ⅱ期、Ⅲ期临床试验虽然不少,但是申报新药注册的项目很少,提示中药新药临床试验效率较慢,申办者和CRO公司临床试验管理能力有待加强,中医GCP机构临床研究能力亟需提高。
从中药临床试验分类,中药新药高达1682项,占72%;中药上市后评价523项,占22%,中药保护品种144项,占6%。说明严格按照照GCP要求开展的中药上市后评价项目其实不多,导致许多中药上市后评价临床研究质量不高,临床研究结论难以为同行采信。中药保护品种临床试验大幅度萎缩,说明《中药保护品种条例》(1992年国务院院106号令)政策红利基本消失,对企业缺乏吸引力。
五年中开展的2828项药物临床试验中,中药占据绝对优势,达2349项,占82%;化学药物481项,占17%;生物制品较少,只有46占项,占1%。在承接的化药项目中大多数是生物等效性试验,虽然有11家参加50项国际多中心试验,但是除个别机构外其他实践经验很少;说明中医GCP机构较为封闭,包括业务对外拓展、与国内外医院合作、技术接轨均较少,不利于中医临床研究水平的提高。特别是中国已经加入ICH-GCP,面对挑战中医GCP机构应该积极主动参与更多、更高水平的临床研究中去。
五、存在的问题
基于目前对医务人员绩效考核标准,药物临床试验即不是医疗业务工作也不是医学科研工作,更多时候成为“业余工作”。又因药物临床试验涉及药品的疗效和安全性,须承担相应法律责任,不少医务人员视为畏途,开展临床试验积极性不高。
临床试验质量与效率至关重要,有赖于临床研究能力提高。目前部分医院还存在临床研究培训不足、认识不够、体会不深、经验缺乏等问题;临床试验管理模式和流程较为陈旧,效率不高。
药物临床试验专职技术人员,是一支涵盖医学、药学、护理、生物统计等知识的复合型技术队伍。但是目前职称评定对于药物临床试验专职技术人员十分不利,GCP专职技术长期处于尴尬地位,无法得到更大的晋升空间与职业发展机会,导致人员流动、人才流失。
此外,社会公众对药物临床试验的理解与支持水平较低,临床试验招募患者困难等各种因素。
六、展望
临床试验是确认新药的临床疗效和安全性唯一途径,目前全球各国都十分重视临床研究在医学事业和医药产业中的核心纽带作用。
没有发达的中药产业,就没有发达的中医事业,要研发更好的中药,要发展中医药事业,要促进公众健康,就要开展临床试验。
我们相信,在国家有关政策鼓励下,在各级领导的大力支持下,发扬中医GCP人“求真、求实”精神,一定能够为中医药事业发展做出应有的贡献!
中国药学会中药临床评价专业委员会
2019年3月28日

来源:AnyTesting


