您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2019-06-12 09:35
医疗器械厂商在开展风险管理工作时,通常会考虑材料的生物学危害,那如何证明材料的安全性呢?开展生物相容性测试是不二选择。由于医疗器械类别多样,使用的材料也纷繁复杂,所以测试项目会有很大差异。
例如,材料成熟且成分单一、使用风险低的非侵入器械可能开展“基础三项”就足矣,但对于材料新颖、使用风险高的植入器械而言,可能就需要完成更多的测试项目。那么,厂商该如何选择合适的测试项目呢?本文将和大家一起讨论这个话题。
1、医疗器械的类别
生物学评价的核心是关注材料的安全性。不同材料、不同使用部位、以及不同接触时长都会导致不一样的生物学危害,因此开展的测试项目也会不尽相同。为了让厂商更方便地识别和明确测试项目,生物学评价的参考标准ISO 10993-1:2018按照人体接触性质和接触时间对医疗器械进行了分类。
1. 按人体接触性质分类
按照人体接触性质,医疗器械可分为三种情况:表面接触、外部接入和植入。
表面接触器械
关于这一条分类标准,大家要关注器械与人体表面接触部位的性质。第一种情况是仅与完整皮肤接触的器械,常见的器械有压缩绷带、固定带、电极片、体外假体等;第二种情况是与无损伤粘膜接触的器械,比如导尿管、气管插管、支气管镜、胃镜、肠镜等;第三种情况是与伤口或损伤表面接触的器械,最常见的产品就是创可贴,其它产品还包括各种敷料或封闭敷贴等。
外部接入器械
外部接入器械的分类要考虑应用部位,通常分为三种情况:1)与血路间接接触的器械,一般指与血路上某一点接触并作为管路向血管系统输入的器械,典型代表是输液器和输血器;2)与组织、骨或牙髓/牙本质系统接触的器械,相对应的代表器械有腹腔镜、关节内窥镜、牙科填充物等;3)与循环血液接触的器械,比如透析器、透析管路及附件、血管内导管、临时性起搏电极等等。
植入器械
按照植入物的接触部位,植入器械可分为两类:1)与组织/骨接触的器械,与组织和组织液接触的典型器械有乳房植入物、起搏器、植入性给药器械、人工肌腱等,与骨接触的代表器械有人工关节、骨钉骨板、骨水泥等;2)与血液接触的器械,例如心脏瓣膜、人工血管等。
2. 按接触时间分类
根据接触时间,医疗器械可以明确分为三类:1)短期接触(A):24小时内一次、多次或重复使用或接触的器械;2)长期接触(B):24小时至30天内一次、多次或重复长期使用或接触的器械;3)持久接触(C):30天以上一次、多次或重复长期使用或接触的器械。
特别要注意的是,对于多次接触的器械,在分类时要考虑潜在的累积效应,要计算接触过程中总的跨越时间。例如,烧伤病人在使用敷贴时,由于换药时使用的是同一规格型号的产品且换药间隔很短,所以不能将单个的敷贴孤立来看,而应该考虑多个产品的累积作用,将使用时间叠加。
另外,该标准明确提到,如果一种材料或器械兼属于两种以上的时间分类,应采用较严的试验或评价考虑。
2、如何选择生物相容性测试项目
大家如果按照上述两个分类原则确定了器械类别,接下来就可以根据标准ISO 10993-1:2018的附录A表格1给器械“找定位”了。该表格明确了器械类别和测试项目的关系,表格的第一列是器械类别,第二列是接触情况,第三列是接触时间,第四大列是测试项目。
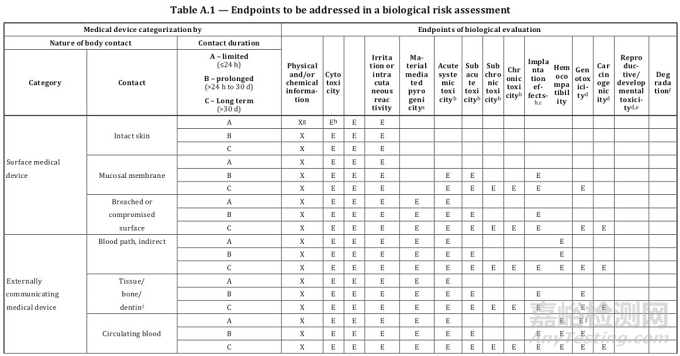
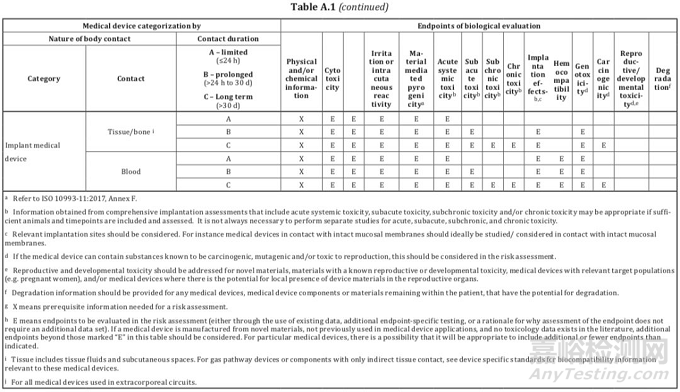
我们以血压计和心脏瓣膜为例,看看到底要开展哪些生物相容性测试。血压计属于与人体表面接触的器械,接触部位为完整皮肤且接触时间小于24小时,与表格的第一行对应,所以开展的项目为体外细胞毒性测试、刺激和致敏测试,也就是大家常提到的“基础三项”。
心脏瓣膜属于植入器械,接触部位为循环血液且接触时间大于30天,与表格的最后一行对应,要开展的测试项目除“基础三项”外,还包括材料介导的致热原性、急毒、亚急毒、慢毒、亚慢毒、局部植入效应、血液相容性、遗传毒性和致癌性。所以,像心脏瓣膜这种高风险的产品,几乎所有的测试项目都要涉及到。通过上述两个例子大家不难发现,如果器械类别很明确,其实是很容易通过表格A.1找到合适的测试项目。
3、总结
目前,虽然市场上有很多成熟的第三方检测机构能够从测试项目选择、到开展测试、再到出具报告,帮助医疗器械厂商完成生物学评价工作,但古话说得好“知其然,知其所以然”,特别是在测试项目选择阶段,大家如果能够清晰地识别出产品要做哪些测试,这一定可以让你事半功倍。
参考资料:
1. ISO 10993-1:2018 Biological evaluation of medical devices -- Part 1: Evaluation and testing within a risk management process
2. 医疗器械生物学评价指导原则第1部分:总则(征求意见稿)

来源:启升资讯


