您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-12-03 15:14
医疗器械和材料的某些成分和降解产物可能会使人体免疫系统产生免疫毒性,其对人体免疫系统的影响已引起越来越多的关注。但由于目前尚没有标准化试验,GB/T 16886中第20部分给出的是如何进行免疫毒性评价方面的框架,包括医疗器械潜在免疫毒理性方面的免疫毒理学综述和用于检验不同类型医疗器械免疫毒性的方法指南。
医疗器械诱导的免疫变异临床指征研究的关键领域
免疫抑制
免疫刺激
超敏反应
慢性炎症
自身免疫
风险评定与风险管理
风险评定包括危害识别、剂量反应评定和接触评定,同时进行风险的表征。应在风险表征的基础上按照ISO14971进行实施风险管理。
由于很难预测新化学物和新材料的免疫毒性,所以风险的评定和管理的重心应放在医疗器械含有的已知免疫毒性化学物,主要通过广泛的文献检索进行识别,然后考虑综合风险管理/风险降低程序,同时采取能够进一步降低剩余风险的各种措施,比如在标签上注明禁忌症、产品召回、设计改变和使用或应用限制。
危害的识别
免疫危害信息可通过许多途径获得,包括但不仅限于此:
——材料表征;
——残留物表征;
——可沥滤材料的表征;
——添加到医疗器械中的药品和其他物质的表征;
——接触时间和接触途径的表征;
——与化学物、药品或材料既往接触的观察;
——毒性试验。
迄今为止大部分已识别的免疫学反应与材料添加剂有关,因此这些化学物的接触评定对于识别免疫危害是重要的。
不同类型医疗器械的各种材料可能发生的免疫应答见下表:
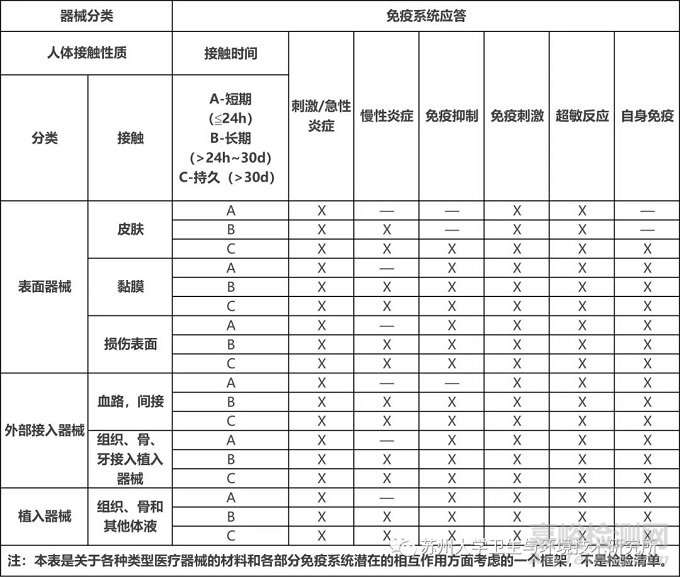
免疫毒性可根据已知的免疫学结果进行预测,。
最可能具有免疫原性的物质是蛋白质、多糖、核酸和脂类、动物组织等生物源材料已知可激发免疫应答。小分子量物质一般无免疫原性,但其可与宿主蛋白质结合而具有免疫原性。
免疫毒性评定方法
总则
◆可采用体内和体外法进行免疫毒性试验。与体内免疫毒性试验相比,体外法由于无法模拟整个免疫系统的复杂情况,试验有一定的局限性,但可用作机制方面的研究。
◆在考虑进行动物试验时,宜按照ISO10993-2的规定对已有的替代方法、减少动物数量的方法和改良的替代方法进行试验,同时还需慎重考虑免疫毒性试验的生物学意义和预测价值。
◆免疫毒性检验可分为非功能性和功能性检验两种类型。非功能性检验在测定中具有描述特性:形态学方面和/或定量的术语、淋巴组织变化、淋巴细胞数目和免疫球蛋白水平或其他免疫功能标志物。功能性检验则测定细胞和/或器官活性,如淋巴细胞增殖、细胞毒活性、特异性抗体形成。
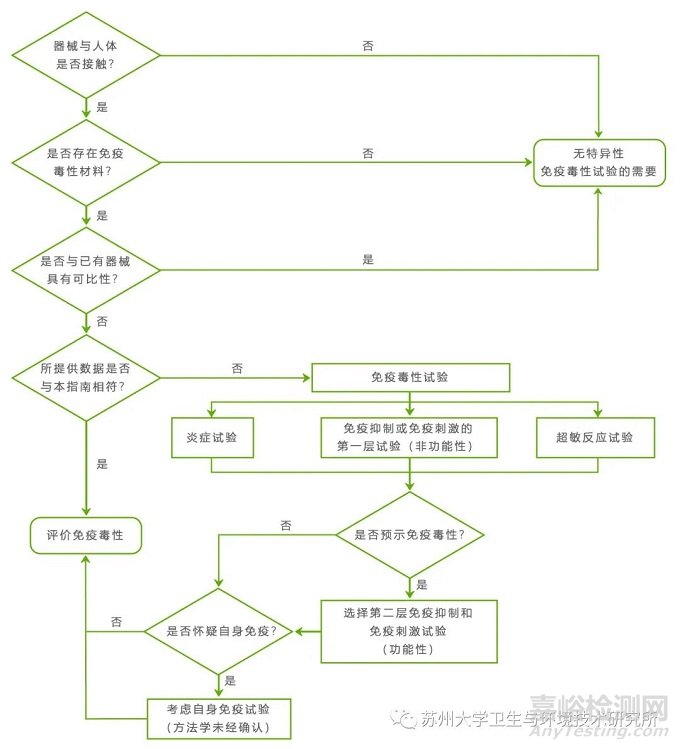
◆免疫毒理学危害的评价的设计流程图:
炎症
◆评价植入异物后引起炎症反应程度的最直接最适当的方法,就是对异物注射或植入部位进行组织病理学观察。与免疫毒性相关的炎症是以淋巴细胞为主的损害。可参考ISO 10993-6。
免疫抑制
◆一般采用阶层式评估,分为二层,见评价流程图:
◆第一层中抑制指征主要为非功能性检验,免疫器官重量、细胞数目和/或细胞群以及免疫球蛋白的变化。
◆第二层中可采用更特异性的免疫功能检验,比如测定作用物在主动免疫期间对自然杀伤(NK)细胞活性和/或免疫功能方面的影响,例如:致敏后抗原特异性抗体产生的检验。
◆单一的毒性或免疫抑制试验不能用于评价所有的免疫相关项目,因此需要鉴别最重要的指示性项目,以选择有效的方法去评价特定因素的免疫抑制作用。
免疫刺激
◆用于免疫抑制的检验方法通常也适用于免疫刺激的检测。
超敏反应
◆医疗器械最常见的超敏反应是迟发型超敏反应(Ⅳ型)和速发型超敏反应(Ⅰ型),对于Ⅰ型超敏反应尚没有好的预测性试验。
◆迟发型超敏反应(Ⅳ型)包括抗原特异性细胞炎症应答,参考ISO 10993-10。
自身免疫
◆目前还没有建立能够将动物数据外推至人的用于检验过敏症和自身免疫的有效动物模型。
临床前试验提供数据的外推
因免疫系统的免疫沉积和/或储备的特性,体外试验和动物试验对于人类的意义非常复杂。
免疫毒理学作用不一定就会影响健康,且由于位置不同就需要采用特定的试验,免疫病理也不同,这些现象通过传统的一般毒性试验并不能够区分出来。

来源:GB/T 16886.20-2015


