您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-04-21 11:29
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
君实新冠口服药启动头对头III期临床。君实生物与旺山旺水生物合作开发的口服核苷类抗SARSCoV-2药物VV116片登记启动一项III期临床,评估与辉瑞Paxlovid对比早期治疗轻中度新冠肺炎的有效性和安全性。申办者为上海交通大学医学院附属瑞金医院。今年3月中旬,该新药刚刚在评估对比标准治疗用于中重度新冠患者的国际多中心、随机、双盲、对照III期临床中完成首例患者入组及给药。
国内药讯
1.康诺亚ADC品种获FDA快速通道资格。康诺亚开发的Claudin 18.2靶向ADC新药CMG901获FDA授予快速通道资格,用于治疗复发/难治性胃癌及胃食管结合部腺癌。今年4月初,FDA也授予该新药用于相同适应症的孤儿药资格。CMG901是由Claudin 18.2特异性抗体、可裂解连接子及毒性载荷一甲基澳瑞他汀E构成,目前该新药已在中美获批开展临床试验。预计今年第二季度初,康诺亚将在中国启动CMG901的剂量拓展研究。
2.香雪第二款TCR-T获批临床。香雪制药旗下香雪生命科学的创新产品TAEST1901注射液获国家药监局临床试验许可,拟用于治疗组织基因型为HLA-A*02:01、肿瘤抗原AFP表达为阳性的晚期肝癌或其它晚期肿瘤。这是一种HLA-A*02:01/AFP特异性的TCR-T治疗产品,是该公司获批临床的第二款TCR-T。在临床前研究中,TAEST1901显示出良好的安全性,针对HLA-A*02:01和AFP双阳性的靶细胞也具有特异性药效特征。
3.默沙东双重激动剂获批NASH临床。默沙东1类生物制品MK-6024注射液获国家药监局临床默示许可,拟用于非酒精性脂肪性肝炎(NASH)的治疗。MK-6024(efinopegdutide)是韩美公司开发的每周一次的GLP-1R/GCGR双重激动剂,它不但可以激活GLP-1R,提高胰岛素分泌并且降低食物摄入,还可以激活GCGR起到降低炎症和脂肪生成等效果。目前该新药正在Ⅱ期临床中评估与司美格鲁肽相比治疗NAFLD的疗效。
4.朗信LCA基因疗法获批眼科临床。朗信生物旗下朗昇生物1类新药LX101注射液获国家药监局临床试验默示许可,用于治疗RPE65双等位基因突变相关的遗传性视网膜变性(IRD)患者。LX101是一款以rAAV为载体的基因疗法,通过对RPE65基因编码序列优化设计,高效表达人源RPE65蛋白,补偿因该基因突变导致的蛋白功能缺失。在研究者发起的临床研究中,LX101表现出良好的安全性,且已在多例患者中见到视力提高的疗效。
5.启德与AIMEDBIO合作开发脑瘤ADC。启德医药与AIMEDBIO公司签署合作协议,将利用启德医药创新偶联技术平台,合作开发“First In Class”抗体偶联药物,用于治疗脑肿瘤。该项目预计2023年进入临床阶段,启德医药iLDC技术平台,将细胞毒素或其他类型的有效载荷与抗体进行位点特异性智能连续偶联,已成功开发出包括10多个创新药物的强大产品管线,其中多个品种进入或者接近临床阶段。
国际药讯
1.武田重组蛋白新冠疫苗在日获批上市。武田从诺瓦瓦克斯(Novavax)公司引进的新冠疫苗Nuvaxovid(NVX-CoV2373)获日本厚生劳动省批准上市,用于18岁及以上人群的初次和加强免疫。Nuvaxovid也是日本批准的首个重组蛋白新冠疫苗。在美国开展的试验中,NVX-CoV2373对中、重度新冠肺炎患者的保护效力达100%,整体效力为90.4%;在英国进行的试验中,新冠疫苗的效力为89.7%。
2.度普利尤单抗获欧盟批准用于儿童哮喘。赛诺菲IL-4/IL-13抑制剂Dupixent(度普利尤单抗)获欧盟扩大适用范围,用于附加维持治疗6~11岁、经中高剂量吸入型糖皮质激素联合另一种维持治疗药物治疗后控制不佳的2型炎症型重度哮喘患者。在一项Ⅲ期VOYAGE研究中,Dupixent联合标准疗法治疗组较安慰剂组重度哮喘年化率分别降低65%和59%;安全性结果与Dupixent在12岁及以上控制不佳的中重度哮喘患者中的已知安全性基本一致。
3.阿斯利康/第一三共重磅ADC获优先审评资格。阿斯利康与第一三共开发的HER2-ADC疗法Enhertu(trastuzumab deruxtecan)的补充上市申请(sBLA)获FDA授予优先审评资格,用于治疗HER2突变、不可切除或转移性非小细胞肺癌(NSCLC)经治患者。在一项Ⅱ期临床DESTINY-Lung01中,Enhertu达到54.9%的确认客观缓解率和92.3%的疾病控制率。此前,该新药已获FDA批准,三线治疗HER2阳性、无法切除或转移性乳腺癌,以及HER2阳性局部晚期或转移性胃癌。
4.再生元购进免疫肿瘤候选药物。再生元宣布将以约2.5亿美元的价格收购Checkmate公司,并获得该公司一款CpG-A寡脱氧核苷酸Toll样受体9激动剂Vidutolimod。该新药目前正在与其他治疗黑色素瘤、非黑色素瘤皮肤癌和头颈癌的药物开展联合用药研究。此外,再生元还计划与SpringWorks公司开展联合用药研究,共同评估再生元REGN5458与SpringWorks公司的小分子γ-分泌酶抑制剂nirogacestat联用治疗多发性骨髓瘤的效果。
5.AI药物临床设计公司完成B轮融资。Unlearn公司完成5000万美元的B轮融资,以进一步优化其构建人体临床试验TwinRCT的人工智能机器学习平台。TwinRCT是一种随机化临床试验,患者随机入组治疗组和对照组。基于历史对照数据,Unlearn机器学习模型会为每个患者构建一个数字化双胞胎,预测这名患者如果接受安慰剂的治疗,疾病的进展程度如何。Unlearn机器学习平台旨在让临床试验以更小的规模,更迅速地进行。
6.利妥昔单抗治疗ALL临床失败。柳叶刀血液病学上刊载的一篇最新研究论文显示,利妥昔单抗联合标准护理在治疗急性淋巴细胞白血病(ALL)患者的Ⅲ期临床UKALL14研究(NCT01085617)中未达到主要终点。中位随访为53.7个月时,标准疗法的3年EFS为43.7%(95%CI,37.8-49.5),而联合治疗的EFS为51.4%(45.4-57.1)(HR,0.85;95%CI 0.69-1.06;P =0.14),数据不具统计学意义的显著改善。联合治疗具有安全性,两组的AEs发生率没有差异。
医药热点
1.2022软科中国医药类大学排名出炉。4月19日,高等教育专业评价机构软科正式发布“2022软科中国大学排名”。综合性大学排名前三分别为清华大学、北京大学、浙江大学。此次共有85所高校登上医药类大学排名,位列前五的分别为北京协和医学院、首都医科大学、南京医科大学、哈尔滨医科大学、中国医科大学。
2.上海市第六人民医院安徽医院落地合肥。安徽省发改委在官网就《上海市第六人民医院安徽医院项目可行性研究报告》进行审批前公示。根据披露的信息,上海市第六人民医院安徽医院系上海交通大学附属第六人民医院和中国科大附属一院(安徽省立医院)合作共建,并依托中国科大附属一院北区创伤中心建设,是落地安徽的第二个国家区域医疗中心,设计床位1000张,预计在今年十月开诊。该项目总投资约14亿元,总建筑面积21万平方米。
3.美CDC:奥密克戎新变体正在美国站稳脚跟。美国疾控中心(CDC)19日表示,奥密克戎新变体正在美国站稳脚跟。目前,虽然奥密克戎BA.2亚型仍然是美国主要流行毒株,占美国新冠病毒变种的75%,但奥密克戎亚型变异株BA.2.12.1目前约占全美新增病例的五分之一。新的奥密克戎亚型变异株BA.2.12.1和BA.2.12可能是纽约州近期病例激增的原因。纽约州卫生官员估计,新的变异株传染性比BA.2高23%至27%。
评审动态
1. CDE新药受理情况(04月20日)
2. FDA新药获批情况(北美04月18日)
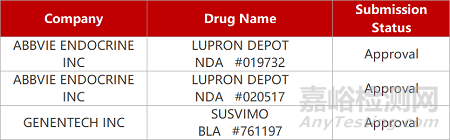

来源:药研发


