您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-08-19 23:36
近年来,人工智能(Artificial Intelligence,AI)在医疗器械方面的应用快速发展,我国已批准肺炎CT影像分诊、糖尿病视网膜病变眼底图像筛查、肺结节CT影像检测、心电图分析诊断、颅内出血CT影像分诊等方面的人工智能注册证近三十款。
在心电信号方面,有更多研究将人工智能技术应用于心电图分析诊断。《柳叶刀》曾报道了使用卷积神经网络算法的人工智能心电图仪,产品对180922名患者的649931份心电图进行房颤分析,其灵敏度为79.0%,特异性为79.5%,总体准确率为79.4%。国内也有AI心电产品对13949份心律失常临床进行分析,诊断17类心律失常事件的综合灵敏性、特异性和准确率分别为98.08%、99.84%和 99.84%。我国2018年心血管病现患人数约3.30亿。2020年心血管病住院患者院内病死率约是全因住院病死率的2倍。心血管病高患病率和高致死率预示着心电图诊断庞大的市场,人工智能心电产品值得更多的投入与研究。
01心电产品国内上市情况及发展趋势
据不完全统计,截止2022年3月13日,国内已注册心电产品(不含监护仪)约 558 个,包括心电电极 96个、心电图机170个、动态心电记录仪165个、心电软件73个、单导心电产品30个,具体分布图见图 1。
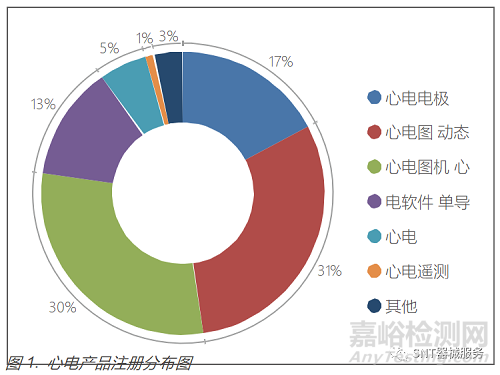
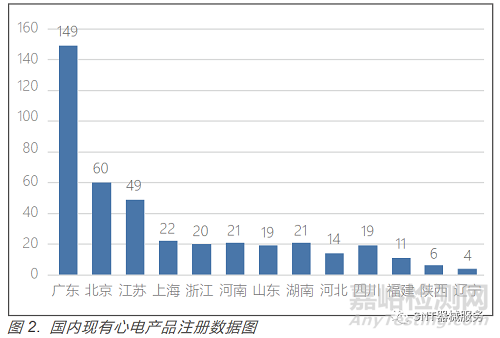
心电产品(不包括心电电极)主要分布在广东、北京、江苏、上海、浙江、湖南等医疗器械大省(市)(见图 2)。进 口心电产品约79个,心电电极 32 个。从企业申报注册产品看,心电产品的发展趋势为可穿戴(使用方便、舒适),微 型化(产品便携、体积小、重量轻),家用化(在日常生活中与智能手机联合使用,智能化(通过云计算、大数据、人工智能等技术进行筛查、自动分析)。
心电生产厂家数量繁多、产品设计各有特点,心电数据 存储格式多样、记录时间长短不一、采样率因厂家而异、标注方式方法不尽相同,为心电数据库的建立带来巨大的挑战。国内已上市三款AI心电产品(国械注准 20203070658、 国械注准 20203210080、国械注准 20213070059),部分企业也在陆续申报注册。AI心电产品注册过程还需要时刻关注法规变化。
02产品监管信息要求
根据《人工智能医用软件产品分类界定指导原则》,人工智能心电软件产品用于心律失常、心肌梗死、心室肥大等疾病的辅助诊断,应属于第三类医疗器械,需向国家药监局申报注册。产品名称应为通用名称,采用人工智能技术的产品宜使用辅助决策、辅助诊断、辅助检测、辅助分析等词语,建议命名为心电图辅助决策软件、动态心电图辅助决策软件、动态心电图辅助分析软件等。
注册证结构组成包括物理组成(如光盘、网络下载)和逻辑组成,功能模块需相应体现人工智能(如深度学习)字样,如深度学习心电分析模块。对于适用范围,需要体现心电数据类型,如静态心电图、动态心电图、单导心电图;使用人群,如成人、小儿、新生儿;核心临床功能,如心律失常、心肌缺血、ST-T异常分析;使用限制,如专业医生使用、分析结果仅作为诊断参考、分析结果不能单独用作临床诊疗决策依据等。
03产品性能研究
人工智能心电软件的产品技术要求基本思路可按照常规心电分析软件的指标进行编写,表 1 按《医疗器械软件注册审查指导原则》的模板列举人工智能心电分析软件性能指标的基本实例。建议在此基础上增加对人工智能算法准确性以及网络安全方面的指标。
现阶段,我国人工智能医疗器械标准化技术归口单位正在起草《人工智能医疗器械质量要求和评价》系列标准,现已完成术语、数据集通用要求、数据标注通用要求共3部分人工智能医疗器械标准的制定工作,生产企业可持续关注标准的发布实施。对于人工智能心电软件产品,有条件的企业,可制定相应的团体标准,以明确产品性能指标和算法性能测试方法。

04软件研究资料要求
软件研究资料包括基本的医疗器械软件研究资料(医疗器械软件描述文档)、网络安全研究报告(网络安全描述文档)、云计算服务研究资料。核心功能需明确人工智能 算法的算法名称、类型(公认成熟、全新算法)、临床功能 以及算法的出处(如文献)。
人工智能心电软件所涉及的算法一般包括心电波形处理、QRS 检测、AI 心搏分类算法等。算法研究资料的要求见《人工智能医疗器械注册审查指导原则》第六章,人工智能心电算法建议以算法为单位提交算法研究资料。现有应用广泛、权威的心电数据库包括 MIT- BIH、AHA、NST、CU、CES 数据库等,该类数据库也是心 电标准YY0782-2010和YY0885-2013中引用的用于验证性能的数据库。以上公开数据库,经必要评估或必要处理后,能用于AI心电软件的,可用于算法性能评估。对于软件确认测试的数据库,需要使用国内人群的心电数据,如国内第三 方数据库作为测评数据库。企业有必要说明测评数据库的充分性、适宜性和有效性。
05临床评价要求
辅助分析和诊断功能的心电图机、自动分析诊断功能的动态心电图记录仪,均不属于免于临床评价医疗器械目录的产品,需要提交临床评价资料。对于自动分析诊断功能的心电图,可在验证标准数据库的基础上,提供算法验证的研究资料,重点关注心电数据的来源,数据收集应考虑数据来源的合规性和多样性、目标疾病流行病学特征(与申报的适用范围匹配)、数据质量控制要求。
申报人工智能产品的,企业有必要说明AI算法与原有自动分析诊断算法的区别。如原有自动分析算法是基于临床试验或有足够的临床文献 / 使用数据,可考虑通过同品种医疗器械的方式,与原有分析诊断功能的心电图设备进行临床评价。对于算法的差异,可通过自建数据库的方式验证算法的准确性,以证明产品的算法是可靠的、有效的。如AI算法是全新算法,或者申报企业未有上市的自动分析诊断设备,有必要开展临床试验,临床试验可考虑回顾性研究。
06小结
心电产品发展迅速,应用广泛,监管部门有必要发布有关人工智能心电方面的标准、审评要点、指导原则,为审评和注册申报提供指导;审评部门需跟踪 FDA、欧盟、日本等国家有关人工智能心电的政策动态及人工智能心电产品获批情况,及时更新审评关注点,加强专业水平的提高。
人工智能心电生产厂家在申报人工智能心电分析软件产品时,生产企业要定位好产品的适用范围,制定好符合产品特点的性能指标,并提供包括数据库建立、算法验证等方面的研究资料,基于人工智能算法的成熟度以及国内人工智能心电产品注册现状选择合理的评价路径,在保证安全性、有效性的前提下,缩短注册周期,早日获批上市。

来源:广东省药监局审评认证中


