今日头条
青峰RNA聚合酶抑制剂报流感NDA。江西青峰药业与银杏树药业联合开发的核酸内切酶抑制剂1类化药GP681片的上市申请获CDE受理,用于治疗急性流行性感冒。GP681的作用靶点是流感病毒RNA聚合酶酸性蛋白。与传统抗流感药物不同,RNA聚合酶酸性蛋白抑制剂可更早干预病毒生命周期,直接阻碍成熟病毒的形成,且仅需服用40~80mg即可治愈流感。
国内药讯
1.全球首个lgA肾病新药中国获批上市。云顶新耀从Calliditas公司引进的布地奈德的创新口服靶向迟释制剂耐赋康®(Nefecon ®)获国家药监局批准上市,用于治疗原发性IgA肾病。在Ⅲ期NefIgArd试验中,与安慰剂相比,Nefecon治疗9个月后降低患者的尿蛋白肌酐比(UPCR)达27% (P=0.0003) ,UPCR较基线值减少了31%(vs5%)。该新药已在美国和欧盟获批上市,是全球首个IgA肾病的靶向治疗药物。
2.广生堂新冠口服药获批上市。广生堂旗下广生中霖抗新冠病毒口服小分子3CL蛋白酶抑制剂一类创新药阿泰特韦片(GST-HG171)/利托那韦片组合包装(商品名:泰中定)获国家药监局附条件批准上市,用于治疗轻型、中型新冠病毒感染( COVID -19)的成年患者。在临床试验(IIT)中,泰中定治疗组中位转阴时间为8.4天,Paxlovid对照组中位转阴时间为9.5天,安慰剂组中位转阴时间为10.3天。
3.武田P-CAB中国获批用于根除幽门螺杆菌。武田的富马酸伏诺拉生片获国家药监局批准新适应症,联合适当的抗生素用于根除幽门螺杆菌(HP)。富马酸伏诺拉生片是一款新型钾离子竞争性酸阻滞剂(P-CAB),此前已在中国获批用于反流性食管炎的初始治疗,以及用于反复发作的反流性食管炎患者的维持治疗。
4.康宁杰瑞PD-L1单抗拟纳入突破性品种。康宁杰瑞与思路迪医药开发的皮下注射PD-L1抗体恩沃利单抗注射液获CDE拟纳入突破性治疗品种,联合仑伐替尼治疗既往至少一线含铂化疗、非微卫星高度不稳定(MSI-H)/非错配修复基因缺陷型(dMMR)晚期子宫内膜癌经治患者。恩沃利单抗皮下注射可30秒内完成用药,为静脉不耐受的肿瘤患者需求提供解决方案。2021年11月,该产品已在国内获批上市,用于治疗不可切除或转移性MSI-H/dMMR晚期实体瘤。
5.北京炎明ALPK1激动剂获批临床。炎明生物自主研发的新型小分子先天免疫激动剂PTT-936获FDA临床许可。PTT-936是一款ALPK1(Alpha-kinase 1)激动剂,通过激活机体的免疫系统来进行肿瘤治疗。在临床前研究中,PTT-936单药或者联合免疫检查点抑制剂均具有良好的抗肿瘤活性;并且具有潜在的更大的治疗窗口。PTT-936有望为肿瘤患者带来全新的治疗方案。
6.复宏汉霖EGFR-ADC获批实体瘤临床。复宏汉霖靶向EGFR的ADC产品HLX42获FDA批准,即将在美国开展用于治疗晚期/转移性实体瘤的临床研究。在临床前研究中,HLX42已在几种对EGFR或TKI 耐药的CDX和PDX模型中显示出较强的肿瘤抑制作用;HLX42与奥希替尼联用在LU3075 PDX模型中具有协同抗肿瘤作用。今年10月,该新药已在国内获得临床许可。
国际药讯
1.强生IL-23R拮抗剂启动银屑病头对头III期研究。强生制药IL-23R拮抗剂JNJ-77242113在ClinicalTrials.gov上登记一项III期临床(NCT06143878),旨在对比安慰剂和TYK2变构抑制剂氘可来昔替尼,治疗中重度斑块状银屑病的有效性与安全性。在Ⅱ期临床中,与安慰剂相比,JNJ-77242113治疗组第16周时达到PASI75的患者比例显著更高(25mg QD 37.2%,50mg QD 58.1%,25mg BID 51.2%,100mg QD 65.1%,100mg BID 78.6%,安慰剂组为9.3%);两组发生不良事件的发生率相似。
2.创新多肽组合胶质瘤早期临床积极。Enterome公司多肽疗法EO2401联合PD-1抑制剂Opdivo,加或不加抗VEGF疗法贝伐珠单抗,用于治疗首次出现疾病进展/复发的胶质母细胞瘤(GBM)患者的Ⅰ/Ⅱ期临床结果积极。EO2401与纳武利尤单抗和贝伐珠单抗联合用药的中位生存期为14.5个月,中位疗效持续时间为13.1个月,中位无进展生存期(PFS)为5.5个月;12个月和18个月时的生存率分别为57.4%和43.1%的。EO2401组合耐受性良好。
3.葛兰素史克PD-1抗体Ⅰ期临床见刊。葛兰素史克PD-1抗体Jemperli(dostarlimab)治疗dMMR实体瘤的Ⅰ期GARNET研究结果公布于JAMA子刊。中位随访为27.7个月时,盲法独立中心审评评估的dMMR实体瘤客观缓解率为44.0%(95% CI,38.6%~49.6%);疾病控制率为58.4%;中位无进展生存期为6.9个月(95% CI,4.2~13.6个月);第6、12、24和36个月的无进展生存期概率分别为50.5%、45.8%、40.6%和39.7%。临床中,未发现新的安全性问题。
4.多重治疗个性化TCR-T实体瘤早期临床积极。TScan公司TCR-T产品T-Plex在SITC会议上公布其用于治疗实体瘤的Ⅰ期临床积极进展。该项试验旨在评估T-Plex单药、以及联合其他TCR进行多重、增强治疗实体瘤(包括非小细胞肺癌、黑色素瘤、头颈癌、卵巢癌以及宫颈癌)的安全性与初步疗效。T-Plex组合方案可有效克服肿瘤异质性和HLA杂合性缺失,提高TCR-T的长久治疗效果。目前,TScan目前正在对肿瘤具有的靶点和人类白细胞抗原(HLA)组合的患者进行筛选。
5.艾伯维起诉乌帕替尼仿制药制造商。近日,艾伯维针对其重磅产品JAK1抑制剂Rinvoq(乌帕替尼)已向特拉华州联邦法院提起诉讼,指控山德士、Hetero Labs、Aurobindo Pharma、Intas Pharmaceuticals和Sun Pharmaceutical等仿制药制造商侵犯Rinvoq的数十项专利。Rinvoq已获得FDA批准治疗克罗恩病、溃疡性结肠炎,类风湿性关节炎、银屑病关节炎、特应性皮炎、强直性脊柱炎以及中轴型脊柱关节炎等7项适应症。覆盖Rinvoq的美国物质成分专利预计将于2033年到期。
6.AI药物公司获3800万美元种子融资。Vivodyne公司完成总额3800万美元的种子融资,用于推进其发现管线和临床预测人工智能(AI)平台,该平台可识别新的治疗靶点,并通过直接在实验室培养的人体器官组织进行测试来预测患者对新药的应答。Vivodyne由宾夕法尼亚大学生物工程专家Andrei Georgescu博士和Dan Huh博士联合创立。此轮融资由Khosla Ventures领投,Kairos Ventures、CS Ventures、MBX Capital和Bison Ventures公司参与。
医药热点
1.2022年中国医院排行榜发布。11月25日,复旦版《2022年度中国医院综合排行榜》和《2022年度中国医院专科声誉排行榜》在上海发布。本次榜单评选新增疼痛学、运动医学和罕见病学三个学科,评审学科由42个增加至45个。北京协和医院、四川大学华西医院、中国人民解放军总医院、上海交通大学医学院附属瑞金医院和复旦大学附属中山医院位列《2022年度中国医院综合排行榜》前五名。
2.2025年全国三级中医医院儿科全覆盖。为充分发挥中医药在保障儿童健康中的重要作用,国家中医药管理局日前发布通知提出进一步加强中医医院(含中西医结合医院、少数民族医医院,下同)儿科建设,到2025年,实现全国三级中医医院、中西医结合医院儿科设置全覆盖,二级中医医院、中西医结合医院80%以上设置儿科。
3.四川省人民医院构建“双三元联动”新模式。为积极应对人口老龄化,四川省人民医院率先开展“互联网+护理服务”等延续性护理工作,构建了“住院—门诊—家庭”和“住院—社区—家庭”双三元联动的延续护理工作新模式,创新开展延续护理服务。目前该医院提供居家护理服务开展的业务覆盖9个专业14个项目,其中,以PICC、伤口造口、康复护理等专业为主。
评审动态
1. CDE新药受理情况(11月25日)
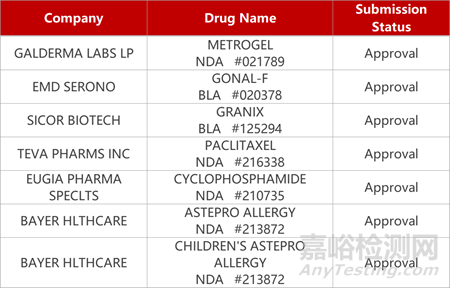
2. FDA新药获批情况(北美11月22日)